В кристаллографии полиморфизм — это явление, при котором соединение или элемент может кристаллизоваться в более чем одной кристаллической структуре .
Предыдущее определение развивалось на протяжении многих лет и до сих пор является предметом обсуждения. [1] [2] [3] Обсуждение определяющих характеристик полиморфизма включает в себя различие между типами переходов и структурных изменений, происходящих при полиморфизме, по сравнению с другими явлениями.
Фазовые переходы (изменения фаз), которые помогают описать полиморфизм, включают полиморфные переходы, а также переходы плавления и испарения. Согласно ИЮПАК , полиморфный переход — это «обратимый переход твердой кристаллической фазы при определенной температуре и давлении (точка инверсии) в другую фазу того же химического состава с другой кристаллической структурой». [4] Кроме того, Уолтер Маккроун описал фазы в полиморфном веществе как «различающиеся по кристаллической структуре, но идентичные в жидком или паровом состоянии». Маккроун также определяет полиморф как «кристаллическую фазу данного соединения, возникающую в результате возможности по крайней мере двух различных расположений молекул этого соединения в твердом состоянии». [5] [6] Эти определяющие факты подразумевают, что полиморфизм включает изменения физических свойств, но не может включать химические изменения. Некоторые ранние определения не делают этого различия.
Исключение химических изменений из тех изменений, которые допустимы во время полиморфного перехода, определяет полиморфизм. Например, изомеризация часто может приводить к полиморфным переходам. Однако таутомерия (динамическая изомеризация) приводит к химическим изменениям, а не к полиморфизму. [1] Кроме того, аллотропия элементов и полиморфизм были связаны исторически. Однако аллотропы элемента не всегда являются полиморфами. Распространенным примером являются аллотропы углерода , которые включают графит, алмаз и лондсдейлит. Хотя все три формы являются аллотропами, графит не является полиморфом алмаза и лондсдейлита. Изомеризация и аллотропия — это только два из явлений, связанных с полиморфизмом. Для получения дополнительной информации об идентификации полиморфизма и его отличии от других явлений см. обзор Брога и др. [2]
Также полезно отметить, что материалы с двумя полиморфными фазами можно назвать диморфными , с тремя полиморфными фазами – триморфными и т. д. [7]
Полиморфизм имеет практическое значение для фармацевтических препаратов , агрохимикатов , пигментов , красителей , пищевых продуктов и взрывчатых веществ .
Ранние записи об открытии полиморфизма приписывают Эйльхарду Митчерлиху и Йенсу Якобу Берцелиусу их исследования фосфатов и арсенатов в начале 1800-х годов. Исследования включали измерение углов раздела кристаллов, чтобы показать, что химически идентичные соли могут иметь две разные формы. Первоначально Митчерлих назвал это открытие изоморфизмом. [8] Измерение плотности кристаллов также использовалось Вильгельмом Оствальдом и выражалось в соотношении Оствальда. [9]
Развитие микроскопа улучшило наблюдения полиморфизма и помогло Морицу Людвигу Франкенхайму в его исследованиях в 1830-х годах. Он смог продемонстрировать методы, вызывающие изменения кристаллической фазы, и формально обобщил свои выводы о природе полиморфизма. Вскоре после этого в обиход вошел более сложный поляризованный световой микроскоп , который обеспечил лучшую визуализацию кристаллических фаз, позволяя кристаллографам различать различные полиморфы. Горячий столик был изобретен и установлен на поляризованном световом микроскопе Отто Леманном примерно в 1877 году. Это изобретение помогло кристаллографам определять точки плавления и наблюдать полиморфные переходы. [8]
Хотя использование микроскопов с горячим столиком продолжалось в течение 1900-х годов, термические методы также стали широко использоваться для наблюдения за тепловым потоком, который происходит во время фазовых изменений, таких как плавление и полиморфные переходы. Один из таких методов, дифференциальная сканирующая калориметрия (ДСК), продолжает использоваться для определения энтальпии полиморфных переходов. [8]
В 20 веке рентгеновская кристаллография стала широко использоваться для изучения кристаллической структуры полиморфов. Для получения измерений кристаллической ячейки используются как методы рентгеновской дифракции на монокристаллах, так и методы порошковой рентгеновской дифракции. Каждый полиморф соединения имеет уникальную кристаллическую структуру. В результате разные полиморфы будут давать разные картины рентгеновской дифракции. [8]
Методы колебательной спектроскопии стали использоваться для исследования полиморфизма во второй половине двадцатого века и стали более широко использоваться по мере совершенствования оптических, компьютерных и полупроводниковых технологий. Эти методы включают инфракрасную (ИК) спектроскопию , терагерцовую спектроскопию и рамановскую спектроскопию . Среднечастотная ИК и рамановская спектроскопия чувствительны к изменениям в моделях водородных связей . Такие изменения впоследствии могут быть связаны со структурными различиями. Кроме того, терагерцовая и низкочастотная рамановская спектроскопия выявляют колебательные моды, возникающие в результате межмолекулярных взаимодействий в кристаллических твердых телах. Опять же, эти колебательные моды связаны со структурой кристалла и могут использоваться для выявления различий в трехмерной структуре среди полиморфов. [10]
Вычислительная химия может использоваться в сочетании с методами колебательной спектроскопии для понимания истоков колебаний в кристаллах. [10] Сочетание методов обеспечивает подробную информацию о кристаллических структурах, подобную той, что может быть получена с помощью рентгеновской кристаллографии. В дополнение к использованию вычислительных методов для улучшения понимания спектроскопических данных, новейшей разработкой в идентификации полиморфизма в кристаллах является область предсказания кристаллической структуры . Эта техника использует вычислительную химию для моделирования образования кристаллов и прогнозирования существования определенных полиморфов соединения до того, как они будут экспериментально обнаружены учеными. [11] [12]
Многие соединения проявляют полиморфизм. Утверждается, что «каждое соединение имеет различные полиморфные формы, и что, в общем, число форм, известных для данного соединения, пропорционально времени и деньгам, потраченным на исследование этого соединения». [13] [5] [14]
Это явление было открыто в 1832 году Фридрихом Вёлером и Юстусом фон Либихом . Они наблюдали, как шелковистые иглы свежекристаллизованного бензамида медленно превращались в ромбические кристаллы. [15] Современный анализ [16] выделяет три полиморфа для бензамида: наименее стабильная, образованная мгновенным охлаждением, — это орторомбическая форма II. За этим типом следует моноклинная форма III (наблюдаемая Вёлером/Либихом). Наиболее стабильной формой является моноклинная форма I. Механизмы водородных связей одинаковы для всех трех фаз; однако они сильно различаются по своим пи-пи взаимодействиям.
В 2006 году был открыт новый полиморф малеиновой кислоты , спустя 124 года после изучения первой кристаллической формы. Малеиновая кислота производится в промышленных масштабах в химической промышленности. Она образует соль, используемую в медицине. Новый тип кристалла получается, когда сокристалл кофеина и малеиновой кислоты (2:1) растворяется в хлороформе и растворитель медленно испаряется. В то время как форма I имеет моноклинную пространственную группу P 2 1 / c , новая форма имеет пространственную группу Pc . Оба полиморфа состоят из слоев молекул, соединенных посредством водородных связей групп карбоновой кислоты : в форме I слои чередуются относительно чистого дипольного момента , тогда как в форме II слои ориентированы в одном направлении. [17]
После 125 лет исследований 1,3,5-тринитробензол дал второй полиморф. Обычная форма имеет пространственную группу Pbca , но в 2004 году был получен второй полиморф в пространственной группе Pca 2 1 , когда соединение кристаллизовалось в присутствии добавки, трисиндана. Этот эксперимент показывает, что добавки могут вызывать появление полиморфных форм. [18]
Акридин был получен в виде восьми полиморфов [19] , а арипипразол — в виде девяти. [20] Рекорд по наибольшему количеству хорошо охарактеризованных полиморфов принадлежит соединению, известному как ROY . [21] [22] Глицин кристаллизуется как в виде моноклинных , так и в виде гексагональных кристаллов . Полиморфизм в органических соединениях часто является результатом конформационного полиморфизма . [23]
Элементы, включая металлы, могут проявлять полиморфизм. Аллотропия — это термин, используемый при описании элементов, имеющих различные формы, и он обычно используется в области металлургии. Некоторые (но не все) аллотропы также являются полиморфами. Например, у железа есть три аллотропа, которые также являются полиморфами. Альфа-железо, которое существует при комнатной температуре, имеет форму ОЦК. Выше 910 градусов существует гамма-железо, которое имеет форму ГЦК. Выше 1390 градусов существует дельта-железо с формой ОЦК. [24]
Другим металлическим примером является олово, которое имеет две аллотропные модификации, которые также являются полиморфами. При комнатной температуре бета-олово существует в виде белой тетрагональной формы. При охлаждении ниже 13,2 градусов образуется альфа-олово, которое имеет серый цвет и форму кубического алмаза. [24]
Классическим примером неметалла, проявляющего полиморфизм, является углерод. Углерод имеет множество аллотропов, включая графит, алмаз и лондсдейлит. Однако не все они являются полиморфами друг друга. Графит не является полиморфом алмаза и лондсдейлита, поскольку он химически отличается, имея гибридизированную связь sp 2. Алмаз и лондсдейлит химически идентичны, оба имеют гибридизированную связь sp 3 , и они отличаются только своими кристаллическими структурами, что делает их полиморфами. Кроме того, графит имеет две полиморфные модификации: гексагональную (альфа) форму и ромбоэдрическую (бета) форму. [24]
Полиморфизм в бинарных оксидах металлов привлек большое внимание, поскольку эти материалы имеют значительную экономическую ценность. Один набор известных примеров имеет состав SiO 2 , который образует множество полиморфов. Важными из них являются: α-кварц , β-кварц , тридимит , кристобалит , моганит , коэсит и стишовит . [25] [26]
Классическим примером полиморфизма является пара минералов кальцит , который является ромбоэдрическим, и арагонит , который является орторомбическим. Оба являются формами карбоната кальция . [24] Третья форма карбоната кальция — ватерит, который является гексагональным и относительно нестабильным. [28]
β-HgS осаждается в виде черного твердого вещества, когда соли Hg(II) обрабатываются H 2 S. При осторожном нагревании суспензии черный полиморф преобразуется в красную форму. [29]
Согласно правилу Оствальда , обычно менее стабильные полиморфы кристаллизуются раньше стабильной формы. Концепция основана на идее, что нестабильные полиморфы больше напоминают состояние в растворе и, таким образом, кинетически выгодны. Основополагающий случай волокнистого против ромбического бензамида иллюстрирует этот случай. Другой пример дают два полиморфа диоксида титана . [27] Тем не менее, известны системы, такие как метацетамол , где только узкая скорость охлаждения благоприятствует получению метастабильной формы II. [30]
Полиморфы имеют разную стабильность. Некоторые быстро преобразуются при комнатной (или любой) температуре. Большинство полиморфов органических молекул отличаются только на несколько кДж/моль по энергии решетки. Примерно 50% известных пар полиморфов отличаются менее чем на 2 кДж/моль, а различия в стабильности более чем на 10 кДж/моль редки. [31] Стабильность полиморфов может меняться в зависимости от температуры [32] [33] [34] или давления. [35] [36] Важно, что структурная и термодинамическая стабильность различны. Термодинамическая стабильность может быть изучена с использованием экспериментальных или вычислительных методов. [37] [38]
Полиморфизм зависит от деталей кристаллизации . Растворитель во всех отношениях влияет на природу полиморфа, включая концентрацию, другие компоненты растворителя, т. е. виды, которые ингибируют или способствуют определенным моделям роста. [39] Решающим фактором часто является температура растворителя, из которого осуществляется кристаллизация . [40]
Метастабильные полиморфы не всегда воспроизводимо получаются, что приводит к случаям « исчезающих полиморфов », обычно с негативными последствиями для закона и бизнеса. [13] [11] [41]
Препараты получают одобрение регулирующих органов и патенты только на один полиморф.
В классическом патентном споре GlaxoSmithKline защищала свой патент на полиморф типа II активного ингредиента препарата Зантак от конкурентов, в то время как срок действия патента на полиморф типа I уже истек. [42]
Полиморфизм в препаратах также может иметь прямые медицинские последствия, поскольку скорость растворения зависит от полиморфа. Полиморфную чистоту образцов препаратов можно проверить с помощью таких методов, как порошковая рентгеновская дифракция, ИК/рамановская спектроскопия, а в некоторых случаях — с использованием различий в их оптических свойствах. [43]
Известные случаи до 2015 года обсуждаются в обзорной статье Бучара, Ланкастера и Бернстайна. [11]
Дибензоксазепины
Многопрофильные исследования, включающие экспериментальные и вычислительные подходы, были применены к фармацевтическим молекулам для облегчения сравнения их твердотельных структур. В частности, это исследование было сосредоточено на изучении того, как изменения в молекулярной структуре влияют на молекулярную конформацию, мотивы упаковки, взаимодействия в полученных кристаллических решетках и степень твердотельного разнообразия этих соединений. Результаты подчеркивают ценность исследований предсказания кристаллической структуры и расчетов PIXEL в интерпретации наблюдаемого твердотельного поведения и количественной оценке межмолекулярных взаимодействий в упакованных структурах и выявлении ключевых стабилизирующих взаимодействий. Экспериментальный скрининг дал 4 физические формы для клозапина по сравнению с 60 различными физическими формами для оланзапина . Результаты экспериментального скрининга клозапина согласуются с его энергетическим ландшафтом кристалла, который подтверждает, что никакая альтернативная упаковка не является термодинамически конкурентоспособной для экспериментально полученной структуры. В то время как в случае оланзапина , ландшафт кристаллической энергии подчеркивает, что обширный экспериментальный скрининг, вероятно, не обнаружил все возможные полиморфы оланзапина , и дальнейшее разнообразие твердых форм может быть направлено на лучшее понимание роли кинетики в его кристаллизации. Исследования CSP смогли предложить объяснение отсутствия центросимметричного димера в безводном клозапине . Расчеты PIXEL для всех кристаллических структур клозапина показали, что подобно оланзапину , энергия межмолекулярного взаимодействия в каждой структуре также доминирует Ed. Несмотря на сходство молекулярной структуры между амоксапином и локсапином (молекулы в группе 2), кристаллическая упаковка, наблюдаемая в полиморфах локса, значительно отличается от амоксапина . Комбинированное экспериментальное и вычислительное исследование показало, что метильная группа в локсапине оказывает значительное влияние на увеличение диапазона доступных твердых форм и благоприятствует различным альтернативным расположениям упаковки. Исследования CSP снова помогли объяснить наблюдаемое твердотельное разнообразие локсапина и амоксапина. Расчеты PIXEL показали, что в отсутствие сильных водородных связей слабые водородные связи, такие как C–H...O, C–H...N и дисперсионные взаимодействия, играют ключевую роль в стабилизации кристаллической решетки обеих молекул. Эффективная кристаллическая упаковка амоксапина, по-видимому, способствует его мономорфному поведению по сравнению со сравнительно менее эффективной упаковкой локсапинамолекулы в обоих полиморфах. Сочетание экспериментальных и вычислительных подходов обеспечило более глубокое понимание факторов, влияющих на структуру твердого тела и разнообразие в этих соединениях. Поверхности Хиршфельда с использованием Crystal Explorer представляют собой еще один способ изучения режимов упаковки и межмолекулярных взаимодействий в молекулярных кристаллах. Влияние изменений в малых заместителях на форму и распределение электронов также можно исследовать путем сопоставления общей электронной плотности с электростатическим потенциалом для молекул в газовой фазе. Это позволяет напрямую визуализировать и сравнивать общую форму, богатые электронами и дефицитные по электронам области внутри молекул. Форму этих молекул можно дополнительно исследовать, чтобы изучить ее влияние на разнообразное твердотельное разнообразие. [44]
Позаконазол
Первоначальные формулы позаконазола на рынке, лицензированные как Ноксафил, были сформулированы с использованием формы I позаконазола . Открытие полиморфов позаконазола быстро увеличивалось и привело к большому количеству исследований в области кристаллографии позаконазола . Сольват метанола и сокристалл 1,4-диоксана были добавлены в Кембриджскую структурную базу данных (CSD). [45]
Противовирусный препарат ритонавир существует в виде двух полиморфов, которые сильно различаются по эффективности. Такие проблемы были решены путем переформулирования лекарства в гелевые капсулы и таблетки, а не в оригинальные капсулы. [46]
Была только одна доказанная полиморфная форма I аспирина , хотя существование другого полиморфа обсуждалось с 1960-х годов, и в одном отчете от 1981 года сообщалось, что при кристаллизации в присутствии ангидрида аспирина дифрактограмма аспирина имеет слабые дополнительные пики. Хотя в то время это было отклонено как простая примесь, это было, оглядываясь назад, форма II аспирина. [11]
Форма II была обнаружена в 2005 году [47] [48] после попытки совместной кристаллизации аспирина и леветирацетама из горячего ацетонитрила .
В форме I пары молекул аспирина образуют центросимметричные димеры через ацетильные группы с (кислотным) метильным протоном и карбонильными водородными связями . В форме II каждая молекула аспирина образует те же самые водородные связи, но с двумя соседними молекулами вместо одной. Что касается водородных связей, образованных группами карбоновой кислоты , оба полиморфа образуют идентичные димерные структуры. Полиморфы аспирина содержат идентичные 2-мерные секции и поэтому более точно описываются как политипы. [49]
Чистую форму II аспирина можно получить, добавив в смесь 15% аспирина безводного. [11]
Порошок парацетамола имеет плохие компрессионные свойства, что затрудняет изготовление таблеток. Был найден второй полиморф с более подходящими компрессионными свойствами. [50]
Ацетат кортизона существует по меньшей мере в пяти различных полиморфных модификациях, четыре из которых нестабильны в воде и переходят в стабильную форму.
Карбамазепин , эстроген , пароксетин [51] и хлорамфеникол также демонстрируют полиморфизм.
Пиразинамид имеет по крайней мере 4 полиморфа. [52] Все они трансформируются в стабильную α-форму при комнатной температуре при хранении или механической обработке. [53] Недавние исследования доказывают, что α-форма термодинамически стабильна при комнатной температуре. [32] [34]
Политипы являются особым случаем полиморфов, где множественные плотноупакованные кристаллические структуры отличаются только в одном измерении. Политипы имеют идентичные плотноупакованные плоскости, но различаются последовательностью укладки в третьем измерении, перпендикулярном этим плоскостям. Карбид кремния (SiC) имеет более 170 известных политипов , хотя большинство из них редки. Все политипы SiC имеют практически одинаковую плотность и свободную энергию Гиббса . Наиболее распространенные политипы SiC показаны в Таблице 1.
Таблица 1 : Некоторые политипы SiC. [54]
Вторая группа материалов с различными политипами — это дихалькогениды переходных металлов , слоистые материалы, такие как дисульфид молибдена (MoS2 ) . Для этих материалов политипы оказывают более выраженное влияние на свойства материала, например, для MoS2 политип 1T имеет металлический характер, в то время как форма 2H является более полупроводниковой. [55] Другим примером является дисульфид тантала , где встречаются как обычные политипы 1T, так и 2H, но также и более сложные типы «смешанной координации», такие как 4Hb и 6R, где смешаны слои тригональной призматической и октаэдрической геометрии. [56] Здесь политип 1T демонстрирует волну плотности заряда с выраженным влиянием на проводимость в зависимости от температуры, в то время как политип 2H демонстрирует сверхпроводимость .
ZnS и CdI 2 также являются политипичными. [57] Было высказано предположение, что этот тип полиморфизма обусловлен кинетикой, при которой винтовые дислокации быстро воспроизводят частично неупорядоченные последовательности периодическим образом.
_and_monotropic_behaviour_(right)..jpg/440px-Energy-Temperature_diagrams_of_a_system_exhibiting_two_polymorphic_forms_with_enantiotropic_behaviour_(left)_and_monotropic_behaviour_(right)..jpg)
С точки зрения термодинамики , различают два типа полиморфного поведения. Для монотропной системы графики свободных энергий различных полиморфов в зависимости от температуры не пересекаются до тех пор, пока все полиморфы не расплавятся. В результате любой переход от одного полиморфа к другому ниже точки плавления будет необратимым. Для энантиотропной системы график свободной энергии в зависимости от температуры показывает точку пересечения до различных точек плавления. [58] Также может быть возможным взаимозаменяемое преобразование между двумя полиморфами путем нагревания или охлаждения или посредством физического контакта с полиморфом с более низкой энергией.
Простая модель полиморфизма заключается в моделировании свободной энергии Гиббса шарообразного кристалла как . Здесь первый член — это поверхностная энергия, а второй член — объемная энергия. Оба параметра . Функция достигает максимума перед падением, пересекая ноль при . Для того чтобы кристаллизоваться, шар кристалла должен преодолеть энергетический барьер в части энергетического ландшафта. [59]
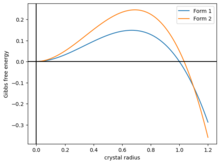
Теперь предположим, что есть два вида кристаллов с разными энергиями и , и если они имеют ту же форму, что и на рисунке 2, то две кривые пересекаются в некоторой точке . Тогда система имеет три фазы:
Если кристалл растет медленно, он может кинетически застрять в форме 1.