Протеородопсин (также известный как pRhodopsin ) — это семейство трансмембранных белков , которые используют ретиналь в качестве хромофора для светоопосредованной функциональности, в данном случае протонного насоса . pRhodopsin обнаружен в морских планктонных бактериях , археях и эукариотах ( протах ), но впервые был обнаружен у бактерий. [1] [2] [3] [4]
Его название происходит от протеобактерий (теперь называемых Pseudomonadota ), которые были названы в честь древнегреческого Πρωτεύς ( Протей ), раннего морского бога, упомянутого Гомером как « Старик моря », Ῥόδος ( родон ) для « розы », из-за ее розоватого цвета, и ὄψις ( опсис ) для «зрения». Некоторые члены семейства, гомологичные родопсин -подобные пигменты , то есть бактериородопсин (которых существует более 800 типов), имеют сенсорные функции , такие как опсины , неотъемлемые для зрительной фототрансдукции . Многие из этих сенсорных функций неизвестны — например, функция нейропсина в сетчатке человека. [5] Известно, что члены имеют различные спектры поглощения, включая зеленый и синий видимый свет . [6] [7] [8] [9] [10] [11]
Протеородопсин (PR или pRhodopsin) был впервые обнаружен в 2000 году в бактериальной искусственной хромосоме из ранее некультивированных морских Gammaproteobacteria , до сих пор упоминаемых только по их риботипическим метагеномным данным , SAR86. Было обнаружено, что больше видов Gammaproteobacteria, как грамположительных , так и грамотрицательных , экспрессируют этот белок. [1]
Образцы бактерий, экспрессирующих протеородопсин, были получены из восточной части Тихого океана , центральной части северной части Тихого океана и южного океана , Антарктиды . [12] Впоследствии гены вариантов протеородопсина были идентифицированы в образцах из Средиземного моря , Красного моря , Саргассова моря , Японского моря и Северного моря . [4] [6]
Варианты протеородопсина не распространяются случайным образом, а рассеиваются вдоль градиентов глубины на основе максимальной настройки поглощения конкретной последовательности голопротеина ; это в основном связано с электромагнитным поглощением водой , которое создает градиенты длины волны относительно глубины. Oxyrrhis marina — это простейший динофлагеллят с поглощающим зеленый протеородопсином (результат группы L109), который существует в основном в мелководных приливных бассейнах и на берегах, где все еще доступен зеленый свет. Karlodinium micrum , другой динофлагелат, экспрессирует настроенный на синий протеородопсин (E109), что может быть связано с его глубоководными вертикальными миграциями . [3] Первоначально считалось, что O. marina является гетеротрофом , однако протеородопсин вполне может принимать участие в функционально значимой манере, поскольку он был наиболее обильно экспрессируемым ядерным геном и, кроме того, неравномерно распределен в организме, что предполагает некоторую функцию мембраны органеллы . Ранее единственными известными эукариотическими белками, преобразующими солнечную энергию, были Фотосистема I и Фотосистема II . Была выдвинута гипотеза, что латеральный перенос генов — это метод, с помощью которого протеородопсин проник в многочисленные типы. Бактерии, археи и эукариоты — все колонизируют фотическую зону , где они появляются на свету; Протеородопсин смог распространиться через эту зону, но не в другие части водной толщи. [3] [4] [9] [13] [14]
Протеородопсин принадлежит к семейству подобных ретинилиденовых белков, наиболее похожих на его архейных гомологов галородопсин и бактериородопсин. Сенсорный родопсин был открыт Францем Кристианом Боллем в 1876 году. [11] [15] Бактериородопсин был открыт в 1971 году и назван в 1973 году и в настоящее время известно, что он существует только в археях, а не в бактериях. [16] Галородопсин был впервые открыт и назван в 1977 году. [17] Бактериородопсин и Галородопсин оба существуют только в археях, тогда как протеородопсин охватывает бактерии, археи и эукариоты. Протеородопсин имеет семь трансмембранных α-спиралей ретиналя, ковалентно связанных с помощью механизма оснований Шиффа с остатком лизина в седьмой спирали (спираль G). Бактериородопсин, как и протеородопсин, является светочувствительным протонным насосом. Сенсорный родопсин является G-сопряженным белком, участвующим в зрении. [1] [17]
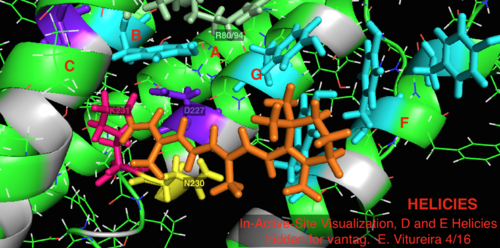
По сравнению с его более известным архейным гомологом бактериородопсином, большинство остатков активного центра, известных своей важностью для механизма бактериородопсина, сохраняются в протеородопсине. Однако сходство последовательностей не является существенно сохраненным ни от гало-, ни от бактериородопсина. Гомологи остатков активного центра Arg 82, Asp 85 (первичный акцептор протонов ), Asp 212 и Lys 216 ( сайт связывания основания Шиффа ретинального ) в бактериородопсине сохраняются как Arg94, Asp97, Asp227 и Lys231 в протеородопсине. Однако в протеородопсине нет остатков карбоновой кислоты , непосредственно гомологичных Glu 194 или Glu204 бактериородопсина (или Glu 108 и 204 в зависимости от варианта бакродопсина), которые, как полагают, участвуют в пути высвобождения протонов на внеклеточной поверхности. Однако Asp97 и Arg94 могут заменить эту функциональность без близкого расположения остатков, как в бактериородопсине. Кафедра химии Сиракузского университета убедительно показала, что Asp97 не может быть группой высвобождения протонов, поскольку высвобождение происходило при вынужденных условиях, при которых группа аспарагиновой кислоты оставалась протонированной. [18] [19] [20] [21]
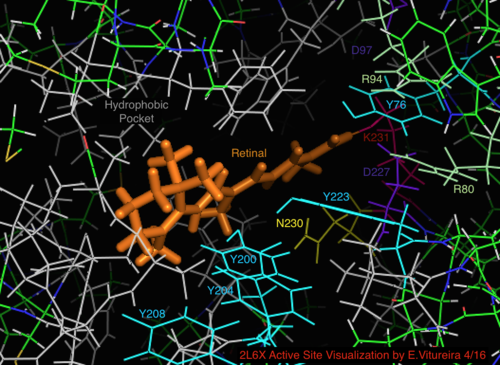
Семейство галопротеинов родопсина объединяет лиганд ретиналь, один из многих типов витамина А. Ретиналь представляет собой сопряженный полиненасыщенный хромофор ( полиен ), получаемый из плотоядной пищи или по каротиновому пути ( β-каротин 15,15'-моноксигеназа ).
Протеородопсин функционирует во всех океанах Земли как работающий под действием света насос H+, по механизму, аналогичному механизму бактериородопсина. Как и в бактериородопсине, ретинальный хромофор протеородопсина ковалентно связан с апопротеином через протонированное основание Шиффа в Lys231. Конфигурация ретинального хромофора в нефотолизированном протеородопсине преимущественно полностью транс, [18] и изомеризуется в 13-цис при освещении светом. Было предложено несколько моделей полного фотоцикла протеородопсина, основанных на FTIR и УФ-видимой спектроскопии ; они напоминают установленные модели фотоцикла для бактериородопсина. [18] [20] [21] [22] Полные фотосистемы на основе протеородопсина были обнаружены и экспрессированы в E. coli, что дало им дополнительную способность к световому градиенту энергии для генерации АТФ без внешней потребности в ретинале или предшественниках; вместе с геном PR пять других белков кодируют путь биосинтеза фотопигмента. [23]
Если ген протеородопсина вставить в E. coli и дать ретиналь этим модифицированным бактериям , то они включат пигмент в свою клеточную мембрану и будут качать H+ в присутствии света. Глубокий фиолетовый цвет является репрезентативным для явно трансформированных колоний из-за поглощения света. Протонные градиенты могут использоваться для питания других структур мембранных белков или для подкисления органеллы типа везикул. [1] Было также продемонстрировано, что протонный градиент, создаваемый протеородопсином, может использоваться для генерации АТФ. [23]