
В химии раствор — это особый тип однородной смеси, состоящей из двух или более веществ. В такой смеси растворенное вещество — это вещество, растворенное в другом веществе, известном как растворитель . Если силы притяжения между частицами растворителя и растворенного вещества больше, чем силы притяжения, удерживающие частицы растворенного вещества вместе, частицы растворителя раздвигают частицы растворенного вещества и окружают их. Эти окруженные частицы растворенного вещества затем отдаляются от твердого растворенного вещества и выходят в раствор. Процесс смешивания раствора происходит в масштабе, где задействованы эффекты химической полярности , что приводит к взаимодействиям, которые характерны для сольватации . Раствор обычно имеет состояние растворителя, когда растворитель составляет большую часть смеси, как это обычно и бывает. Одним из важных параметров раствора является концентрация , которая является мерой количества растворенного вещества в данном количестве раствора или растворителя. Термин « водный раствор » используется, когда одним из растворителей является вода . [1]
Гомогенный означает, что компоненты смеси образуют одну фазу. Гетерогенный означает, что компоненты смеси находятся в разных фазах. Свойства смеси (такие как концентрация, температура и плотность) могут быть равномерно распределены по объему, но только при отсутствии явлений диффузии или после их завершения. Обычно растворителем считается вещество, присутствующее в наибольшем количестве. Растворителями могут быть газы, жидкости или твердые тела. Один или несколько компонентов, присутствующих в растворе, кроме растворителя, называются растворенными веществами. Раствор имеет то же физическое состояние , что и растворитель.
Если растворитель является газом , то при заданном наборе условий растворяются только газы (неконденсирующиеся) или пары (конденсирующиеся). Примером газообразного раствора является воздух (кислород и другие газы, растворенные в азоте). Поскольку взаимодействия между газообразными молекулами почти не играют роли, неконденсирующиеся газы образуют довольно тривиальные растворы. В литературе их даже не классифицируют как растворы, а просто рассматривают как однородные смеси газов. Броуновское движение и постоянное молекулярное перемешивание молекул газа гарантируют однородность газообразных систем. Неконденсирующиеся газовые смеси (например, воздух/CO 2 или воздух/ксенон) не расслаиваются самопроизвольно и не осаждаются, а отчетливо стратифицированы и разделяют газовые слои в зависимости от их относительной плотности . Диффузионные силы эффективно противодействуют силам гравитации в нормальных условиях, преобладающих на Земле. Случай конденсирующихся паров иной: как только достигается давление насыщенного пара при заданной температуре, избыток пара конденсируется в жидкое состояние .
Если растворитель — жидкость , то почти все газы, жидкости и твердые вещества могут быть растворены. Вот несколько примеров:
Контрпримерами служат жидкие смеси, которые не являются гомогенными : коллоиды , суспензии , эмульсии не считаются растворами.
Жидкости организма являются примерами сложных жидких растворов, содержащих множество растворенных веществ. Многие из них являются электролитами, поскольку содержат ионы растворенных веществ, такие как калий . Кроме того, они содержат молекулы растворенных веществ, такие как сахар и мочевина . Кислород и углекислый газ также являются важными компонентами химии крови , где значительные изменения их концентраций могут быть признаком тяжелой болезни или травмы.
Если растворитель является твердым веществом , то в нем могут растворяться газы, жидкости и твердые вещества.
Способность одного соединения растворяться в другом соединении называется растворимостью . [ необходимо уточнение ] Когда жидкость может полностью раствориться в другой жидкости, две жидкости являются смешивающимися . Два вещества, которые никогда не могут смешаться, чтобы образовать раствор, называются несмешивающимися .
Все растворы имеют положительную энтропию смешивания. Взаимодействия между различными молекулами или ионами могут быть энергетически выгодными или нет. Если взаимодействия невыгодны, то свободная энергия уменьшается с увеличением концентрации растворенного вещества. В какой-то момент потеря энергии перевешивает прирост энтропии, и больше никаких частиц растворенного вещества [ необходимо разъяснение ] не может быть растворено; раствор называется насыщенным . Однако точка, в которой раствор может стать насыщенным, может значительно меняться в зависимости от различных факторов окружающей среды, таких как температура , давление и загрязнение. Для некоторых комбинаций растворенное вещество-растворитель перенасыщенный раствор можно приготовить, повысив растворимость (например, путем повышения температуры) для растворения большего количества растворенного вещества, а затем понизив ее (например, путем охлаждения).
Обычно, чем выше температура растворителя, тем больше данного твердого растворенного вещества он может растворить. Однако большинство газов и некоторые соединения демонстрируют растворимость, которая уменьшается с повышением температуры. Такое поведение является результатом экзотермической энтальпии раствора . Некоторые поверхностно-активные вещества демонстрируют такое поведение. Растворимость жидкостей в жидкостях, как правило, менее чувствительна к температуре, чем растворимость твердых веществ или газов.
Физические свойства соединений, такие как температура плавления и температура кипения, изменяются при добавлении других соединений. Вместе они называются коллигативными свойствами . Существует несколько способов количественного определения количества одного соединения, растворенного в других соединениях, которые вместе называются концентрацией . Примерами являются молярность , объемная доля и мольная доля .
Свойства идеальных растворов можно рассчитать с помощью линейной комбинации свойств его компонентов. Если и растворенное вещество, и растворитель присутствуют в равных количествах (например, в растворе 50% этанола и 50% воды), то понятия «растворенное вещество» и «растворитель» становятся менее значимыми, но вещество, которое чаще используется в качестве растворителя, обычно обозначается как растворитель (в данном примере вода).
В принципе, все типы жидкостей могут вести себя как растворители: жидкие благородные газы , расплавленные металлы, расплавленные соли, расплавленные ковалентные сети и молекулярные жидкости. В практике химии и биохимии большинство растворителей являются молекулярными жидкостями. Их можно разделить на полярные и неполярные в зависимости от того, обладают ли их молекулы постоянным электрическим дипольным моментом . Другое различие заключается в том, могут ли их молекулы образовывать водородные связи ( протонные и апротонные растворители). Вода , наиболее часто используемый растворитель, является как полярной, так и поддерживает водородные связи.
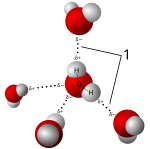
Соли растворяются в полярных растворителях, образуя положительные и отрицательные ионы, которые притягиваются к отрицательным и положительным концам молекулы растворителя соответственно. Если растворителем является вода, гидратация происходит, когда заряженные ионы растворенного вещества оказываются окруженными молекулами воды. Стандартным примером является водная соленая вода. Такие растворы называются электролитами . Всякий раз, когда соль растворяется в воде, необходимо учитывать ассоциацию ионов .
Полярные растворенные вещества растворяются в полярных растворителях, образуя полярные связи или водородные связи. Например, все алкогольные напитки представляют собой водные растворы этанола . С другой стороны, неполярные растворенные вещества лучше растворяются в неполярных растворителях. Примерами являются углеводороды, такие как масло и жир , которые легко смешиваются, но несовместимы с водой.
Примером несмешиваемости нефти и воды является утечка нефти из поврежденного танкера, которая не растворяется в морской воде, а плавает на поверхности.
В лабораториях принято готовить раствор непосредственно из его составляющих ингредиентов. В практических расчетах есть три случая:
В следующих уравнениях A — растворитель, B — растворенное вещество, а C — концентрация. Вклад объема растворенного вещества учитывается с помощью модели идеального раствора.
Пример: Приготовьте раствор 2 г/100 мл NaCl с 1 л воды . Плотность полученного раствора считается равной плотности воды, утверждение справедливо, особенно для разбавленных растворов, поэтому информация о плотности не требуется.
Химики часто готовят концентрированные исходные растворы , которые затем можно разбавлять по мере необходимости для лабораторных применений. Стандартные растворы — это те, в которых концентрации растворенных веществ известны точно и достоверно.