
В кристаллографии кристаллическая структура — это описание упорядоченного расположения атомов , ионов или молекул в кристаллическом материале . [1] Упорядоченные структуры возникают из-за внутренней природы составляющих их частиц и образуют симметричные узоры , которые повторяются вдоль главных направлений трехмерного пространства в материи.
Наименьшая группа частиц в материале, которая составляет этот повторяющийся узор, является элементарной ячейкой структуры. Элементарная ячейка полностью отражает симметрию и структуру всего кристалла, который построен путем повторяющегося перемещения элементарной ячейки вдоль ее главных осей. Векторы перемещения определяют узлы решетки Браве .
Длины главных осей/рёбер элементарной ячейки и углы между ними являются постоянными решётки , также называемыми параметрами решётки или параметрами ячейки . Свойства симметрии кристалла описываются концепцией пространственных групп . [1] Все возможные симметричные расположения частиц в трёхмерном пространстве могут быть описаны 230 пространственными группами.
Кристаллическая структура и симметрия играют решающую роль в определении многих физических свойств, таких как спайность , электронная зонная структура и оптическая прозрачность .
Кристаллическая структура описывается в терминах геометрии расположения частиц в элементарных ячейках. Элементарная ячейка определяется как наименьшая повторяющаяся единица, имеющая полную симметрию кристаллической структуры. [2] Геометрия элементарной ячейки определяется как параллелепипед , обеспечивающий шесть параметров решетки, взятых как длины ребер ячейки ( a , b , c ) и углы между ними (α, β, γ). Положения частиц внутри элементарной ячейки описываются дробными координатами ( xi , yi , zi ) вдоль ребер ячейки, измеренными от точки отсчета. Таким образом, необходимо сообщить только координаты наименьшего асимметричного подмножества частиц, называемого кристаллографической асимметричной единицей. Асимметричная единица может быть выбрана так, чтобы она занимала наименьшее физическое пространство , что означает, что не все частицы должны физически располагаться внутри границ, заданных параметрами решетки. Все остальные частицы элементарной ячейки генерируются операциями симметрии, которые характеризуют симметрию элементарной ячейки. Совокупность операций симметрии элементарной ячейки формально выражается как пространственная группа кристаллической структуры. [3]
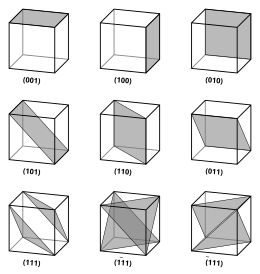
Векторы и плоскости в кристаллической решетке описываются трехзначной нотацией индекса Миллера . Этот синтаксис использует индексы h , k и ℓ в качестве параметров направления. [4]
По определению синтаксис ( hkℓ ) обозначает плоскость, которая пересекает три точки a 1 / h , a 2 / k и a 3 / ℓ или некоторое их кратное. То есть индексы Миллера пропорциональны обратным величинам пересечений плоскости с элементарной ячейкой (в базисе векторов решетки). Если один или несколько индексов равны нулю, это означает, что плоскости не пересекают эту ось (т. е. пересечение находится «на бесконечности»). Плоскость, содержащая координатную ось, транслируется так, что она больше не содержит эту ось до того, как будут определены ее индексы Миллера. Индексы Миллера для плоскости являются целыми числами без общих множителей. Отрицательные индексы обозначаются горизонтальными чертами, как в (1 2 3). В ортогональной системе координат для кубической ячейки индексы Миллера плоскости являются декартовыми компонентами вектора, нормального к плоскости.
Рассматривая только плоскости ( hkℓ ), пересекающие одну или несколько точек решетки ( плоскости решетки ), расстояние d между соседними плоскостями решетки связано с (кратчайшим) вектором обратной решетки, ортогональным плоскостям, по формуле
Кристаллографические направления — это геометрические линии, связывающие узлы ( атомы , ионы или молекулы ) кристалла. Аналогично, кристаллографические плоскости — это геометрические плоскости, связывающие узлы. Некоторые направления и плоскости имеют более высокую плотность узлов. Эти плоскости высокой плотности оказывают влияние на поведение кристалла следующим образом: [1]

Некоторые направления и плоскости определяются симметрией кристаллической системы. В моноклинной, тригональной, тетрагональной и гексагональной системах есть одна уникальная ось (иногда называемая главной осью ), которая имеет более высокую вращательную симметрию, чем две другие оси. Базисная плоскость — это плоскость, перпендикулярная главной оси в этих кристаллических системах. Для триклинной, орторомбической и кубической кристаллических систем обозначение оси произвольно, и главной оси нет.
Для особого случая простых кубических кристаллов векторы решетки ортогональны и имеют одинаковую длину (обычно обозначаются a ); аналогично для обратной решетки. Таким образом, в этом общем случае индексы Миллера ( ℓmn ) и [ ℓmn ] оба просто обозначают нормали/направления в декартовых координатах . Для кубических кристаллов с постоянной решетки a расстояние d между соседними (ℓmn) плоскостями решетки равно (сверху):
Из-за симметрии кубических кристаллов можно менять местами и знаками целые числа и иметь эквивалентные направления и плоскости:
Для гранецентрированных кубических (ГЦК) и объемноцентрированных кубических (ОЦК) решеток примитивные векторы решетки не ортогональны. Однако в этих случаях индексы Миллера условно определяются относительно векторов решетки кубической суперячейки и, следовательно, снова являются просто декартовыми направлениями .
Расстояние d между соседними ( hkℓ ) плоскостями решетки определяется по формуле: [5] [6]
Определяющим свойством кристалла является его внутренняя симметрия. Выполнение определенных операций симметрии над кристаллической решеткой оставляет ее неизменной. Все кристаллы обладают трансляционной симметрией в трех направлениях, но некоторые имеют и другие элементы симметрии. Например, поворот кристалла на 180° вокруг определенной оси может привести к атомной конфигурации, идентичной исходной конфигурации; кристалл имеет двойную вращательную симметрию вокруг этой оси. Помимо вращательной симметрии, кристалл может иметь симметрию в виде зеркальных плоскостей, а также так называемые составные симметрии, которые являются комбинацией трансляционной и вращательной или зеркальной симметрии. Полная классификация кристалла достигается, когда идентифицированы все внутренние симметрии кристалла. [7]
Системы решеток — это группировка кристаллических структур в соответствии с точечными группами их решетки. Все кристаллы попадают в одну из семи систем решеток. Они связаны с семью кристаллическими системами , но не совпадают с ними .
Наиболее симметричная, кубическая или изометрическая система, имеет симметрию куба , то есть она демонстрирует четыре тройные оси вращения, ориентированные под углом 109,5° ( тетраэдрический угол ) относительно друг друга. Эти тройные оси лежат вдоль диагоналей тела куба. Другие шесть систем решеток — гексагональная , тетрагональная , ромбоэдрическая (часто путаемая с тригональной кристаллической системой ), орторомбическая , моноклинная и триклинная .
Решетки Бравэ , также называемые пространственными решетками , описывают геометрическое расположение точек решетки [4] и, следовательно, трансляционную симметрию кристалла. Три измерения пространства предоставляют 14 различных решеток Бравэ, описывающих трансляционную симметрию. Все кристаллические материалы, признанные сегодня, за исключением квазикристаллов , вписываются в одну из этих конфигураций. Выше показаны четырнадцать трехмерных решеток, классифицированных по системе решетки.
Кристаллическая структура состоит из одной и той же группы атомов, базиса , расположенного вокруг каждой точки решетки. Эта группа атомов, таким образом, бесконечно повторяется в трех измерениях в соответствии с расположением одной из решеток Браве. Характерное вращение и зеркальная симметрия элементарной ячейки описываются ее кристаллографической точечной группой .
Кристаллическая система — это набор точечных групп, в котором сами точечные группы и соответствующие им пространственные группы назначены решетчатой системе. Из 32 точечных групп, существующих в трех измерениях, большинство назначены только одной решетчатой системе, в этом случае кристаллическая система и решетчатая система имеют одинаковое название. Однако пять точечных групп назначены двум решетчатым системам, ромбоэдрической и гексагональной, поскольку обе решетчатые системы обладают тройной вращательной симметрией. Эти точечные группы назначены тригональной кристаллической системе.
Всего существует семь кристаллических систем: триклинная, моноклинная, ромбическая, тетрагональная, тригональная, гексагональная и кубическая.
Кристаллографическая точечная группа или кристаллический класс — это математическая группа, включающая операции симметрии, которые оставляют по крайней мере одну точку неподвижной и которые оставляют внешний вид кристаллической структуры неизменным. Эти операции симметрии включают
Оси вращения (собственные и несобственные), плоскости отражения и центры симметрии в совокупности называются элементами симметрии . Существует 32 возможных класса кристаллов. Каждый из них может быть отнесен к одной из семи кристаллических систем.
Помимо операций точечной группы, пространственная группа кристаллической структуры содержит операции трансляционной симметрии. К ним относятся:
Существует 230 различных пространственных групп.
Рассматривая расположение атомов относительно друг друга, их координационные числа, межатомные расстояния, типы связей и т. д., можно сформировать общее представление о структурах и альтернативные способы их визуализации. [9]
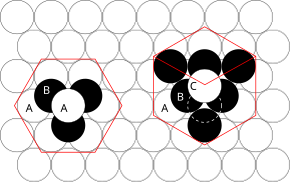
Принципы, которые здесь задействованы, можно понять, рассмотрев наиболее эффективный способ упаковки сфер одинакового размера и укладки плотно упакованных атомных плоскостей в трех измерениях. Например, если плоскость A лежит под плоскостью B, есть два возможных способа размещения дополнительного атома поверх слоя B. Если бы дополнительный слой был размещен непосредственно над плоскостью A, это привело бы к следующей серии:
Такое расположение атомов в кристаллической структуре известно как гексагональная плотнейшая упаковка (ГПУ) .
Однако если все три плоскости смещены относительно друг друга и последовательность повторяется только после того, как четвертый слой будет расположен непосредственно над плоскостью А, то возникает следующая последовательность:
Такой тип структурной организации известен как кубическая плотная упаковка (КПУ) .
Элементарная ячейка ccp-расположения атомов — это гранецентрированная кубическая (fcc) элементарная ячейка. Это не сразу очевидно, так как плотно упакованные слои параллельны плоскостям {111} элементарной ячейки fcc. Существует четыре различных ориентации плотно упакованных слоев.
Одной из важных характеристик кристаллической структуры является ее атомный коэффициент упаковки (APF). Он рассчитывается, предполагая, что все атомы являются идентичными сферами с радиусом, достаточно большим, чтобы каждая сфера примыкала к следующей. Атомный коэффициент упаковки — это доля пространства, заполненного этими сферами, которую можно вычислить, вычислив общий объем сфер и разделив на объем ячейки следующим образом:
Другой важной характеристикой кристаллической структуры является ее координационное число (КЧ). Это число ближайших соседей центрального атома в структуре.
Ниже показаны APF и CN наиболее распространенных кристаллических структур:
Эффективность упаковки FCC и HCP, равная 74%, является максимально возможной плотностью в элементарных ячейках, построенных из сфер только одного размера.
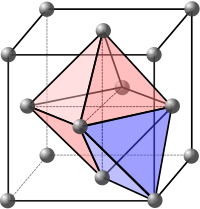
Интерстициальные сайты относятся к пустым пространствам между атомами в кристаллической решетке. Эти пространства могут быть заполнены противоположно заряженными ионами с образованием многоэлементных структур. Они также могут быть заполнены примесными атомами или собственными интерстициалами с образованием дефектов интерстиций .
Реальные кристаллы характеризуются дефектами или неровностями в идеальных структурах, описанных выше, и именно эти дефекты критически определяют многие электрические и механические свойства реальных материалов.
Когда один атом заменяет один из основных атомных компонентов в кристаллической структуре, может произойти изменение электрических и тепловых свойств материала. [11] Примеси могут также проявляться как примеси электронного спина в некоторых материалах. Исследования магнитных примесей показывают, что существенное изменение определенных свойств, таких как удельная теплоемкость, может быть вызвано небольшими концентрациями примеси, как, например, примеси в полупроводниковых ферромагнитных сплавах могут привести к различным свойствам, как впервые было предсказано в конце 1960-х годов. [12] [13]
Дислокации в кристаллической решетке — это линейные дефекты, связанные с локальными полями напряжений. Дислокации допускают сдвиг при более низком напряжении, чем необходимо для идеальной кристаллической структуры. [14] Локальные поля напряжений приводят к взаимодействиям между дислокациями, которые затем приводят к деформационному упрочнению или холодной обработке .
Границы зерен — это интерфейсы, где встречаются кристаллы с различной ориентацией. [4] Граница зерен — это однофазный интерфейс, при этом кристаллы по обе стороны границы идентичны, за исключением ориентации. Термин «граница кристаллита» иногда, хотя и редко, используется. Области границ зерен содержат те атомы, которые были возмущены из своих исходных узлов решетки, дислокации и примеси, которые мигрировали к границе зерна с более низкой энергией.
Рассматривая границу зерна геометрически как интерфейс одного кристалла, разрезанного на две части, одна из которых повернута, мы видим, что для определения границы зерна требуется пять переменных. Первые два числа берутся из единичного вектора, который определяет ось вращения. Третье число обозначает угол поворота зерна. Последние два числа определяют плоскость границы зерна (или единичный вектор, который нормален к этой плоскости). [9]
Границы зерен нарушают движение дислокаций через материал, поэтому уменьшение размера кристаллитов является распространенным способом повышения прочности, как описано в соотношении Холла-Петча . Поскольку границы зерен являются дефектами в кристаллической структуре, они имеют тенденцию снижать электро- и теплопроводность материала. Высокая межфазная энергия и относительно слабая связь в большинстве границ зерен часто делают их предпочтительными местами для начала коррозии и для осаждения новых фаз из твердого тела. Они также важны для многих механизмов ползучести . [9]
Границы зерен в целом имеют ширину всего несколько нанометров. В обычных материалах кристаллиты достаточно велики, чтобы границы зерен составляли малую долю материала. Однако достижимы очень малые размеры зерен. В нанокристаллических твердых телах границы зерен становятся значительной объемной долей материала, оказывая глубокое влияние на такие свойства, как диффузия и пластичность . В пределе малых кристаллитов, когда объемная доля границ зерен приближается к 100%, материал перестает иметь какой-либо кристаллический характер и, таким образом, становится аморфным твердым телом . [9]
Трудность предсказания стабильных кристаллических структур на основе знания только химического состава долгое время была камнем преткновения на пути к полностью вычислительному проектированию материалов. Теперь, с более мощными алгоритмами и высокопроизводительными вычислениями, структуры средней сложности можно предсказывать, используя такие подходы, как эволюционные алгоритмы , случайная выборка или метадинамика.
Кристаллические структуры простых ионных твердых тел (например, NaCl или поваренной соли) давно рационализировались в терминах правил Полинга , впервые изложенных в 1929 году Лайнусом Полингом , которого многие с тех пор называют «отцом химической связи». [15] Полинг также рассмотрел природу межатомных сил в металлах и пришел к выводу, что около половины из пяти d-орбиталей в переходных металлах участвуют в образовании связей, а оставшиеся несвязывающие d-орбитали отвечают за магнитные свойства. Поэтому Полинг смог сопоставить количество d-орбиталей в образовании связей с длиной связи, а также со многими физическими свойствами вещества. Впоследствии он ввел металлическую орбиталь, дополнительную орбиталь, необходимую для обеспечения беспрепятственного резонанса валентных связей между различными электронными структурами. [16]
В теории резонирующих валентных связей факторы, определяющие выбор одной из альтернативных кристаллических структур металла или интерметаллического соединения, вращаются вокруг энергии резонанса связей между межатомными позициями. Очевидно, что некоторые режимы резонанса будут вносить больший вклад (будут более механически стабильными, чем другие), и что, в частности, простое отношение числа связей к числу позиций будет исключительным. Результирующий принцип заключается в том, что особая стабильность связана с простейшими отношениями или «числами связей»: 1 ⁄ 2 , 1 ⁄ 3 , 2 ⁄ 3 , 1 ⁄ 4 , 3 ⁄ 4 и т. д. Выбор структуры и значение осевого отношения (которое определяет относительные длины связей) являются, таким образом, результатом усилий атома использовать свою валентность для образования стабильных связей с простыми дробными числами связей. [17] [18]
После постулирования прямой корреляции между концентрацией электронов и кристаллической структурой в сплавах бета-фазы, Хьюм-Розери проанализировал тенденции в температурах плавления, сжимаемости и длинах связей в зависимости от номера группы в периодической таблице, чтобы установить систему валентностей переходных элементов в металлическом состоянии. Таким образом, эта трактовка подчеркнула увеличение прочности связи в зависимости от номера группы. [19] Действие направленных сил было подчеркнуто в одной статье о связи между гибридами связей и металлическими структурами. Результирующая корреляция между электронными и кристаллическими структурами суммируется одним параметром, весом d-электронов на гибридизированную металлическую орбиталь. «d-вес» вычисляется до 0,5, 0,7 и 0,9 для структур fcc, hcp и bcc соответственно. Таким образом, связь между d-электронами и кристаллической структурой становится очевидной. [20]
В предсказаниях/моделировании кристаллической структуры периодичность обычно применяется, поскольку система представляется неограниченной во всех направлениях. Начиная с триклинной структуры без дополнительных предполагаемых свойств симметрии, система может быть приведена к проявлению некоторых дополнительных свойств симметрии путем применения Второго закона Ньютона к частицам в элементарной ячейке и недавно разработанного динамического уравнения для векторов периода системы [21] (параметры решетки, включая углы), даже если система подвергается внешнему напряжению.

Полиморфизм — это возникновение множественных кристаллических форм материала. Он встречается во многих кристаллических материалах, включая полимеры , минералы и металлы . Согласно правилам фазовых равновесий Гиббса, эти уникальные кристаллические фазы зависят от интенсивных переменных, таких как давление и температура. Полиморфизм связан с аллотропией , которая относится к элементарным твердым телам . Полная морфология материала описывается полиморфизмом и другими переменными, такими как габитус кристалла , аморфная фракция или кристаллографические дефекты . Полиморфы имеют различную стабильность и могут спонтанно и необратимо трансформироваться из метастабильной формы (или термодинамически нестабильной формы) в стабильную форму при определенной температуре. [22] Они также демонстрируют различные температуры плавления , растворимости и картины дифракции рентгеновских лучей .
Хорошим примером этого является кварцевая форма диоксида кремния , или SiO 2 . В подавляющем большинстве силикатов атом Si показывает тетраэдрическую координацию с 4 атомами кислорода. Все, кроме одной, кристаллические формы включают тетраэдрические единицы {SiO 4 }, связанные вместе общими вершинами в различных расположениях. В разных минералах тетраэдры показывают разную степень сеток и полимеризации. Например, они встречаются поодиночке, соединенные парами, в более крупных конечных кластерах, включая кольца, в цепях, двойных цепях, листах и трехмерных каркасах. Минералы классифицируются по группам на основе этих структур. В каждой из 7 термодинамически стабильных кристаллических форм или полиморфов кристаллического кварца только 2 из 4 ребер тетраэдров {SiO 4 } являются общими с другими, что дает чистую химическую формулу для кремнезема: SiO 2 .
Другим примером является элементарное олово (Sn), которое является ковким вблизи температур окружающей среды, но становится хрупким при охлаждении. Это изменение механических свойств обусловлено существованием его двух основных аллотропов , α- и β-олово. Два аллотропа , которые встречаются при нормальном давлении и температуре, α-олово и β-олово, более известны как серое олово и белое олово соответственно. Еще два аллотропа, γ и σ, существуют при температурах выше 161 °C и давлениях выше нескольких ГПа. [23] Белое олово является металлическим и является стабильной кристаллической формой при комнатной температуре или выше. Ниже 13,2 °C олово существует в серой форме, которая имеет алмазную кубическую кристаллическую структуру, похожую на алмаз , кремний или германий . Серое олово вообще не имеет металлических свойств, представляет собой тускло-серый порошкообразный материал и имеет мало применений, за исключением нескольких специализированных полупроводниковых применений. [24] Хотя температура α–β-превращения олова номинально составляет 13,2 °C, примеси (например, Al, Zn и т. д.) понижают температуру перехода значительно ниже 0 °C, а при добавлении Sb или Bi превращение может вообще не произойти. [25]
Двадцать из 32 классов кристаллов являются пьезоэлектриками , и кристаллы, принадлежащие к одному из этих классов (точечным группам), проявляют пьезоэлектричество . Все пьезоэлектрические классы не обладают инверсионной симметрией . Любой материал развивает диэлектрическую поляризацию при приложении электрического поля, но вещество, которое имеет такое естественное разделение зарядов даже в отсутствие поля, называется полярным материалом. Является ли материал полярным или нет, определяется исключительно его кристаллической структурой. Только 10 из 32 точечных групп являются полярными . Все полярные кристаллы являются пироэлектриками , поэтому 10 классов полярных кристаллов иногда называют пироэлектрическими классами.
Существует несколько кристаллических структур, в частности структура перовскита , которые проявляют сегнетоэлектрическое поведение. Это аналогично ферромагнетизму , в том смысле, что при отсутствии электрического поля во время производства сегнетоэлектрический кристалл не проявляет поляризации. При приложении электрического поля достаточной величины кристалл становится постоянно поляризованным. Эта поляризация может быть обращена достаточно большим противозарядом, таким же образом, как может быть обращен ферромагнетик. Однако, хотя они и называются сегнетоэлектриками, эффект обусловлен кристаллической структурой (а не наличием черного металла).
![]() Медиа, связанные с кристаллическими структурами на Wikimedia Commons
Медиа, связанные с кристаллическими структурами на Wikimedia Commons