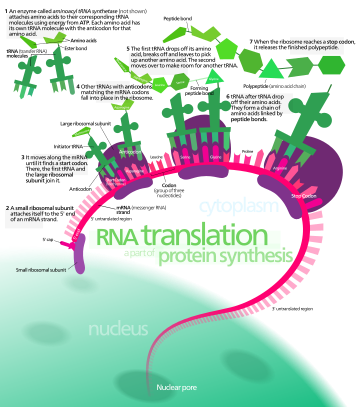
В биологии трансляция — это процесс в живых клетках , в котором белки производятся с использованием молекул РНК в качестве шаблонов . Генерируемый белок представляет собой последовательность аминокислот . Эта последовательность определяется последовательностью нуклеотидов в РНК. Нуклеотиды считаются тремя одновременно. Каждая такая тройка приводит к добавлению одной конкретной аминокислоты к образующемуся белку. Соответствие тройки нуклеотидов аминокислоте называется генетическим кодом . Трансляцию осуществляет большой комплекс функциональных РНК и белков, называемых рибосомами . Весь этот процесс называется экспрессией генов .
При трансляции информационная РНК (мРНК) декодируется в рибосоме вне ядра с образованием определенной аминокислотной цепи или полипептида . Полипептид позже сворачивается в активный белок и выполняет свои функции в клетке. Рибосома облегчает декодирование, индуцируя связывание комплементарных антикодонных последовательностей транспортной РНК (тРНК) с кодонами мРНК . ТРНК несут определенные аминокислоты, которые соединяются в полипептид, когда мРНК проходит через него и «читается» рибосомой.
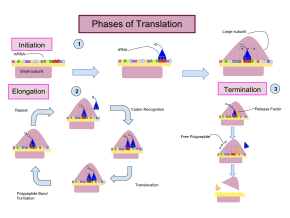
Перевод происходит в три этапа:
У прокариот (бактерий и архей) трансляция происходит в цитозоле, где большие и малые субъединицы рибосомы связываются с мРНК. У эукариот трансляция происходит в цитоплазме или через мембрану эндоплазматического ретикулума в процессе, называемом котрансляционной транслокацией . При котрансляционной транслокации весь комплекс рибосома/мРНК связывается с внешней мембраной шероховатой эндоплазматической сети (ЭР), и новый белок синтезируется и высвобождается в ЭР; вновь созданный полипептид может храниться внутри ЭР для будущего транспорта везикул и секреции вне клетки или немедленно секретироваться.
Многие типы транскрибируемых РНК, такие как тРНК, рибосомальная РНК и малая ядерная РНК, не подвергаются трансляции в белки.
Некоторые антибиотики действуют путем ингибирования трансляции. К ним относятся анизомицин , циклогексимид , хлорамфеникол , тетрациклин , стрептомицин , эритромицин и пуромицин . Прокариотические рибосомы имеют структуру, отличную от структуры эукариотических рибосом, и поэтому антибиотики могут специфически воздействовать на бактериальные инфекции без какого-либо вреда для эукариотических клеток- хозяев .
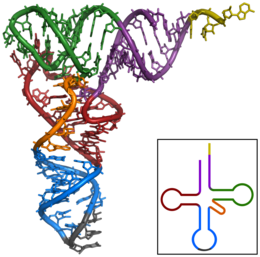
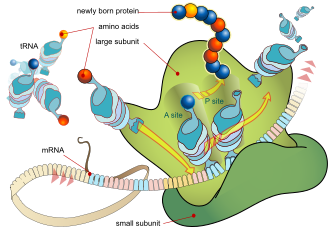
Основной процесс производства белка – это добавление по одной аминокислоте к концу белка. Эту операцию выполняет рибосома . [1] Рибосома состоит из двух субъединиц: малой и большой субъединицы. Эти субъединицы собираются вместе перед трансляцией мРНК в белок, обеспечивая место для проведения трансляции и образования полипептида. [2] Выбор типа добавляемой аминокислоты определяется молекулой информационной РНК (мРНК). Каждая добавленная аминокислота соответствует трехнуклеотидной подпоследовательности мРНК. Для каждого такого возможного триплета принимается соответствующая аминокислота. Последовательные аминокислоты, добавленные в цепь, соответствуют последовательным тройкам нуклеотидов в мРНК. Таким образом, последовательность нуклеотидов в матричной цепи мРНК определяет последовательность аминокислот в создаваемой аминокислотной цепи. [3] Добавление аминокислоты происходит на С-конце пептида; таким образом, говорят, что трансляция направлена от амина к карбоксилу. [4]
мРНК переносит генетическую информацию, закодированную в виде рибонуклеотидной последовательности, от хромосом к рибосомам. Рибонуклеотиды «читаются» механизмом трансляции в последовательности триплетов нуклеотидов , называемых кодонами. Каждый из этих триплетов кодирует определенную аминокислоту .
Молекулы рибосомы переводят этот код в определенную последовательность аминокислот. Рибосома представляет собой многосубъединичную структуру, содержащую рибосомальную РНК (рРНК) и белки. Это «фабрика», где аминокислоты собираются в белки. Транспортные РНК (тРНК) представляют собой небольшие некодирующие цепи РНК (74–93 нуклеотида), которые транспортируют аминокислоты к рибосоме. Репертуар генов тРНК широко варьируется у разных видов: некоторые бактерии имеют от 20 до 30 генов, тогда как сложные эукариоты могут иметь тысячи. [5] тРНК имеют сайт для прикрепления аминокислот и сайт, называемый антикодоном. Антикодон представляет собой триплет РНК, комплементарный триплету мРНК, который кодирует грузовую аминокислоту .
Аминоацил-тРНК-синтетазы ( ферменты ) катализируют связь между конкретными тРНК и аминокислотами , которые необходимы их антикодоновым последовательностям. Продуктом этой реакции является аминоацил-тРНК . У бактерий эта аминоацил-тРНК переносится в рибосому с помощью EF-Tu , где кодоны мРНК сопоставляются посредством комплементарного спаривания оснований со специфическими антикодонами тРНК. Аминоацил-тРНК-синтетазы, которые неправильно спаривают тРНК с неправильными аминокислотами, могут производить неправильно заряженные аминоацил-тРНК, что может привести к появлению неподходящих аминокислот в соответствующем положении в белке. Такая «неправильная трансляция» [6] генетического кода естественным образом происходит на низких уровнях у большинства организмов, но определенные клеточные среды вызывают увеличение разрешающего декодирования мРНК, иногда к выгоде клетки.
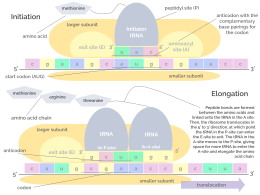
Рибосома имеет два сайта связывания тРНК. Это аминоацильный сайт (сокращенно А) и пептидильный сайт/сайт выхода (сокращенно P/E). Что касается мРНК, то три сайта ориентированы от 5’ к 3’-ЭПК, поскольку рибосомы движутся к 3’-концу мРНК. А -сайт связывает входящую тРНК с комплементарным кодоном мРНК. P /E-сайт удерживает тРНК с растущей полипептидной цепью. Когда аминоацил-тРНК первоначально связывается с соответствующим кодоном мРНК, она находится в А-сайте. Затем между аминокислотой тРНК в А-сайте и аминокислотой заряженной тРНК в P/E-сайте образуется пептидная связь. Растущая полипептидная цепь переносится на тРНК в А-сайте. Происходит транслокация, перемещающая тРНК в сайт P/E, теперь уже без аминокислоты; тРНК, которая находилась в сайте A и теперь заряжена полипептидной цепью, перемещается в сайт P/E, и тРНК уходит, а другая аминоацил-тРНК входит в сайт A, чтобы повторить процесс. [7]
После добавления новой аминокислоты к цепи и после высвобождения тРНК из рибосомы в цитозоль энергия, обеспечиваемая гидролизом GTP, связанного с транслоказой EF -G (у бактерий ) и a/eEF -2 (у эукариот и архей ) перемещает рибосому на один кодон вниз к 3'-концу . Энергия, необходимая для трансляции белков, значительна. Для белка, содержащего n аминокислот, количество высокоэнергетических фосфатных связей, необходимых для его трансляции, составляет 4 n -1. [8] Скорость перевода варьируется; в прокариотических клетках он значительно выше (до 17–21 аминокислотного остатка в секунду), чем в эукариотических клетках (до 6–9 аминокислотных остатков в секунду). [9]
Несмотря на то, что рибосомы обычно считаются точными и процессивными машинами, процесс трансляции подвержен ошибкам, которые могут привести либо к синтезу ошибочных белков, либо к преждевременному прекращению трансляции либо потому, что тРНК соединяется с неправильным кодоном, либо потому, что тРНК связан с неправильной аминокислотой. [10] По оценкам, частота ошибок при синтезе белков составляет от 1 на 10 5 до 1 на 10 3 неправильно включенных аминокислот, в зависимости от условий эксперимента. [11] Вместо этого, по оценкам, скорость преждевременного прекращения трансляции составляет порядка 10 -4 событий на транслируемый кодон. [12] Правильная аминокислота ковалентно связана с правильной тРНК с помощью аминоацилтрансфераз. Аминокислота соединена своей карбоксильной группой с 3'-ОН тРНК сложноэфирной связью . Когда тРНК имеет связанную с ней аминокислоту, тРНК называют «заряженной». Инициация включает связывание небольшой субъединицы рибосомы с 5'-концом мРНК с помощью факторов инициации (IF). У бактерий и меньшинства архей инициация синтеза белка включает распознавание богатой пуринами инициирующей последовательности на мРНК, называемой последовательностью Шайна-Дальгарно. Последовательность Шайна-Дальгарно связывается с комплементарной богатой пиримидином последовательностью на 3'-конце части 16S рРНК 30S субъединицы рибосомы. Связывание этих комплементарных последовательностей гарантирует, что 30S рибосомальная субъединица связана с мРНК и выровнена таким образом, что инициирующий кодон помещается в 30S часть P-сайта. Как только мРНК и субъединица 30S правильно связаны, фактор инициации переносит комплекс инициаторной тРНК-аминокислоты, f-Met-тРНК, в сайт 30S P. Фаза инициации завершается, когда субъединица 50S присоединяется к субъединице 30, образуя активную рибосому 70S. [13] Терминация полипептида происходит, когда участок А рибосомы занимает стоп-кодон (UAA, UAG или UGA) на мРНК, создавая первичную структуру белка. тРНК обычно не может распознавать стоп-кодоны или связываться со ими. Вместо этого стоп-кодон индуцирует связывание белка фактора высвобождения [14] (RF1 и RF2), что приводит к разборке всего комплекса рибосома/мРНК путем гидролиза полипептидной цепи из пептидилтрансферазного центра [1] рибосомы. . [15] Лекарства или специальные мотивы последовательности мРНК могут изменить структуру рибосом так, что почти родственные тРНК будут связываться со стоп-кодоном вместо факторов высвобождения. В таких случаях «трансляционного чтения» трансляция продолжается до тех пор, пока рибосома не встретит следующий стоп-кодон. [16]
Процесс трансляции строго регулируется как у эукариотических, так и у прокариотических организмов. Регуляция трансляции может влиять на глобальную скорость синтеза белка, которая тесно связана с метаболическим и пролиферативным состоянием клетки.
Чтобы глубже разобраться в этом сложном процессе, ученые обычно используют метод, известный как профилирование рибосом. [17] Этот метод позволяет исследователям сделать снимок транслатома, показывая, какие части мРНК транслируются рибосомами в белки в данный момент времени. Профилирование рибосом дает ценную информацию о динамике трансляции, раскрывая сложное взаимодействие между последовательностью генов, структурой мРНК и регуляцией трансляции. Например, исследования с использованием этого метода показали, что генетические различия и их последующая экспрессия в виде мРНК также могут влиять на скорость трансляции РНК-специфичным образом. [18]
В развитие этой концепции более поздней разработкой является профилирование рибосом отдельных клеток — метод, который позволяет нам изучать процесс трансляции с разрешением отдельных клеток. [19] Это особенно важно, поскольку клетки, даже одного типа, могут демонстрировать значительную вариабельность синтеза белка. Профилирование одноклеточных рибосом потенциально может пролить свет на гетерогенную природу клеток, что приведет к более глубокому пониманию того, как регуляция трансляции может влиять на поведение клеток, метаболическое состояние и реакцию на различные стимулы или условия.
Трансляционный контроль имеет решающее значение для развития и выживания рака . Раковые клетки часто должны регулировать фазу трансляции экспрессии генов, хотя до конца не понятно, почему трансляция нацелена на такие этапы, как транскрипция. Хотя раковые клетки часто имеют генетически измененные факторы трансляции, раковые клетки гораздо чаще изменяют уровни существующих факторов трансляции. [20] Несколько основных онкогенных сигнальных путей, включая пути RAS-MAPK , PI3K/AKT/mTOR , MYC и WNT-β-катенин , в конечном итоге перепрограммируют геном посредством трансляции. [21] Раковые клетки также контролируют трансляцию, чтобы адаптироваться к клеточному стрессу. Во время стресса клетка транслирует мРНК, которые могут смягчить стресс и способствовать выживанию. Примером этого является экспрессия AMPK при различных видах рака; его активация запускает каскад, который в конечном итоге может позволить раку избежать апоптоза (запрограммированной гибели клеток), вызванного лишением питания. Будущие методы лечения рака могут включать в себя нарушение механизма трансляции клетки, чтобы противостоять последующим эффектам рака. [20]
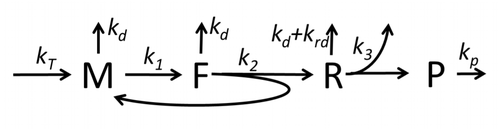
Описание процесса транскрипции-трансляции с упоминанием только самых основных «элементарных» процессов состоит из:
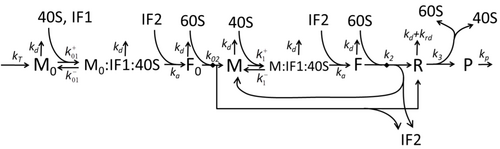
Процесс построения аминокислот для создания белка при трансляции в течение длительного времени является предметом различных физических моделей, начиная с первых детальных кинетических моделей, таких как [23] или других, учитывающих стохастические аспекты трансляции и с использованием компьютерного моделирования. За последние четыре десятилетия было разработано и проанализировано множество моделей синтеза белка, основанных на химической кинетике. [24] [25] Помимо химической кинетики, для моделирования детальной кинетики синтеза белка или некоторых его компонентов применялись различные формализмы моделирования, такие как полностью асимметричный простой процесс исключения , [25] вероятностные логические сети , сети Петри и алгебра макс-плюс. этапы. Базовая модель синтеза белка, учитывающая все восемь «элементарных» процессов, была разработана [22] в соответствии с парадигмой , согласно которой «полезные модели просты и расширяемы». [26] Простейшая модель M0 представлена кинетическим механизмом реакции (рис. M0). Было обобщено, что оно включает связывание 40S, 60S и факторов инициации (IF) (рис. M1'). Оно было расширено и теперь включает влияние микроРНК на синтез белка. [27] Большинство моделей в этой иерархии можно решить аналитически. Эти решения были использованы для извлечения «кинетических сигнатур» различных конкретных механизмов регуляции синтеза.
Также возможен перевод вручную (для коротких последовательностей) или с помощью компьютера (после предварительного программирования, см. раздел ниже); это позволяет биологам и химикам нарисовать на бумаге химическую структуру кодируемого белка.
Сначала преобразуйте каждое основание ДНК-матрицы в его РНК-комплемент (обратите внимание, что комплементом A теперь является U), как показано ниже. Обратите внимание, что матричная цепь ДНК — это та, против которой полимеризуется РНК; другая цепь ДНК будет такой же, как РНК, но с тимином вместо урацила.
ДНК -> РНК А -> У Т -> А С -> Г Г -> С А=Т-> А=У
Затем разделите РНК на триплеты (группы из трех оснований). Обратите внимание, что существует 3 «окна» перевода, или рамки чтения , в зависимости от того, где вы начинаете читать код. Наконец, используйте таблицу « Генетический код» , чтобы перевести приведенное выше в структурную формулу , используемую в химии.
Это даст первичную структуру белка. Однако белки имеют тенденцию сворачиваться , частично в зависимости от гидрофильных и гидрофобных сегментов цепи. О вторичной структуре часто еще можно догадаться, но правильную третичную структуру зачастую очень трудно определить.
В то время как другие аспекты, такие как трехмерная структура, называемая третичной структурой белка, могут быть предсказаны только с использованием сложных алгоритмов , аминокислотная последовательность, называемая первичной структурой, может быть определена исключительно на основе последовательности нуклеиновой кислоты с помощью таблицы трансляции .
Этот подход может не дать правильный аминокислотный состав белка, в частности, если в белок включены нетрадиционные аминокислоты , такие как селеноцистеин , который кодируется обычным стоп-кодоном в сочетании с расположенной ниже шпилькой (SElenoCysteine Insertion Sequence или СЕКИС).
Существует множество компьютерных программ, способных транслировать последовательность ДНК/РНК в последовательность белка. Обычно это выполняется с использованием стандартного генетического кода, однако немногие программы могут обрабатывать все «особые» случаи, такие как использование альтернативных инициирующих кодонов, которые являются биологически значимыми. Например, редкий альтернативный стартовый кодон CTG кодирует метионин , когда он используется в качестве стартового кодона, и лейцин во всех других положениях.
Пример: таблица сокращенного перевода стандартного генетического кода (с веб-страницы таксономии NCBI). [28]
AA = FFLLSSSSYY**CC*WLLLLPPPPHHQQRRRRIIIMTTTNNKKSSRRVVVVAAAADDEEGGGG Начинается = ---М---------------М---------------М------------ ---------------- BASE1 = TTTTTTTTTTTTTTTTCCCCCCCCCCCCCCCAAAAAAAAAAAAAAAGGGGGGGGGGGGGGGGG Base2 = TTTTCCCCAAAAGGGGTTTTTCCCCAAAAGGGGTTTTTCCCCAAAAGGGTTTTTCCCCAAAAGGGG Base3 = TCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAG
В строке «Начала» указаны три стартовых кодона: UUG, CUG и очень распространенный AUG. Он также указывает на первый аминокислотный остаток, если интерпретировать его как начало: в данном случае это полностью метионин.
Даже при работе с обычными эукариотическими последовательностями, такими как геном дрожжей , часто желательно иметь возможность использовать альтернативные таблицы перевода, а именно для трансляции митохондриальных генов. В настоящее время группа таксономии NCBI определяет следующие таблицы перевода для перевода последовательностей в GenBank : [28]
{{cite journal}}: CS1 maint: multiple names: authors list (link)