
Меланин ( / ˈ m ɛ l ə n ɪ n / ; отдревнегреческого μέλας(mélas) «чёрный, тёмный») — семействобиомолекул,организованных в видеолигомеровилиполимеров, которые, помимо прочих функций, обеспечиваютпигментымногихорганизмов.[1]Пигменты меланина вырабатываются в специализированной группе клеток, известных какмеланоциты.
Существует пять основных типов меланина: эумеланин, феомеланин, нейромеланин , алломеланин и пиомеланин. [2] Меланин вырабатывается посредством многоступенчатого химического процесса, известного как меланогенез , где за окислением аминокислоты тирозина следует полимеризация . Феомеланин — это цистеинированная форма, содержащая полибензотиазиновые части, которые в значительной степени отвечают за красный или желтый оттенок, придаваемый некоторым цветам кожи или волос. Нейромеланин обнаружен в мозге. Были проведены исследования для изучения его эффективности при лечении нейродегенеративных заболеваний, таких как болезнь Паркинсона . [3] Алломеланин и пиомеланин — это два типа безазотистого меланина.
Фенотипическая цветовая вариация , наблюдаемая в эпидермисе и волосах млекопитающих , в первую очередь определяется уровнями эумеланина и феомеланина в исследуемой ткани. У среднестатистического человека эумеланин более распространен в тканях, требующих фотозащиты , таких как эпидермис и ретинальный пигментный эпителий . [4] У здоровых людей эпидермальный меланин коррелирует с воздействием УФ-излучения, в то время как ретинальный меланин, как было обнаружено, коррелирует с возрастом, при этом его уровни уменьшаются в 2,5 раза между первым и девятым десятилетиями жизни, [5] что объясняется окислительной деградацией, опосредованной активными формами кислорода, генерируемыми через липофусцин -зависимые пути. [6] При отсутствии альбинизма или гиперпигментации человеческий эпидермис содержит приблизительно 74% эумеланина и 26% феомеланина, в значительной степени независимо от тона кожи, при этом содержание эумеланина колеблется в пределах 71,8–78,9%, а феомеланина — в пределах 21,1–28,2%. [7] Общее содержание меланина в эпидермисе колеблется от примерно 0 мкг/мг в эпидермальной ткани альбиноса [8] до >10 мкг/мг в более темной ткани. [9]
В коже человека меланогенез инициируется воздействием УФ-излучения , в результате чего кожа темнеет. Эумеланин является эффективным поглотителем света; пигмент способен рассеивать более 99,9% поглощенного УФ-излучения. [10] Из-за этого свойства эумеланин, как полагают, защищает клетки кожи от повреждения УФ-излучением А и В, снижая риск истощения фолиевой кислоты и деградации дермы. Воздействие УФ-излучения связано с повышенным риском злокачественной меланомы , рака меланоцитов (клеток меланина). Исследования показали более низкую заболеваемость раком кожи у людей с более концентрированным меланином, т. е. более темным тоном кожи . [11]
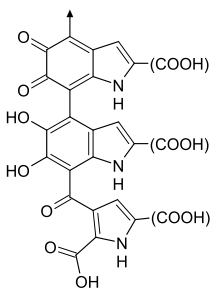
Эумеланин имеет две формы, связанные с 5,6-дигидроксииндолом (DHI) и 5,6-дигидроксииндол-2-карбоновой кислотой (DHICA). Эумеланин, полученный из DHI, темно-коричневый или черный и нерастворимый, а эумеланин, полученный из DHICA, более светлый и растворимый в щелочи. Оба эумеланина возникают в результате окисления тирозина в специализированных органеллах, называемых меланосомами . Эта реакция катализируется ферментом тирозиназой . Первоначальный продукт, допахинон, может превращаться либо в 5,6-дигидроксииндол (DHI), либо в 5,6-дигидроксииндол-2-карбоновую кислоту (DHICA). DHI и DHICA окисляются, а затем полимеризуются, образуя два эумеланина. [12]
В естественных условиях DHI и DHICA часто сополимеризуются, что приводит к образованию ряда полимеров эумеланина. Эти полимеры вносят вклад в разнообразие компонентов меланина в коже и волосах человека, от светло-желтого/красного феомеланина до светло-коричневого эумеланина, обогащенного DHICA, и темно-коричневого или черного эумеланина, обогащенного DHI. Эти конечные полимеры различаются по растворимости и цвету. [12]
Анализ высокопигментированной кожи ( тип V и VI по Фицпатрику) показывает, что DHI-эумеланин составляет наибольшую часть, приблизительно 60–70%, за ним следует DHICA-эумеланин в количестве 25–35%, а феомеланин всего 2–8%. Примечательно, что в то время как обогащение DHI-эумеланином происходит во время загара , оно сопровождается уменьшением DHICA-эумеланина и феомеланина. [12] Небольшое количество черного эумеланина при отсутствии других пигментов вызывает седые волосы. Небольшое количество эумеланина при отсутствии других пигментов вызывает светлые волосы. [13] Эумеланин присутствует в коже и волосах и т. д.
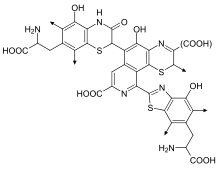
Феомеланины (или феомеланины) придают волосам оттенки от желтоватого до красноватого. [14] Феомеланины особенно концентрируются в губах, сосках, головке полового члена и влагалище. [15] Когда небольшое количество эумеланина в волосах (который в противном случае привел бы к светлым волосам) смешивается с феомеланином, в результате получаются оранжевые волосы, которые обычно называют «рыжими» или «рыжими» . Феомеланин также присутствует в коже, и поэтому рыжеволосые люди часто имеют более розоватый оттенок своей кожи. Воздействие ультрафиолетового света на кожу увеличивает содержание феомеланина, как и эумеланина; но вместо того, чтобы поглощать свет, феомеланин в волосах и коже отражает желтый или красный свет, что может увеличить повреждение от воздействия УФ-излучения. [16]
Производство феомеланина в значительной степени зависит от доступности цистеина , который транспортируется в меланосому, реагируя с допахиноном с образованием цис-допы. Затем цис-допа претерпевает несколько преобразований, прежде чем сформировать феомеланин. [12] С химической точки зрения феомеланины отличаются от эумеланинов тем, что олигомерная структура включает бензотиазиновые и бензотиазольные единицы, которые производятся [17] вместо DHI и DHICA , когда присутствует аминокислота L-цистеин .
Феомеланины, в отличие от эуэманинов, редко встречаются у низших организмов [18], и утверждается, что они являются «эволюционным новшеством в родословной четвероногих» [19], но недавние исследования обнаружили их также у некоторых рыб. [20]
Нейромеланин (НМ) — это нерастворимый полимерный пигмент, вырабатываемый в определенных популяциях катехоламинергических нейронов в мозге. У людей самое большое количество НМ, который присутствует в меньших количествах у других приматов и полностью отсутствует у многих других видов. [21] Биологическая функция остается неизвестной, хотя было показано, что человеческий НМ эффективно связывает переходные металлы , такие как железо, а также другие потенциально токсичные молекулы. Поэтому он может играть решающую роль в апоптозе и связанной с ним болезни Паркинсона . [22]
Вплоть до 1960-х годов меланин классифицировался на эумеланин и феомеланин. Однако в 1955 году был открыт меланин, связанный с нервными клетками, нейромеланин. В 1972 году была открыта водорастворимая форма, пиомеланин. В 1976 году в природе был обнаружен алломеланин, пятая форма меланинов. [2]


Пептидомеланин — еще одна водорастворимая форма меланина. [23] Было обнаружено, что он секретируется в окружающую среду прорастающими спорами Aspergillus niger (штамм: melanoliber). Пептидомеланин образуется как сополимер между эумеланином L-ДОФА и короткими пептидами , которые образуют «корону», отвечающую за растворимость вещества. Пептидные цепи связаны с основным полимером L-ДОФА с помощью пептидных связей. Это приводит к предложенному биосинтетическому процессу, включающему гидроксилирование тирозинилированных пептидов, образованных с помощью протеаз во время спорогенеза, которые затем включаются автоокислительным путем в растущий основной полимер L-ДОФА.
Можно обогатить меланин селеном вместо серы . Этот селеновый аналог феомеланина был успешно синтезирован химическими и биосинтетическими путями с использованием селеноцистина в качестве исходного сырья. [24] Из-за более высокого атомного номера селена можно ожидать, что полученный селеномеланин обеспечит лучшую защиту от ионизирующего излучения по сравнению с другими известными формами меланина. Эта защита была продемонстрирована в экспериментах с радиацией на клетках человека и бактериях, что открывает возможность применения в космических полетах. [25]
Трихохромы (ранее называвшиеся трихозидеринами) — это пигменты, которые производятся тем же метаболическим путем, что и эумеланины и феомеланины, но в отличие от этих молекул они имеют низкую молекулярную массу. Они встречаются в некоторых рыжих человеческих волосах. [26]

У людей меланин является основным фактором, определяющим цвет кожи . Он также содержится в волосах, пигментированной ткани, лежащей в основе радужной оболочки глаза, и в сосудистой полоске внутреннего уха . В мозге ткани с меланином включают продолговатый мозг и пигментосодержащие нейроны в областях ствола мозга , таких как голубое пятно . Он также встречается в сетчатой оболочке надпочечников . [ 18]
Меланин в коже вырабатывается меланоцитами , которые находятся в базальном слое эпидермиса . Хотя, в целом, люди обладают схожей концентрацией меланоцитов в своей коже, меланоциты у некоторых людей и этнических групп вырабатывают различное количество меланина. Соотношение эумеланина (74%) и феомеланина (26%) в эпидермисе постоянно независимо от степени пигментации. [ 27] У некоторых людей в организме очень мало или совсем нет синтеза меланина, состояние, известное как альбинизм . [28]
Поскольку меланин представляет собой совокупность более мелких молекул-компонентов, существует много различных типов меланина с различными пропорциями и схемами связывания этих молекул-компонентов. И феомеланин, и эумеланин встречаются в коже и волосах человека, но эумеланин является наиболее распространенным меланином у людей, а также формой, которая, скорее всего, будет дефицитной при альбинизме. [29]
Меланины выполняют очень разнообразные роли и функции в различных организмах. Одна из форм меланина входит в состав чернил, используемых многими головоногими моллюсками (см. Чернила головоногих моллюсков ) в качестве защитного механизма от хищников. Меланины также защищают микроорганизмы, такие как бактерии и грибки, от стрессов, которые влекут за собой повреждение клеток, таких как ультрафиолетовое излучение солнца и активные формы кислорода . Меланин также защищает от повреждений, вызванных высокими температурами, химическими стрессами (такими как тяжелые металлы и окислители ) и биохимическими угрозами (такими как защита хозяина от вторгающихся микробов). [30] Поэтому во многих патогенных микробах (например, в грибке Cryptococcus neoformans ) меланины, по-видимому, играют важную роль в вирулентности и патогенности , защищая микроб от иммунных реакций его хозяина . У беспозвоночных основным аспектом врожденной иммунной системы защиты от вторгающихся патогенов является меланин. В течение нескольких минут после заражения микроб инкапсулируется в меланин (меланизация), и считается, что образование побочных продуктов свободных радикалов во время формирования этой капсулы способствует их уничтожению. [31] Некоторые виды грибов, называемые радиотрофными грибами , по-видимому, способны использовать меланин в качестве фотосинтетического пигмента , который позволяет им улавливать гамма-лучи [32] и использовать эту энергию для роста. [33]
У рыб меланин встречается не только в коже, но и во внутренних органах, таких как глаза. Большинство видов рыб используют эумеланин, [34] [19] но Stegastes apicalis и Cyprinus carpio используют вместо него феомеланин. [20] [35]
Более темные перья птиц обязаны своим цветом меланину и менее подвержены разрушению бактериями, чем непигментированные или содержащие каротиноидные пигменты. [36] Перья, содержащие меланин, также на 39% более устойчивы к истиранию, чем те, которые его не содержат, потому что гранулы меланина помогают заполнить пространство между кератиновыми нитями, которые образуют перья. [37] [38] Синтез феомеланина у птиц подразумевает потребление цистеина, полунезаменимой аминокислоты, которая необходима для синтеза антиоксиданта глутатиона (GSH), но которая может быть токсичной, если ее в избытке в рационе. Действительно, многие плотоядные птицы, в рационе которых высокое содержание белка, демонстрируют окраску на основе феомеланина. [39]
Меланин также важен для пигментации млекопитающих . [40] Рисунок шерсти млекопитающих определяется геном агути , который регулирует распределение меланина. [41] [42] Механизмы гена были тщательно изучены на мышах, чтобы обеспечить понимание разнообразия рисунков шерсти млекопитающих. [43]
Было замечено, что меланин у членистоногих откладывается слоями, создавая таким образом брэгговский отражатель с переменным показателем преломления. Когда масштаб этого рисунка совпадает с длиной волны видимого света, возникает структурная окраска : придавая ряду видов радужный цвет. [44] [45]
Паукообразные — одна из немногих групп, в которой меланин не так легко обнаружить, хотя исследователи обнаружили данные, свидетельствующие о том, что пауки на самом деле вырабатывают меланин. [46]
Некоторые виды моли, включая лесную тигровую моль , преобразуют ресурсы в меланин для улучшения своей терморегуляции. Поскольку лесная тигровая моль имеет популяции в большом диапазоне широт, было замечено, что более северные популяции показали более высокие показатели меланизации. Как в желтом, так и в белом мужском фенотипе лесной тигровой моли, особи с большим количеством меланина имели повышенную способность удерживать тепло, но повышенную скорость хищничества из-за более слабого и менее эффективного апосематического сигнала. [47]
Меланин защищает мух и мышей Drosophila от повреждения ДНК не-УФ-излучением. [48] Важные исследования на моделях Drosophila включают Hopwood et al. , 1985. [48] Большая часть нашего понимания радиозащитных эффектов меланина против гамма-излучения получена в лабораториях и исследовательских группах Ирмы Моссе. [49] [50] [51] [52] [53] [54] [55] : 1151 Моссе начала заниматься радиобиологией в советское время, получила все большую поддержку от правительства в связи с открытием радиотрофных микробов в Чернобыле и с 2022 года продолжает работу в Белорусском институте генетики и цитологии. [54] Ее наиболее значительный вклад - Mosse et al. , 2000 на мышах [49] [50] [51] [52] [53] [54] [55] : 1151 , но также включает Mosse et al. , 1994, [53] Mosse et al. , 1997, [53] Mosse et al. , 1998, [52] Mosse et al. , 2001, [53] Mosse et al. , 2002, [52] [53] Mosse et al. , 2006, [52] [53] Mosse et al. , 2007 [53] и Mosse et al. , 2008. [53][обновлять]

Меланин, вырабатываемый растениями, иногда называют «катехиновыми меланинами», поскольку они могут давать катехол при щелочном плавлении. Это обычно наблюдается при ферментативном потемнении фруктов, таких как бананы. Меланин из скорлупы каштана может использоваться в качестве антиоксиданта и красителя. [56] Биосинтез включает окисление индол-5,6-хинона полифенолоксидазой типа тирозиназы из тирозина и катехоламинов , что приводит к образованию катехолового меланина. Несмотря на это, многие растения содержат соединения, которые подавляют выработку меланинов. [57]
В настоящее время известно, что меланины не имеют единой структуры или стехиометрии. [ необходима цитата ] Тем не менее, химические базы данных, такие как PubChem, включают структурные и эмпирические формулы; обычно 3,8-диметил-2,7-дигидробензо[1,2,3- cd :4,5,6 -c ′ d ′]дииндол-4,5,9,10-тетрон . Его можно рассматривать как единый мономер, который учитывает измеренный элементный состав и некоторые свойства меланина, но вряд ли его можно найти в природе. [58] Солано [58] утверждает, что эта вводящая в заблуждение тенденция вытекает из сообщения об эмпирической формуле в 1948 году, [59] но не приводит никаких других исторических подробностей.
Первый этап биосинтетического пути как эумеланинов, так и феомеланинов катализируется тирозиназой . [ 60 ]
Допахинон может соединяться с цистеином двумя путями с образованием бензотиазинов и феомеланинов.
Кроме того, допахинон может преобразовываться в лейкодопахром и следовать еще двум путям к эумеланинам.
Подробные метаболические пути можно найти в базе данных KEGG (см. Внешние ссылки).
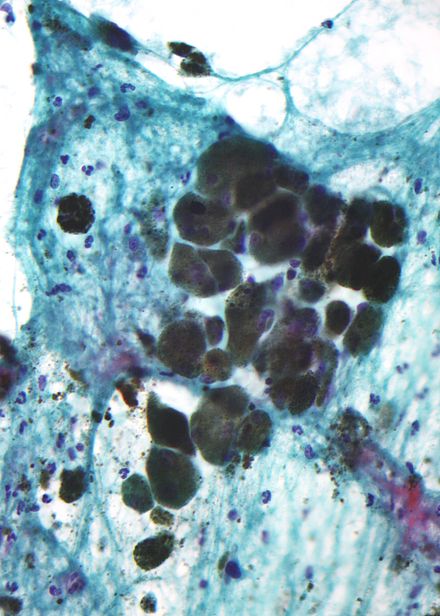
Меланин коричневый, непреломляющий свет и мелкозернистый, с отдельными гранулами диаметром менее 800 нанометров. Это отличает меланин от обычных пигментов распада крови , которые крупнее, плотнее и преломляющие свет, и имеют цвет от зеленого до желтого или красно-коричневого. В сильно пигментированных поражениях плотные агрегаты меланина могут скрывать гистологические детали. Разбавленный раствор перманганата калия является эффективным отбеливателем меланина. [61]
Существует около девяти типов окулокутантного альбинизма , который в основном является аутосомно-рецессивным заболеванием. У некоторых этнических групп наблюдается более высокая частота различных форм. Например, наиболее распространенный тип, называемый окулокутантным альбинизмом типа 2 (OCA2), особенно часто встречается среди людей чернокожего африканского происхождения и белых европейцев. Люди с OCA2 обычно имеют светлую кожу, но часто не такую бледную, как OCA1. У них (OCA2 или OCA1? см. комментарии в разделе «История») волосы от светло-русых до золотистых, клубнично-русых или даже каштановых, и чаще всего голубые глаза. 98,7–100% современных европейцев являются носителями производного аллеля SLC24A5 , известной причины несиндромального окулокутантного альбинизма. Это аутосомно-рецессивное заболевание, характеризующееся врожденным снижением или отсутствием пигмента меланина в коже, волосах и глазах. По оценкам, частота OCA2 среди афроамериканцев составляет 1 на 10 000, что контрастирует с частотой 1 на 36 000 у белых американцев. [62] В некоторых африканских странах частота этого расстройства еще выше, от 1 на 2 000 до 1 на 5 000. [63] Другая форма альбинизма, «желтый окулокутанный альбинизм», по-видимому, более распространена среди амишей , которые в основном имеют швейцарское и немецкое происхождение. Люди с этим вариантом IB расстройства обычно имеют белые волосы и кожу при рождении, но быстро развивают нормальную пигментацию кожи в младенчестве. [63]
Глазной альбинизм влияет не только на пигментацию глаз, но и на остроту зрения. Люди с альбинизмом обычно плохо проходят тесты, в диапазоне от 20/60 до 20/400. Кроме того, две формы альбинизма, примерно 1 из 2700 наиболее распространены среди людей пуэрториканского происхождения, связаны со смертностью, выходящей за рамки смертей, связанных с меланомой.
Связь между альбинизмом и глухотой хорошо известна, хотя и плохо изучена. В своем трактате 1859 года «О происхождении видов » Чарльз Дарвин заметил, что «кошки, которые полностью белые и имеют голубые глаза, как правило, глухие». [64] У людей гипопигментация и глухота встречаются вместе при редком синдроме Ваарденбурга , преимущественно наблюдаемом среди хопи в Северной Америке. [65] Частота альбинизма у индейцев хопи оценивается примерно в 1 из 200 человек. Похожие модели альбинизма и глухоты были обнаружены у других млекопитающих, включая собак и грызунов. Однако недостаток меланина как таковой, по-видимому, не является прямой причиной глухоты, связанной с гипопигментацией, поскольку большинство людей, у которых отсутствуют ферменты, необходимые для синтеза меланина, имеют нормальную слуховую функцию. [66] Вместо этого отсутствие меланоцитов в сосудистой полоске внутреннего уха приводит к кохлеарным нарушениям, [67] хотя причины этого до конца не изучены.
При болезни Паркинсона, расстройстве, которое влияет на нейромоторное функционирование, наблюдается снижение нейромеланина в черной субстанции и голубом пятне в результате специфического выпадения дофаминергических и норадренергических пигментированных нейронов. Это приводит к снижению синтеза дофамина и норадреналина . Хотя не было выявлено никакой корреляции между расой и уровнем нейромеланина в черной субстанции, значительно более низкая заболеваемость Паркинсона у чернокожих, чем у белых, «побудила некоторых предположить, что кожный меланин может каким-то образом защищать нейромеланина в черной субстанции от внешних токсинов». [68]
В дополнение к дефициту меланина, молекулярная масса полимера меланина может быть уменьшена различными факторами, такими как окислительный стресс, воздействие света, нарушение его связи с белками меланосомального матрикса , изменения pH или локальные концентрации ионов металлов. Было высказано предположение, что снижение молекулярной массы или снижение степени полимеризации глазного меланина превращает обычно антиоксидантный полимер в прооксидант . В своем прооксидантном состоянии меланин, как предполагается, участвует в возникновении и прогрессировании дегенерации желтого пятна и меланомы . [69] Разагилин , важный препарат монотерапии при болезни Паркинсона, обладает свойствами связывания меланина и свойствами уменьшения опухоли меланомы. [70]
Однако более высокие уровни эумеланина также могут быть недостатком, помимо более высокой предрасположенности к дефициту витамина D. Темная кожа является осложняющим фактором при лазерном удалении винных пятен . Эффективные при лечении белой кожи, в целом, лазеры менее успешны при удалении винных пятен у людей азиатского или африканского происхождения. Более высокие концентрации меланина у людей с более темной кожей просто рассеивают и поглощают лазерное излучение, препятствуя поглощению света целевой тканью. Аналогичным образом меланин может осложнить лазерное лечение других дерматологических заболеваний у людей с более темной кожей.
Веснушки и родинки образуются там, где в коже есть локализованная концентрация меланина. Они тесно связаны с бледной кожей.
Никотин имеет сродство к меланинсодержащим тканям из-за его функции предшественника в синтезе меланина или его необратимого связывания с меланином. Предполагается, что это лежит в основе повышенной никотиновой зависимости и более низких показателей отказа от курения у темнокожих людей. [71]
Меланоциты вставляют гранулы меланина в специализированные клеточные пузырьки , называемые меланосомами . Затем они переносятся в клетки кератиноцитов человеческого эпидермиса . Меланосомы в каждой клетке-реципиенте накапливаются на вершине клеточного ядра , где они защищают ядерную ДНК от мутаций, вызванных ионизирующим излучением ультрафиолетовых лучей солнца . В целом, люди, чьи предки долгое время жили в регионах земного шара вблизи экватора, имеют большее количество эумеланина в своей коже. Это делает их кожу коричневой или черной и защищает ее от высоких уровней воздействия солнца, которые чаще приводят к меланомам у людей со светлой кожей. [72]
Не все эффекты пигментации выгодны. Пигментация увеличивает тепловую нагрузку в жарком климате, и темнокожие люди поглощают на 30% больше тепла от солнечного света, чем очень светлокожие люди, хотя этот фактор может быть компенсирован более обильным потоотделением. В холодном климате темная кожа влечет за собой большую потерю тепла за счет излучения. Пигментация также препятствует синтезу витамина D. Поскольку пигментация, по-видимому, не совсем выгодна для жизни в тропиках, были выдвинуты другие гипотезы о ее биологическом значении; например, вторичное явление, вызванное адаптацией к паразитам и тропическим болезням. [73]
У ранних людей развился темный цвет кожи как адаптация к потере волос на теле, что усилило воздействие УФ-излучения. До развития безволосости у ранних людей могла быть светлая кожа под мехом, похожая на ту, что встречается у других приматов . [74] Анатомически современные люди появились в Африке между 200 000 и 100 000 лет назад, [75] а затем заселили остальной мир путем миграции между 80 000 и 50 000 лет назад, в некоторых областях скрещивая с определенными архаичными видами людей ( неандертальцами , денисовцами и, возможно, другими). [76] У первых современных людей была более темная кожа, как у коренных жителей Африки сегодня. После миграции и расселения в Азии и Европе селективное давление темной УФ-защитной кожи уменьшилось там, где излучение солнца было менее интенсивным. Это привело к нынешнему диапазону цвета кожи человека. Из двух распространенных вариантов генов, которые, как известно, связаны с бледной кожей человека, Mc1r , по-видимому, не подвергся положительному отбору [77] , тогда как SLC24A5 подвергся положительному отбору [78] .
Как и в случае с народами, мигрирующими на север, люди со светлой кожей, мигрирующие к экватору, акклиматизируются к гораздо более сильному солнечному излучению. Природа выбирает меньше меланина, когда ультрафиолетовое излучение слабое. Кожа большинства людей темнеет под воздействием ультрафиолетового света, давая им большую защиту, когда это необходимо. Это физиологическая цель загара . Темнокожие люди, которые вырабатывают больше защищающего кожу эумеланина, имеют большую защиту от солнечных ожогов и развития меланомы, потенциально смертельной формы рака кожи, а также других проблем со здоровьем, связанных с воздействием сильного солнечного излучения , включая фотодеградацию некоторых витаминов, таких как рибофлавины , каротиноиды , токоферол и фолат . [79]
Меланин в глазах, в радужной оболочке и сосудистой оболочке , помогает защищать от ультрафиолетового и высокочастотного видимого света ; люди с голубыми, зелеными и серыми глазами больше подвержены риску проблем с глазами, связанных с солнцем. Кроме того, хрусталик глаза желтеет с возрастом, обеспечивая дополнительную защиту. Однако хрусталик также становится более жестким с возрастом, теряя большую часть своей аккомодации — способности менять форму для фокусировки с дальнего на ближний — ущерб, вероятно, из-за сшивания белков, вызванного воздействием УФ-излучения.
Недавние исследования показывают, что меланин может выполнять защитную функцию, отличную от фотозащиты. [80] Меланин способен эффективно хелатировать ионы металлов через свои карбоксилатные и фенольные гидроксильные группы, часто гораздо более эффективно, чем мощный хелатирующий лиганд этилендиаминтетраацетат (ЭДТА). Таким образом, он может служить для секвестрации потенциально токсичных ионов металлов, защищая остальную часть клетки. Эта гипотеза подтверждается тем фактом, что потеря нейромеланина, наблюдаемая при болезни Паркинсона, сопровождается повышением уровня железа в мозге.
Существуют доказательства существования высокосшитого гетерополимера , ковалентно связанного с меланопротеинами матричного каркаса. [81] Было высказано предположение, что способность меланина действовать как антиоксидант прямо пропорциональна его степени полимеризации или молекулярной массе . [82] Неоптимальные условия для эффективной полимеризации мономеров меланина могут привести к образованию прооксидантного меланина с более низкой молекулярной массой, что связано с возникновением и прогрессированием дегенерации желтого пятна и меланомы . [83] Сигнальные пути , которые повышают регуляцию меланизации в ретинальном пигментном эпителии (RPE), также могут быть вовлечены в снижение фагоцитоза внешнего сегмента палочки RPE. Это явление частично объясняется щадящей фовеолярной дегенерацией при дегенерации желтого пятна . [84]
Сильно пигментированные клетки меланомы имеют модуль Юнга около 4,93 кПа, по сравнению с непигментированными клетками, имеющими значение 0,98 кПа. [85] Эластичность клеток меланомы имеет решающее значение для метастазирования и роста ; непигментированные опухоли были больше, чем пигментированные опухоли, и распространялись гораздо легче. Пигментированные и непигментированные клетки присутствуют в опухолях меланомы , поэтому они обе могут быть устойчивыми к лекарствам и метастатическими. [85]
{{cite journal}}: CS1 maint: дата и год ( ссылка )