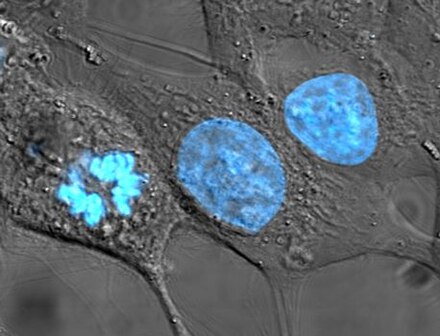
Ядро клетки (от латинского kernel или nuculeus «ядро, семя»; мн.: ядра ) представляет собой мембраносвязанную органеллу, обнаруженную в эукариотических клетках . Эукариотические клетки обычно имеют одно ядро, но некоторые типы клеток, такие как эритроциты млекопитающих , не имеют ядер, а некоторые другие, включая остеокласты , имеют их много . Основными структурами, составляющими ядро, являются ядерная оболочка — двойная мембрана, окружающая всю органеллу и изолирующая ее содержимое от клеточной цитоплазмы ; и ядерная матрица , сеть внутри ядра, которая обеспечивает механическую поддержку.
Ядро клетки содержит почти весь геном клетки . Ядерная ДНК часто состоит из нескольких хромосом — длинных нитей ДНК , усеянных различными белками , такими как гистоны , которые защищают и организуют ДНК. Гены в этих хромосомах структурированы таким образом, чтобы способствовать функционированию клеток . Ядро поддерживает целостность генов и контролирует деятельность клетки, регулируя экспрессию генов .
Поскольку ядерная оболочка непроницаема для крупных молекул , ядерные поры необходимы для регулирования ядерного транспорта молекул через оболочку. Поры пересекают обе ядерные мембраны, обеспечивая канал , через который более крупные молекулы должны активно транспортироваться белками-переносчиками, обеспечивая при этом свободное перемещение малых молекул и ионов . Перемещение крупных молекул, таких как белки и РНК, через поры необходимо как для экспрессии генов, так и для поддержания хромосом. Хотя внутренняя часть ядра не содержит каких-либо мембраносвязанных субкомпартментов, существует ряд ядерных телец , состоящих из уникальных белков, молекул РНК и определенных частей хромосом. Самым известным из них является ядрышко , участвующее в сборке рибосом .
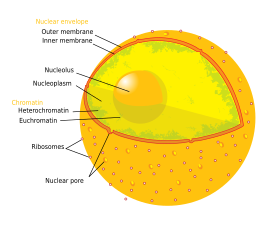
Ядро содержит почти всю ДНК клетки , окружено сетью волокнистых промежуточных нитей , называемых ядерным матриксом , и окружено двойной мембраной, называемой ядерной оболочкой . Ядерная оболочка отделяет жидкость внутри ядра, называемую нуклеоплазмой , от остальной части клетки. Размер ядра коррелирует с размером клетки, и это соотношение наблюдается для различных типов и видов клеток. [1] У эукариот ядро во многих клетках обычно занимает 10% объема клетки. [2] : 178 Ядро — самая крупная органелла в клетках животных. [3] : 12 В клетках человека диаметр ядра составляет примерно шесть микрометров (мкм). [2] : 179

Ядерная оболочка состоит из двух мембран — внутренней и наружной ядерной мембраны , перфорированных ядерными порами . [2] : 649 Вместе эти мембраны служат для отделения генетического материала клетки от остального содержимого клетки и позволяют ядру поддерживать среду, отличную от остальной части клетки. Несмотря на близкое расположение вокруг большей части ядра, эти две мембраны существенно различаются по форме и содержимому. Внутренняя мембрана окружает ядерное содержимое, обеспечивая его определяющий край. [3] : 14 Различные белки, встроенные во внутреннюю мембрану, связывают промежуточные нити, которые придают ядру его структуру. [2] : 649 Наружная мембрана окружает внутреннюю мембрану и является продолжением прилегающей мембраны эндоплазматического ретикулума . [2] : 649 Внешняя ядерная мембрана, являющаяся частью мембраны эндоплазматической сети, усеяна рибосомами , которые активно транслируют белки через мембрану. [2] : 649 Пространство между двумя мембранами называется перинуклеарным пространством и переходит в просвет эндоплазматической сети . [2] : 649
В ядерной оболочке млекопитающих имеется от 3000 до 4000 комплексов ядерных пор (NPC), перфорирующих оболочку. [2] : 650 Каждый NPC содержит восьмикратно симметричную кольцевую структуру в месте слияния внутренней и внешней мембран. [4] Количество NPC может значительно различаться в зависимости от типа клеток; мелких глиальных клеток насчитывается всего около нескольких сотен, а крупных клеток Пуркинье - около 20 000. [2] : 650 NPC обеспечивает избирательный транспорт молекул между нуклеоплазмой и цитозолем . [5] Комплекс ядерных пор состоит примерно из тридцати различных белков, известных как нуклеопорины . [2] : 649 Молекулярная масса пор составляет около 60–80 миллионов дальтон и состоит из от 50 (у дрожжей ) до нескольких сотен белков (у позвоночных ). [3] : 622–4 Общий диаметр пор 100 нм; однако ширина щели, через которую молекулы свободно диффундируют, составляет всего около 9 нм из-за присутствия регуляторных систем в центре поры. Этот размер избирательно позволяет проходить небольшим водорастворимым молекулам, предотвращая при этом несанкционированный вход или выход из ядра более крупных молекул, таких как нуклеиновые кислоты и более крупные белки. Вместо этого эти большие молекулы должны активно транспортироваться в ядро. К кольцу прикреплена структура, называемая ядерной корзиной , которая простирается в нуклеоплазму, и ряд нитевидных отростков, доходящих до цитоплазмы. Обе структуры служат посредником связывания с ядерными транспортными белками. [6] : 509–10.
Большинство белков, субъединиц рибосом и некоторые РНК транспортируются через комплексы пор в процессе, опосредованном семейством транспортных факторов, известных как кариоферины . Те кариоферины, которые опосредуют движение в ядро, также называются импортинами, тогда как те, которые опосредуют движение из ядра, называются экспортинами. Большинство кариоферинов взаимодействуют непосредственно со своим грузом, хотя некоторые используют адаптерные белки . [7] Стероидные гормоны , такие как кортизол и альдостерон , а также другие небольшие жирорастворимые молекулы, участвующие в межклеточной передаче сигналов , могут диффундировать через клеточную мембрану в цитоплазму, где они связывают белки ядерных рецепторов , которые доставляются в ядро. Там они служат факторами транскрипции , когда связаны со своим лигандом ; в отсутствие лиганда многие такие рецепторы функционируют как деацетилазы гистонов , которые подавляют экспрессию генов. [6] : 488
В животных клетках две сети промежуточных филаментов обеспечивают ядру механическую поддержку: ядерная пластинка образует организованную сеть на внутренней стороне оболочки, тогда как менее организованная поддержка обеспечивается на цитозольной стороне оболочки. Обе системы обеспечивают структурную поддержку ядерной оболочки и мест закрепления хромосом и ядерных пор. [8]
Ядерная пластинка состоит в основном из белков -ламинов . Как и все белки, ламины синтезируются в цитоплазме, а затем транспортируются внутрь ядра, где они собираются перед включением в существующую сеть ядерных пластинок. [9] [10] Ламины, обнаруженные на цитозольной поверхности мембраны, такие как эмерин и несприн , связываются с цитоскелетом, обеспечивая структурную поддержку. Ламины также обнаруживаются внутри нуклеоплазмы, где они образуют другую регулярную структуру, известную как нуклеоплазматическая завеса [11] [12] , которую можно увидеть с помощью флуоресцентной микроскопии . Фактическая функция завесы не ясна, хотя она исключена из ядрышка и присутствует во время интерфазы . [13] Структуры ламина, составляющие завесу, такие как LEM3 , связывают хроматин, и нарушение их структуры ингибирует транскрипцию генов, кодирующих белок. [14]
Как и компоненты других промежуточных нитей, мономер ламина содержит альфа-спиральный домен, используемый двумя мономерами для свертывания друг вокруг друга, образуя димерную структуру, называемую спиральной спиралью . Две из этих димерных структур затем соединяются бок о бок в антипараллельном расположении, образуя тетрамер , называемый протофиламентом . Восемь из этих протофиламентов образуют боковое расположение, которое скручивается, образуя веревкообразную нить . Эти нити можно собирать или разбирать динамически, а это означает, что изменения длины нити зависят от конкурирующих скоростей добавления и удаления нитей. [8]
Мутации в генах ламинов, приводящие к дефектам сборки филаментов, вызывают группу редких генетических нарушений, известных как ламинопатии . Наиболее заметной ламинопатией является семейство заболеваний, известных как прогерия , которые вызывают преждевременное старение у людей с этим заболеванием. Точный механизм, посредством которого связанные биохимические изменения приводят к старению фенотипа , не совсем понятен. [15]

Ядро клетки содержит большую часть генетического материала клетки в виде множества линейных молекул ДНК, организованных в структуры, называемые хромосомами . Каждая человеческая клетка содержит примерно два метра ДНК. [6] : 405 В течение большей части клеточного цикла они организованы в комплекс ДНК-белок, известный как хроматин , и во время клеточного деления хроматин образует четко определенные хромосомы, знакомые по кариотипу . Вместо этого небольшая часть клеточных генов расположена в митохондриях . [6] : 438
Существует два типа хроматина. Эухроматин является менее компактной формой ДНК и содержит гены, которые часто экспрессируются клеткой. [16] Другой тип, гетерохроматин , является более компактной формой и содержит ДНК, которая нечасто транскрибируется. Эта структура далее подразделяется на факультативный гетерохроматин , состоящий из генов, которые организованы как гетерохроматин только в определенных типах клеток или на определенных стадиях развития, и конститутивный гетерохроматин , который состоит из структурных компонентов хромосом, таких как теломеры и центромеры . [17] Во время интерфазы хроматин организуется в отдельные отдельные участки, [18] называемые хромосомными территориями . [19] Активные гены, которые обычно обнаруживаются в эухроматической области хромосомы, обычно располагаются ближе к границе территории хромосомы. [20]
Антитела к определенным типам организации хроматина, в частности, нуклеосомам , связаны с рядом аутоиммунных заболеваний , таких как системная красная волчанка . [21] Они известны как антиядерные антитела (АНА) и также наблюдаются при рассеянном склерозе как часть общей дисфункции иммунной системы. [22]
Ядрышко — самая крупная из дискретных, плотно окрашенных, безмембранных структур, известных как ядерные тельца, обнаруженных в ядре. Он образуется вокруг тандемных повторов рДНК , ДНК , кодирующей рибосомальную РНК (рРНК). Эти регионы называются регионами ядрышкового организатора (ЯОР). Основные функции ядрышка — синтез рРНК и сборка рибосом . Структурная сплоченность ядрышка зависит от его активности, поскольку сборка рибосом в ядрышке приводит к временной ассоциации ядрышковых компонентов, облегчая дальнейшую сборку рибосом и, следовательно, дальнейшую ассоциацию. Эта модель подтверждается наблюдениями о том, что инактивация рДНК приводит к смешиванию ядрышковых структур. [23]
На первом этапе сборки рибосомы белок, называемый РНК-полимеразой I, транскрибирует рДНК, которая образует большой предшественник пре-рРНК. Он расщепляется на две большие субъединицы рРНК — 5,8S и 28S , а также небольшую субъединицу рРНК 18S . [2] : 328 [24] Транскрипция, посттранскрипционный процессинг и сборка рРНК происходят в ядрышке при помощи небольших молекул ядрышковой РНК (мякРНК), некоторые из которых происходят из сплайсированных интронов информационных РНК, кодирующих гены, связанные с рибосомальная функция. Собранные рибосомальные субъединицы представляют собой самые крупные структуры, прошедшие через ядерные поры . [6] : 526
При наблюдении под электронным микроскопом можно увидеть, что ядрышко состоит из трех различимых областей: самых внутренних фибриллярных центров (FC), окруженных плотным фибриллярным компонентом (DFC) (который содержит фибрилларин и нуклеолин ), который, в свою очередь, граничит с гранулярный компонент (GC) (содержащий белок нуклеофосмин ). Транскрипция рДНК происходит либо в FC, либо на границе FC-DFC, поэтому при повышении транскрипции рДНК в клетке обнаруживается больше FC. Большая часть расщепления и модификации рРНК происходит в DFC, тогда как последние этапы, включающие сборку белка на субъединицы рибосом, происходят в GC. [24]
Помимо ядрышка, ядро содержит ряд других ядерных телец. К ним относятся тельца Кахаля , близнецы тельца Кахаля, полиморфная интерфазная кариосомная ассоциация (PIKA), тельца промиелоцитарного лейкоза (ПМЛ), параспеклы и сплайсинговые крапинки. Хотя о некоторых из этих доменов мало что известно, они важны тем, что показывают, что нуклеоплазма не представляет собой однородную смесь, а скорее содержит организованные функциональные субдомены. [28]
Другие субъядерные структуры появляются как часть аномальных болезненных процессов. Например, в некоторых случаях немалиновой миопатии сообщалось о наличии небольших внутриядерных палочек . Это состояние обычно возникает в результате мутаций актина , а сами палочки состоят из мутантного актина, а также других белков цитоскелета. [30]
Ядро обычно содержит от одной до десяти компактных структур, называемых тельцами Кахаля или спиральными тельцами (CB), диаметр которых составляет от 0,2 до 2,0 мкм в зависимости от типа и вида клеток. [25] Если смотреть под электронным микроскопом, они напоминают клубки запутанной нити [27] и представляют собой плотные очаги распределения белка коилина . [31] CB участвуют в ряде различных ролей, связанных с процессингом РНК, в частности, в созревании малых ядрышковых РНК (snoRNA) и малых ядерных РНК (snRNA), а также модификации мРНК гистонов. [25]
Похожими на тела Кахаля являются тела Близнецов Кахаля, или драгоценные камни, название которых происходит от созвездия Близнецов в связи с их близкими «близнецовыми» отношениями с CB. Драгоценные камни по размеру и форме похожи на CB и практически неотличимы под микроскопом. [31] В отличие от CB, драгоценные камни не содержат малых ядерных рибонуклеопротеинов (snRNP), но содержат белок, называемый выживанием двигательных нейронов (SMN), функция которого связана с биогенезом snRNP. Считается, что драгоценные камни помогают CB в биогенезе мяРНП [32] , хотя на основании данных микроскопии также было высказано предположение, что CB и драгоценные камни представляют собой разные проявления одной и той же структуры. [31] Более поздние ультраструктурные исследования показали, что драгоценные камни являются близнецами тел Кахаля с разницей в койлиновом компоненте; Тельца Кахаля являются SMN-положительными и коилин-положительными, а драгоценные камни SMN-положительными и коилин-отрицательными. [33]
Домены PIKA, или полиморфные интерфазные кариосомные ассоциации, были впервые описаны в микроскопических исследованиях в 1991 году. Их функция остается неясной, хотя не считалось, что они связаны с активной репликацией ДНК, транскрипцией или процессингом РНК. [34] Было обнаружено, что они часто ассоциируются с дискретными доменами, определяемыми плотной локализацией транскрипционного фактора PTF, который способствует транскрипции малых ядерных РНК (мяРНК). [35]
Белок промиелоцитарного лейкоза (ПМЛ-ядерные тельца) представляет собой сферические тельца, разбросанные по нуклеоплазме, размером около 0,1–1,0 мкм. Они известны под рядом других названий, включая ядерный домен 10 (ND10), тельца Кремера и онкогенные домены PML. [36] ПМЛ-ядерные тельца названы в честь одного из их основных компонентов, белка промиелоцитарного лейкоза (ПМЛ). Их часто можно увидеть в ядре в сочетании с тельцами Кахаля и тельцами расщепления. [28] Pml-/- мыши, которые неспособны создавать PML-ядерные тельца, развиваются нормально без очевидных побочных эффектов, показывая, что PML-ядерные тельца не требуются для большинства важных биологических процессов. [37]
Спеклы представляют собой субъядерные структуры, обогащенные факторами сплайсинга премессенджерной РНК и расположенные в интерхроматиновых областях нуклеоплазмы клеток млекопитающих. [38] На уровне флуоресцентного микроскопа они выглядят как неправильные точечные структуры, которые различаются по размеру и форме, а при исследовании электронной микроскопией они видны как скопления интерхроматиновых гранул . Спеклы представляют собой динамические структуры, и их белковые и РНК-белковые компоненты могут непрерывно перемещаться между спеклами и другими местами ядра, включая активные сайты транскрипции. Спеклы могут работать с р53 как усилители активности генов, напрямую усиливая активность определенных генов. Более того, спекл-ассоциирующие и неассоциирующие мишени гена р53 функционально различны. [39]
Исследования состава, структуры и поведения спеклов предоставили модель для понимания функциональной компартментализации ядра и организации механизма экспрессии генов [40], сплайсинга мяРНП [41] [42] и других сплайсинговых белков, необходимых для пре- Процессинг мРНК. [40] Из-за меняющихся потребностей клетки состав и расположение этих телец изменяются в зависимости от транскрипции и регуляции мРНК посредством фосфорилирования специфических белков. [43] Сплайсинговые спеклы также известны как ядерные спеклы (ядерные спеклы), отсеки фактора сплайсинга (SF-отделения), кластеры интерхроматиновых гранул (IGC) и B-снурпосомы . [44] B-снурпосомы обнаружены в ядрах ооцитов амфибий и у эмбрионов Drosophila melanogaster . На электронных микрофотографиях ядер амфибий B-снурпосомы появляются отдельно или прикреплены к тельцам Кахаля. [45] IGCs функционируют как места хранения факторов сплайсинга. [46]
Обнаружено Фоксом и др. в 2002 г. параспеклы представляют собой отсеки неправильной формы в межхроматиновом пространстве ядра. [47] Параспеклы впервые были обнаружены в клетках HeLa, где их обычно 10–30 на ядро, [48] теперь известно, что параспеклы также существуют во всех первичных клетках человека, трансформированных клеточных линиях и срезах тканей. [49] Их название происходит от их распределения в ядре; «пара» — это сокращение от «параллель», а «пятнышки» относятся к точкам сращивания, с которыми они всегда находятся в непосредственной близости. [48]
Параспеклы изолируют ядерные белки и РНК и, таким образом, действуют как молекулярная губка [50] , которая участвует в регуляции экспрессии генов. [51] Кроме того, параспеклы представляют собой динамические структуры, которые изменяются в ответ на изменения клеточной метаболической активности. Они зависят от транскрипции [47] , и в отсутствие транскрипции РНК Pol II параспекл исчезает, а все связанные с ним белковые компоненты (PSP1, p54nrb, PSP2, CFI(m)68 и PSF) образуют перинуклеолярный колпачок в форме полумесяца. ядрышко. Это явление проявляется во время клеточного цикла. В клеточном цикле параспеклы присутствуют во время интерфазы и на протяжении всего митоза , за исключением телофазы . Во время телофазы, когда образуются два дочерних ядра, транскрипция РНК Pol II отсутствует, поэтому вместо этого белковые компоненты образуют перинуклеолярный колпачок. [49]
Фибриллы перихроматина видны только под электронным микроскопом. Они расположены рядом с транскрипционно активным хроматином и предположительно являются сайтами активного процессинга пре-мРНК . [46]
Кластосомы представляют собой небольшие ядерные тельца (0,2–0,5 мкм), имеющие форму толстого кольца из-за периферической капсулы вокруг этих телец. [26] Это имя происходит от греческого klastos — сломанный и soma — тело. [26] Кластосомы обычно не присутствуют в нормальных клетках, поэтому их трудно обнаружить. Они образуются в условиях высокого протеолитического уровня внутри ядра и разрушаются при снижении активности или при обработке клеток ингибиторами протеасом . [26] [52] Нехватка кластосом в клетках указывает на то, что они не необходимы для функции протеасом . [53] Также было показано, что осмотический стресс вызывает образование кластосом. [54] Эти ядерные тельца содержат каталитические и регуляторные субъединицы протеасомы и ее субстратов, что указывает на то, что кластосомы являются местами деградации белков. [53]
Ядро обеспечивает место для генетической транскрипции , которое отделено от места трансляции в цитоплазме, обеспечивая уровни регуляции генов , недоступные прокариотам . Основная функция клеточного ядра — контроль экспрессии генов и опосредование репликации ДНК во время клеточного цикла. [6] : 171
Ядерная оболочка позволяет контролировать содержимое ядра и при необходимости отделяет его от остальной цитоплазмы. Это важно для контроля процессов по обе стороны ядерной мембраны: в большинстве случаев, когда цитоплазматический процесс необходимо ограничить, ключевой участник удаляется в ядро, где он взаимодействует с факторами транскрипции, подавляя выработку определенных ферментов в ядре. путь. Этот регуляторный механизм возникает в случае гликолиза — клеточного пути расщепления глюкозы для производства энергии. Гексокиназа — фермент, ответственный за первую стадию гликолиза, образующую глюкозо-6-фосфат из глюкозы. При высоких концентрациях фруктозо-6-фосфата , молекулы, полученной позже из глюкозо-6-фосфата, белок-регулятор удаляет гексокиназу в ядро [55] , где она образует комплекс репрессора транскрипции с ядерными белками, чтобы снизить экспрессию задействованных генов. в гликолизе. [56]
Чтобы контролировать, какие гены транскрибируются, клетка отделяет некоторые белки-факторы транскрипции, ответственные за регуляцию экспрессии генов, от физического доступа к ДНК до тех пор, пока они не будут активированы другими сигнальными путями. Это предотвращает даже низкие уровни нежелательной экспрессии генов. Например, в случае генов, контролируемых NF-κB , которые участвуют в большинстве воспалительных реакций, транскрипция индуцируется в ответ на сигнальный путь , например, инициируемый сигнальной молекулой TNF-α , связывающейся с рецептором клеточной мембраны, что приводит к рекрутированию сигнальных белков и, в конечном итоге, к активации транскрипционного фактора NF-κB. Сигнал ядерной локализации белка NF-κB позволяет ему транспортироваться через ядерную пору в ядро, где он стимулирует транскрипцию генов-мишеней. [8]
Компартментализация позволяет клетке предотвращать трансляцию несплайсированной мРНК. [57] Эукариотическая мРНК содержит интроны, которые необходимо удалить перед трансляцией для производства функциональных белков. Сплайсинг осуществляется внутри ядра до того, как рибосомы смогут получить доступ к мРНК для трансляции. Без ядра рибосомы будут транслировать вновь транскрибируемую (необработанную) мРНК, что приведет к образованию деформированных и нефункциональных белков. [6] : 108–15.
Основная функция клеточного ядра — контроль экспрессии генов и опосредование репликации ДНК во время клеточного цикла. [6] : 171 Было обнаружено, что репликация происходит локализованно в ядре клетки. В S-фазе интерфазы клеточного цикла; происходит репликация. Вопреки традиционному представлению о движении репликационных вилок вдоль застойной ДНК, возникла концепция репликационных фабрик , которая означает, что репликационные вилки концентрируются в некоторых иммобилизованных «фабричных» областях, через которые нити матричной ДНК проходят, как конвейерные ленты. [58]

Экспрессия генов сначала включает транскрипцию, при которой ДНК используется в качестве матрицы для производства РНК. В случае генов, кодирующих белки, РНК, образующаяся в результате этого процесса, представляет собой информационную РНК (мРНК), которую затем необходимо транслировать рибосомами для образования белка. Поскольку рибосомы расположены вне ядра, вырабатываемую мРНК необходимо экспортировать. [59]
Поскольку ядро является местом транскрипции, оно также содержит множество белков, которые либо непосредственно опосредуют транскрипцию, либо участвуют в регуляции этого процесса. К этим белкам относятся геликазы , которые раскручивают двухцепочечную молекулу ДНК, чтобы облегчить доступ к ней, РНК-полимеразы , которые связываются с промотором ДНК для синтеза растущей молекулы РНК, топоизомеразы , которые изменяют степень сверхспирализации ДНК, помогая ей скручиваться и раскручивать, а также большое разнообразие факторов транскрипции, которые регулируют экспрессию. [60]
Вновь синтезированные молекулы мРНК известны как первичные транскрипты или пре-мРНК. Прежде чем экспортировать в цитоплазму, они должны подвергнуться посттранскрипционной модификации в ядре; мРНК, которая появляется в цитоплазме без этих модификаций, скорее деградирует, чем используется для трансляции белка. Тремя основными модификациями являются 5'-кэпирование , 3'- полиаденилирование и сплайсинг РНК . Находясь в ядре, пре-мРНК связана с различными белками в комплексах, известных как гетерогенные рибонуклеопротеиновые частицы (hnRNP). Добавление 5'-кэпа происходит котранскрипционно и является первым шагом посттранскрипционной модификации. 3'-полиадениновый хвост добавляется только после завершения транскрипции. [6] : 509–18.
Сплайсинг РНК, осуществляемый комплексом, называемым сплайсосомой , представляет собой процесс, при котором интроны или участки ДНК, не кодирующие белок, удаляются из пре-мРНК, а оставшиеся экзоны соединяются, образуя единую непрерывную молекулу. . Этот процесс обычно происходит после 5'-кэпирования и 3'-полиаденилирования, но может начаться до завершения синтеза в транскриптах со многими экзонами. [6] : 494 Многие пре-мРНК можно сплайсировать разными способами с образованием различных зрелых мРНК, которые кодируют разные белковые последовательности . Этот процесс известен как альтернативный сплайсинг и позволяет производить большое количество белков из ограниченного количества ДНК. [61]

Вход и выход крупных молекул из ядра жестко контролируется комплексами ядерных пор. Хотя небольшие молекулы могут проникать в ядро без какой-либо регуляции, [62] макромолекулам, таким как РНК и белки, для входа в ядро требуются ассоциативные кариоферины, называемые импортинами, и для выхода из них экспортины . «Грузовые» белки, которые должны быть транслоцированы из цитоплазмы в ядро, содержат короткие аминокислотные последовательности, известные как сигналы ядерной локализации , которые связываются импортинами, тогда как белки, транспортируемые из ядра в цитоплазму, несут сигналы ядерного экспорта, связанные с экспортинами. Способность импортинов и экспортинов транспортировать свой груз регулируется ГТФазами , ферментами, которые гидролизуют молекулу гуанозинтрифосфата (ГТФ) с высвобождением энергии. Ключевой ГТФазой ядерного транспорта является Ran , которая связана либо с ГТФ, либо с ВВП (гуанозиндифосфатом), в зависимости от того, находится ли она в ядре или цитоплазме. В то время как импортины зависят от RanGTP для отделения от своего груза, экспортинам требуется RanGTP для связывания со своим грузом. [7]
Ядерный импорт зависит от импортина, связывающего свой груз в цитоплазме и переносящего его через ядерную пору в ядро. Внутри ядра RanGTP отделяет груз от импортина, позволяя импортину покинуть ядро и повторно использовать. Ядерный экспорт аналогичен: экспортин связывает груз внутри ядра в процессе, которому способствует RanGTP, выходит через ядерную пору и отделяется от своего груза в цитоплазме. [63]
Существуют специализированные экспортные белки для транслокации зрелых мРНК и тРНК в цитоплазму после завершения посттранскрипционной модификации. Этот механизм контроля качества важен из-за центральной роли этих молекул в трансляции белков. Неправильная экспрессия белка из-за неполного удаления экзонов или неправильного включения аминокислот может иметь негативные последствия для клетки; таким образом, неполностью модифицированная РНК, достигающая цитоплазмы, скорее деградирует, чем используется в трансляции. [6]

В течение своей жизни ядро может расщепляться или разрушаться либо в процессе клеточного деления , либо вследствие апоптоза (процесса запрограммированной гибели клеток ). Во время этих событий структурные компоненты ядра — оболочка и пластинка — могут систематически разрушаться. В большинстве клеток разборка ядерной оболочки знаменует конец профазы митоза . Однако такая разборка ядра не является универсальной особенностью митоза и происходит не во всех клетках. Некоторые одноклеточные эукариоты (например, дрожжи) подвергаются так называемому закрытому митозу , при котором ядерная оболочка остается неповрежденной. При закрытом митозе дочерние хромосомы мигрируют к противоположным полюсам ядра, которое затем делится надвое. Однако клетки высших эукариот обычно подвергаются открытому митозу , который характеризуется разрушением ядерной оболочки. Затем дочерние хромосомы мигрируют к противоположным полюсам митотического веретена, и вокруг них снова собираются новые ядра. [6] : 854
В определенный момент клеточного цикла при открытом митозе клетка делится с образованием двух клеток. Чтобы этот процесс стал возможным, каждая из новых дочерних клеток должна иметь полный набор генов, а этот процесс требует репликации хромосом, а также разделения отдельных наборов. Это происходит посредством реплицированных хромосом, сестринских хроматид , прикрепляющихся к микротрубочкам , которые, в свою очередь, прикрепляются к различным центросомам . Затем сестринские хроматиды можно переместить в отдельные места клетки. Во многих клетках центросома расположена в цитоплазме, вне ядра; микротрубочки не смогут прикрепляться к хроматидам при наличии ядерной оболочки. [64] Таким образом, на ранних стадиях клеточного цикла, начиная с профазы и заканчивая прометафазой , ядерная мембрана демонтируется. [11] Аналогичным образом, в тот же период ядерная пластинка также разбирается, и этот процесс регулируется фосфорилированием ламинов протеинкиназами, такими как протеинкиназа CDC2 . [65] К концу клеточного цикла ядерная мембрана реформируется, и примерно в то же время ядерная пластинка собирается заново путем дефосфорилирования ламинов. [65]
Однако у динофлагеллят ядерная оболочка остается интактной, центросомы располагаются в цитоплазме, а микротрубочки контактируют с хромосомами, центромерные участки которых включены в ядерную оболочку (так называемый закрытый митоз с внеядерным веретеном). У многих других простейших (например, инфузорий , споровиков ) и грибов центросомы внутриядерные, и их ядерная оболочка также не разбирается при делении клеток. [66]
Апоптоз — это контролируемый процесс, при котором структурные компоненты клетки разрушаются, что приводит к гибели клетки. Изменения, связанные с апоптозом, непосредственно затрагивают ядро и его содержимое, например, при конденсации хроматина и распаде ядерной оболочки и пластинки. Разрушение сетей ламинов контролируется специализированными апоптотическими протеазами , называемыми каспазами , которые расщепляют белки ламинов и, таким образом, нарушают структурную целостность ядра. Расщепление ламина иногда используется в качестве лабораторного индикатора активности каспаз в анализах ранней апоптотической активности. [11] Клетки, экспрессирующие мутантные каспазо-резистентные ламины, лишены ядерных изменений, связанных с апоптозом, что позволяет предположить, что ламины играют роль в инициировании событий, которые приводят к апоптотической деградации ядра. [11] Ингибирование сборки ламина само по себе является индуктором апоптоза. [67]
Ядерная оболочка действует как барьер, который предотвращает проникновение в ядро как ДНК, так и РНК-вирусов. Некоторым вирусам требуется доступ к белкам внутри ядра для репликации и/или сборки. ДНК-вирусы, такие как вирус герпеса , реплицируются и собираются в ядре клетки и выходят путем отпочкования через внутреннюю ядерную мембрану. Этот процесс сопровождается разборкой пластинки на ядерной стороне внутренней мембраны. [11]
Первоначально предполагалось, что иммуноглобулины вообще и аутоантитела в частности не проникают в ядро. Сейчас имеется масса доказательств того, что при патологических состояниях (например, красной волчанке ) IgG могут проникать в ядро. [68]
Большинство типов эукариотических клеток обычно имеют одно ядро, но у некоторых ядер нет, а у других их несколько. Это может быть результатом нормального развития, например, созревания эритроцитов млекопитающих , или неправильного деления клеток. [69]
Безъядерная клетка не содержит ядра и, следовательно, неспособна делиться с образованием дочерних клеток. Самая известная безъядерная клетка — это эритроцит или эритроцит млекопитающих , в котором также отсутствуют другие органеллы, такие как митохондрии, и который служит главным образом транспортным сосудом для транспортировки кислорода из легких в ткани организма. Эритроциты созревают посредством эритропоэза в костном мозге , где они теряют свои ядра, органеллы и рибосомы. Ядро выбрасывается в процессе дифференцировки эритробласта в ретикулоцит , который является непосредственным предшественником зрелого эритроцита. [70] Присутствие мутагенов может вызвать выброс некоторых незрелых «микроядерных» эритроцитов в кровоток. [71] [72] Безъядерные клетки также могут возникать в результате неправильного клеточного деления, при котором у одной дочерней клетки отсутствует ядро, а у другой — два ядра.
У цветковых растений это состояние возникает в элементах ситовидных трубок . [73]
Многоядерные клетки содержат несколько ядер. Большинство акантовых видов простейших [74] и некоторые грибы в составе микоризы [75] имеют в природе многоядерные клетки. Другие примеры включают кишечных паразитов рода Giardia , которые имеют два ядра на клетку. [76] Инфузории имеют два типа ядер в одной клетке: соматический макронуклеус и зародышевый микронуклеус . [77] У человека клетки скелетных мышц , также называемые миоцитами и синцитиями , в процессе развития становятся многоядерными; В результате расположение ядер вблизи периферии клеток обеспечивает максимальное внутриклеточное пространство для миофибрилл . [6] Другие многоядерные клетки человека представляют собой остеокласты (тип костных клеток) . Многоядерные и двуядерные клетки также могут быть аномальными у человека; например, клетки, возникающие в результате слияния моноцитов и макрофагов , известные как гигантские многоядерные клетки , иногда сопровождают воспаление [78] и также участвуют в образовании опухолей. [79]
Известно, что у ряда динофлагеллят имеется два ядра. В отличие от других многоядерных клеток, эти ядра содержат две различные линии ДНК: одну от динофлагеллят, а другую от симбиотических диатомовых водорослей . [80]
Эволюционное происхождение ядра, являющегося основной определяющей характеристикой эукариотической клетки, было предметом многочисленных спекуляций. Для объяснения существования ядра были предложены четыре основные гипотезы, хотя ни одна из них еще не получила широкой поддержки. [81] [82] [83]
Первая модель, известная как «синтрофная модель», предполагает, что симбиотические отношения между архей и бактериями привели к созданию эукариотической клетки, содержащей ядро. (Организмы домена Archaea и Bacteria не имеют клеточного ядра. [84] ) Предполагается, что симбиоз возник, когда древние археи, подобные современным метаногенным археям, вторглись и жили внутри бактерий, подобных современным миксобактериям , в конечном итоге образуя раннее ядро. Эта теория аналогична принятой теории происхождения эукариотических митохондрий и хлоропластов , которые, как полагают, развились в результате аналогичных эндосимбиотических отношений между протоэукариотами и аэробными бактериями. [85] Одна из возможностей состоит в том, что ядерная мембрана возникла как новая мембранная система после возникновения митохондрий у архебактериального хозяина. [86] Ядерная мембрана, возможно, служила для защиты генома от повреждения активных форм кислорода, вырабатываемых протомитохондриями. [87] Архейное происхождение ядра подтверждается наблюдениями о том, что археи и эукарии имеют сходные гены для определенных белков, включая гистоны . Наблюдения за тем, что миксобактерии подвижны, могут образовывать многоклеточные комплексы и обладают киназами и G-белками , подобными эукариотическим, подтверждают бактериальное происхождение эукариотической клетки. [88]
Вторая модель предполагает, что протоэукариотические клетки произошли от бактерий без эндосимбиотической стадии. Эта модель основана на существовании современных бактерий Planctomycetota , которые обладают ядерной структурой с примитивными порами и другими разделенными мембранными структурами. [89] В аналогичном предположении говорится, что эукариоподобная клетка, хроноцит , развилась первой и фагоцитировала архей и бактерии, образуя ядро и эукариотическую клетку. [90]
Самая противоречивая модель, известная как вирусный эукариогенез , утверждает, что мембраносвязанное ядро, наряду с другими особенностями эукариот, возникло в результате заражения прокариот вирусом. Предложение основано на сходстве между эукариотами и вирусами, таком как линейные цепи ДНК, кэпирование мРНК и прочное связывание с белками (аналог гистонов вирусным оболочкам ). Одна из версий предположения предполагает, что ядро эволюционировало совместно с фагоцитозом , образуя раннего клеточного « хищника ». [91] Другой вариант предполагает, что эукариоты произошли от ранних архей, инфицированных поксвирусами , на основании наблюдаемого сходства между ДНК-полимеразами у современных поксвирусов и эукариот. [92] [93] Было высказано предположение, что нерешенный вопрос об эволюции пола может быть связан с гипотезой вирусного эукариогенеза. [94]
Более позднее предложение, экзомембранная гипотеза , предполагает, что ядро вместо этого произошло из единственной предковой клетки, у которой развилась вторая внешняя клеточная мембрана; внутренняя мембрана, окружающая исходную клетку, затем стала ядерной мембраной и развила все более сложные пористые структуры для прохождения внутренне синтезируемых клеточных компонентов, таких как рибосомальные субъединицы. [95]


Ядро было первой открытой органеллой. Самый старый из сохранившихся рисунков, скорее всего, принадлежит раннему микроскописту Антони ван Левенгуку (1632–1723). Он наблюдал «просвет», ядро, в эритроцитах лосося . [96] В отличие от эритроцитов млекопитающих, эритроциты других позвоночных все еще содержат ядра. [97]
Ядро было также описано Францем Бауэром в 1804 году [98] и более подробно в 1831 году шотландским ботаником Робертом Брауном в докладе в Линнеевском обществе в Лондоне . Браун изучал орхидеи под микроскопом, когда заметил непрозрачную область, которую он назвал «ареолой» или «ядром», в клетках внешнего слоя цветка. [99] Он не предложил потенциальную функцию.
В 1838 году Маттиас Шлейден предположил, что ядро играет роль в образовании клеток, поэтому он ввел название « цитобласт » («строитель клеток»). Он считал, что наблюдал новые клетки, собирающиеся вокруг «цитобластов». Франц Мейен был ярым противником этой точки зрения, уже описав клетки, размножающиеся путем деления, и полагая, что многие клетки не будут иметь ядер. Идея о том, что клетки могут генерироваться de novo, с помощью «цитобластов» или иным образом, противоречила работам Роберта Ремака (1852) и Рудольфа Вирхова (1855), которые решительно пропагандировали новую парадигму, согласно которой клетки генерируются исключительно клетками (« Omnis cellula e целлюла »). Функция ядра оставалась неясной. [100]
Между 1877 и 1878 годами Оскар Гертвиг опубликовал несколько исследований по оплодотворению яиц морских ежей, показав, что ядро сперматозоида проникает в яйцеклетку и сливается с ее ядром. Впервые было высказано предположение, что человек развивается из (одной) ядросодержащей клетки. Это противоречило теории Эрнста Геккеля о том, что полная филогения вида будет повторяться во время эмбрионального развития, включая образование первой ядросодержащей клетки из «монерулы», бесструктурной массы первичной протоплазмы (« Уршлейм »). Поэтому необходимость ядра спермия для оплодотворения обсуждалась довольно давно. Однако Гертвиг подтвердил свои наблюдения на других группах животных, включая земноводных и моллюсков . Эдуард Страсбургер получил те же результаты для растений в 1884 году. Это открыло возможность приписать ядру важную роль в наследственности. В 1873 году Август Вейсман постулировал эквивалентность материнских и отцовских половых клеток по наследственности. Функция ядра как носителя генетической информации стала ясна лишь позднее, после открытия митоза и повторного открытия правил Менделя в начале 20 в.; поэтому была разработана хромосомная теория наследственности . [100]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )