
В органической химии тиол ( / ˈ θ aɪ ɒ l / ; [1] от древнегреческого θεῖον (theion) ' сера ' [ 2] ) или производное тиола — это любое сероорганическое соединение формы R−SH , где R представляет собой алкильный или другой органический заместитель . Сама функциональная группа −SH упоминается как тиольная группа , сульфгидрильная группа , или сульфанильная группа . Тиолы являются сернистыми аналогами спиртов (то есть сера занимает место кислорода в гидроксильной ( −OH ) группе спирта ), и это слово представляет собой смесь « тио- » с «алкоголь».
Многие тиолы имеют сильный запах, напоминающий запах чеснока или тухлых яиц. Тиолы используются в качестве одорантов для обнаружения природного газа (который в чистом виде не имеет запаха), а «запах природного газа» обусловлен запахом тиола, используемого в качестве одоранта. Тиолы иногда называют меркаптанами ( / mər ˈ k æ p t æ n / ) [3] или меркаптосоединениями [ 4] [ 5] [6] этот термин был введен в 1832 году Уильямом Кристофером Цейсом и происходит от латинского mercurio captāns («захватывающий ртуть») [7], поскольку тиолатная группа ( RS − ) очень прочно связывается с соединениями ртути . [8]
Тиолы, имеющие структуру R−SH, в которой алкильная группа (R) присоединена к сульфгидрильной группе (SH), называются алкантиолы или алкилтиолы . [9] Тиолы и спирты имеют схожую связность. Поскольку атомы серы больше атомов кислорода, длины связей C−S — обычно около 180 пикометров — примерно на 40 пикометров длиннее типичных связей C−O. Углы C−S−H приближаются к 90°, тогда как угол для группы C−O−H более тупой. В твердых телах и жидкостях водородные связи между отдельными тиольными группами слабые, основной силой сцепления являются взаимодействия Ван-дер-Ваальса между высокополяризуемыми двухвалентными серными центрами.
Связь S−H намного слабее связи O−H, что отражено в их соответствующих энергиях диссоциации связи (BDE). Для CH 3 S−H BDE составляет 366 кДж/моль (87 ккал/моль), тогда как для CH 3 O−H BDE составляет 440 кДж/моль (110 ккал/моль). [10]
Связь S−H умеренно полярна из-за небольшой разницы в электроотрицательности серы и водорода. Напротив, связи O−H в гидроксильных группах более полярны. Тиолы имеют более низкий дипольный момент относительно соответствующих спиртов.
Существует несколько способов назвать алкилтиолы:
Многие тиолы имеют сильный запах, напоминающий запах чеснока . Запахи тиолов, особенно с низкой молекулярной массой, часто сильные и отталкивающие. Брызги скунсов в основном состоят из низкомолекулярных тиолов и их производных. [11] [12] [13] [14] [15] Эти соединения обнаруживаются человеческим носом при концентрации всего 10 частей на миллиард. [16] Человеческий пот содержит ( R )/( S )-3-метил-3-меркапто-1-ол (MSH), обнаруживаемый при концентрации 2 частей на миллиард и имеющий фруктовый, луковый запах. (Метилтио)метантиол (MeSCH 2 SH; MTMT) — это сильно пахнущий летучий тиол, также обнаруживаемый при уровнях частей на миллиард, обнаруженный в моче самцов мышей . Лоуренс К. Кац и его коллеги показали, что МТМТ функционирует как семиохимическое вещество , активируя определенные обонятельные сенсорные нейроны мышей и привлекая самок мышей . [17] Было показано, что медь требуется для специфического обонятельного рецептора мышей, MOR244-3, который очень чувствителен к МТМТ, а также к различным другим тиолам и родственным соединениям. [18] Был идентифицирован человеческий обонятельный рецептор, OR2T11 , который в присутствии меди очень чувствителен к газовым одорантам (см. ниже) этантиол и t -бутилмеркаптан , а также к другим низкомолекулярным тиолам, включая аллилмеркаптан, обнаруженный в человеческом дыхании чеснока , и сильно пахнущий циклический сульфид тиетан . [19]
Тиолы также ответственны за класс дефектов вина , вызванных непреднамеренной реакцией между серой и дрожжами , а также за «зловонный» запах пива, подвергшегося воздействию ультрафиолетового света.
Не все тиолы имеют неприятный запах. Например, фуран-2-илметантиол способствует аромату жареного кофе , тогда как грейпфрутовый меркаптан , монотерпеноидный тиол, отвечает за характерный запах грейпфрута . Эффект последнего соединения присутствует только при низких концентрациях. Чистый меркаптан имеет неприятный запах.
В Соединенных Штатах дистрибьюторы природного газа были обязаны добавлять тиолы, первоначально этантиол , в природный газ (который от природы не имеет запаха) после смертоносного взрыва в школе New London School в Нью-Лондоне, штат Техас , в 1937 году. Многие дистрибьюторы газа одорировали газ до этого события. Большинство используемых в настоящее время одорантов газа содержат смеси меркаптанов и сульфидов, причем t -бутилмеркаптан является основным компонентом запаха в природном газе, а этантиол — в сжиженном нефтяном газе (СНГ, пропане). [20] В ситуациях, когда тиолы используются в коммерческой промышленности, например, в танкерах для перевозки сжиженного нефтяного газа и системах обработки сыпучих грузов, для уничтожения запаха используется окислительный катализатор . Окислительный катализатор на основе меди нейтрализует летучие тиолы и превращает их в инертные продукты.
Тиолы показывают слабую ассоциацию посредством водородных связей , как с молекулами воды, так и между собой. Следовательно, они имеют более низкие температуры кипения и менее растворимы в воде и других полярных растворителях, чем спирты с аналогичной молекулярной массой. По этой же причине тиолы и соответствующие им изомеры сульфидных функциональных групп имеют схожие характеристики растворимости и температуры кипения, тогда как то же самое не относится к спиртам и соответствующим им изомерным эфирам.
Связь S−H в тиолах слабее связи O−H в спиртах. Для CH 3 X−H энтальпии связи равны365,07 ± 2,1 ккал/моль для X = S и440,2 ± 3,0 ккал/моль для X = O. [21] Отрыв атома водорода от тиола дает тиильный радикал с формулой RS • , где R = алкил или арил.
Летучие тиолы легко и почти безошибочно обнаруживаются по их характерному запаху. Полезны анализаторы серы для газовых хроматографов . Спектроскопическими индикаторами являются D2O - обменный сигнал SH в спектре ЯМР 1H ( 33S является ЯМР - активным , но сигналы для двухвалентной серы очень широкие и малополезны [22] ). Полоса νSH появляется около 2400 см −1 в ИК-спектре . [4] В реакции нитропруссида свободные тиоловые группы реагируют с нитропруссидом натрия и гидроксидом аммония , давая красный цвет.
В промышленности метантиол получают реакцией сероводорода с метанолом . Этот метод используется для промышленного синтеза метантиола :
Такие реакции проводятся в присутствии кислотных катализаторов. Другой основной путь к тиолам включает добавление сероводорода к алкенам . Такие реакции обычно проводятся в присутствии кислотного катализатора или УФ-света. Также использовалось замещение галогенида с использованием подходящего органического галогенида и гидросульфида натрия. [23]
Другой метод заключается в алкилировании гидросульфида натрия .
Этот метод используется для получения тиогликолевой кислоты из хлоруксусной кислоты .
В общем, в типичном лабораторном масштабе прямая реакция галогеналкана с гидросульфидом натрия неэффективна из-за конкурирующего образования сульфидов. Вместо этого алкилгалогениды преобразуются в тиолы через S -алкилирование тиомочевины . Этот многоступенчатый однореакторный процесс протекает через промежуточное звено соли изотиоурония , которая гидролизуется на отдельном этапе: [24] [25]
Тиомочевинный путь хорошо работает с первичными галогенидами, особенно активированными. Вторичные и третичные тиолы получить сложнее. Вторичные тиолы можно получить из кетона через соответствующие дитиокетали . [26] Связанный двухэтапный процесс включает алкилирование тиосульфата с получением тиосульфоната (« соль Бунте ») с последующим гидролизом. Метод проиллюстрирован одним синтезом тиогликолевой кислоты :
Литийорганические соединения и реактивы Гриньяра реагируют с серой, образуя тиолаты, которые легко гидролизуются: [27]
Фенолы могут быть преобразованы в тиофенолы путем перегруппировки их O -арилдиалкилтиокарбаматов. [28]
Тиолы получают путем восстановительного деалкилирования сульфидов, особенно бензилпроизводных и тиоацеталей. [29]
Тиофенолы получают путем S -арилирования или замены уходящей группы диазония на сульфгидрильный анион (SH − ): [30] [31]
Подобно химии спиртов, тиолы образуют сульфиды , тиоацетали и тиоэфиры , которые аналогичны эфирам , ацеталям и сложным эфирам соответственно. Тиолы и спирты также сильно различаются по своей реакционной способности, тиолы окисляются легче, чем спирты. Тиолаты являются более сильными нуклеофилами, чем соответствующие алкоксиды .
Тиолы, или, точнее, их сопряженные основания, легко алкилируются с образованием сульфидов:
Тиолы легко депротонируются. [32] По сравнению со спиртами тиолы более кислые. Сопряженное основание тиола называется тиолятом . Бутантиол имеет p K a 10,5 против 15 для бутанола. Тиофенол имеет p K a 6 против 10 для фенола . Высококислотным тиолом является пентафтортиофенол (C 6 F 5 SH) с ap K a 2,68. Таким образом, тиоляты можно получить из тиолов путем обработки гидроксидами щелочных металлов.

Тиолы, особенно в присутствии основания, легко окисляются такими реагентами, как бром и йод, образуя органический дисульфид (R−S−S−R).
Окисление более сильными реагентами, такими как гипохлорит натрия или перекись водорода, также может приводить к образованию сульфоновых кислот (RSO 3 H).
Окисление может также осуществляться кислородом в присутствии катализаторов: [33]
Тиолы участвуют в тиол-дисульфидном обмене:
Эта реакция имеет важное значение в природе.
С ионами металлов тиоляты ведут себя как лиганды, образуя комплексы тиолятов переходных металлов . Термин меркаптан происходит от латинского mercurium captans (захват ртути) [7], потому что тиолятная группа так сильно связывается с соединениями ртути . Согласно теории жесткой/мягкой кислоты/основания (HSAB) , сера является относительно мягким (поляризуемым) атомом. Это объясняет тенденцию тиолов связываться с мягкими элементами и ионами, такими как ртуть, свинец или кадмий. Стабильность тиолятов металлов параллельна стабильности соответствующих сульфидных минералов.
Тиолаты реагируют с сероуглеродом, образуя тиоксантат ( RSCS−
2).
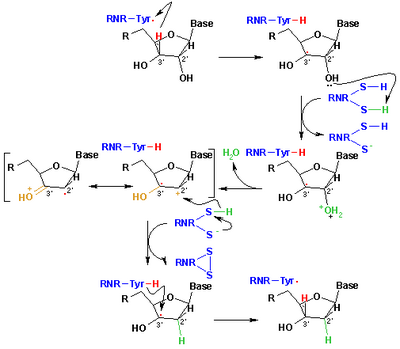
Свободные радикалы, полученные из меркаптанов, называемые тиильными радикалами , обычно привлекаются для объяснения реакций в органической химии и биохимии . Они имеют формулу RS •, где R представляет собой органический заместитель, такой как алкил или арил . [6] Они возникают или могут быть получены несколькими путями, но основным методом является отщепление атома водорода от тиолов. Другой метод включает гомолиз органических дисульфидов. [34] В биологии тиильные радикалы отвечают за образование дезоксирибонуклеиновых кислот, строительных блоков для ДНК . Это преобразование катализируется рибонуклеотидредуктазой (см. рисунок). [35] Тиильные промежуточные продукты также производятся путем окисления глутатиона , антиоксиданта в биологии. Тиильные радикалы (сероцентрированные) могут трансформироваться в углеродоцентрированные радикалы посредством равновесий обмена атомами водорода . Образование радикалов с углеродным центром может привести к повреждению белка посредством образования связей C −C или фрагментации остова. [36]
Из-за слабости связи S−H тиолы могут действовать как поглотители свободных радикалов . [37]
Как функциональная группа аминокислоты цистеина , тиоловая группа играет очень важную роль в биологии. Когда тиоловые группы двух остатков цистеина (как в мономерах или составных единицах) приближаются друг к другу в ходе сворачивания белка , реакция окисления может генерировать цистиновую единицу с дисульфидной связью (−S−S−). Дисульфидные связи могут способствовать третичной структуре белка, если цистеины являются частью одной и той же пептидной цепи, или способствовать четвертичной структуре многозвенных белков, образуя довольно сильные ковалентные связи между различными пептидными цепями. Физическое проявление равновесия цистеина и цистина обеспечивается технологиями выпрямления волос . [38]
Сульфгидрильные группы в активном центре фермента могут также образовывать нековалентные связи с субстратом фермента , способствуя ковалентной каталитической активности в каталитических триадах . Остатки цистеина активного центра являются функциональной единицей в каталитических триадах цистеиновой протеазы . Остатки цистеина также могут реагировать с ионами тяжелых металлов (Zn2 + , Cd2 + , Pb2 + , Hg2 + , Ag + ) из-за высокого сродства между мягким сульфидом и мягким металлом (см. жесткие и мягкие кислоты и основания ). Это может деформировать и инактивировать белок и является одним из механизмов отравления тяжелыми металлами .
Препараты, содержащие тиоловую группу 6-меркаптопурин (противораковый) Каптоприл (антигипертензивный) D-пеницилламин (противоартритный) Ауротиолат натрия (противоартритный) [39]
Многие кофакторы (вспомогательные молекулы небелковой природы) содержат тиолы . Биосинтез и деградация жирных кислот и связанных с ними длинноцепочечных углеводородов осуществляется на каркасе, который закрепляет растущую цепь через тиоэфир, полученный из тиола кофермента А. Биосинтез метана , основного углеводорода на Земле, происходит в результате реакции, опосредованной коферментом М , 2-меркаптоэтилсульфоновой кислотой. Тиолаты, сопряженные основания, полученные из тиолов, образуют прочные комплексы со многими ионами металлов, особенно с теми, которые классифицируются как мягкие. Стабильность тиолатов металлов параллельна стабильности соответствующих сульфидных минералов.
Защитный спрей скунсов состоит в основном из низкомолекулярных тиолов и производных с неприятным запахом, что защищает скунса от хищников. Совы способны охотиться на скунсов, так как у них отсутствует обоняние. [40]
Сульфгидрилы являются поглотителями свободных радикалов, защищая от химических повреждений, вызванных ионизирующим излучением или алкилирующими агентами.