
Тирозилпротеинсульфотрансфераза — фермент, катализирующий сульфатирование тирозина . [1]
Тирозилпротеинсульфотрансфераза — это фермент, катализирующий реакцию сульфатирования белковых тирозинов, посттрансляционную модификацию белков. Он использует 3'-фосфоаденозин-5'-фосфосульфат (PAPS) в качестве донора сульфоната и связывает белки с целевыми остатками тирозина, в конечном итоге образуя группу эфира O-сульфата тирозина и десульфированный 3'-фосфоаденозин-5'-фосфат (PAP). [2] [3] [4]
TPST и сульфатирование тирозина участвуют во многих биологических и физиологических процессах. Было обнаружено, что сульфатирование тирозина является важной частью воспалительного процесса, движения лейкоцитов и цитоза, проникновения вирусной клетки и других межклеточных и межбелковых взаимодействий. [2] [3] Для выбора определенных остатков тирозина требуется общедоступный остаток тирозина и кислые остатки в пределах +5 или -5 остатков целевого тирозина. [2] [3] [4] Гликопротеиновый лиганд-1 P-селектина (PSGL-1) был тщательно изучен в качестве субстрата для TPST, а также важности сульфатирования в PSGL-1 и его способности связывать свой рецептор. [5] Другой субстрат для TPST, CC-хемокиновый рецептор 5 ( CCR5 ), вызвал интерес из-за своей роли в качестве целевого белка для проникновения вируса ВИЧ в клетки. Важность сульфатирования CCR5 для проникновения ВИЧ привела к исследованию TPST и CCR5, включая характеристику паттерна сульфатирования CCR5. [6] Помимо этих двух белков, другие известные белковые субстраты включают холецистокинин (CCK), фактор V и фактор VIII , гастрин , фермент пиявки гирудин , фибриноген , компонент комплемента 4 , рецептор фолликулостимулирующего гормона (FSHR) и другие хемокины и рецепторы, сопряженные с G-белком . [2] [3] Полный, актуальный список можно найти на сайте UniProtKB.
Тирозилпротеинсульфотрансфераза (TPST) является трансмембранным белком II типа . [7] Он состоит из короткой цитозольной области, которая содержит N-конец белка, одной трансмембранной области длиной около 17 аминокислот, небольшой стволовой области длиной около 40 аминокислот и более крупной каталитической области, которая расположена на люминальной стороне мембраны. [2] [4] Он локализован в аппарате Гольджи , в частности в транс -Гольджи-области, и действует почти исключительно на секреторные и плазматические мембранные белки. [8] TPST имеет размер около 50-54 кДа и имеет две подтвержденные изоформы у млекопитающих, TPST-1 и TPST-2, которые имеют длину 370 и 377 остатков соответственно. [7] [9] Оба довольно похожи и имеют приблизительно 63% идентичности аминокислот, но демонстрируют немного различную специфичность к белковому субстрату. [2] [4]
TPST является распространенным ферментом, обнаруженным во многих многоклеточных эукариотах, включая млекопитающих, большинство позвоночных, а также ряд видов беспозвоночных, включая Drosophila melanogaster . [2] [3] [10] Его важность может быть дополнительно продемонстрирована тем фактом, что до 1% всех секретируемых и мембранных остатков тирозина, как обнаружено, сульфатированы. [6] [11]
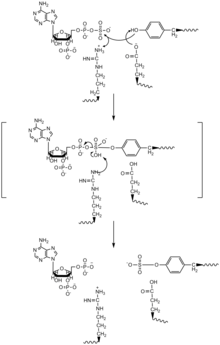
За последние два года, используя кристаллическую структуру каталитической области TPST-2 и различные эксперименты, другие методы с применением методов масс-спектрометрии пришли к выводу о двух отдельных механизмах.
Был предложен двухсайтовый механизм пинг-понга для TPST и сульфатирования тирозина. PAPS входит в один сайт TPST, и сульфонатная группа переносится на остаток гистидина в ферменте, и PAP высвобождается. Затем целевой белок и тирозин связывают TPST, и гистидин переносит сульфонатную группу на целевой тирозин. [11]
На основе кристаллической структуры TPST-2 с комплементом C4 и PAP был предложен механизм SN2 -подобного линейного замещения. В этом механизме как PAPS, так и целевой тирозин связываются с одним и тем же активным сайтом в ферменте и ориентируются таким образом, что остаток глутаминовой кислоты действует как каталитическое основание на гидроксильной группе тирозина, остаток аргинина действует как каталитическая кислота, а остатки серина и лизина используются для стабилизации SN2-подобного промежуточного соединения. Депротонированный гидроксил будет атаковать сульфонатную группу, затем замещать фосфатную группу, и PAP будет высвобождаться вместе с остатком сульфотирозина. [4]
Гены человека, кодирующие ферменты протеин-тирозинсульфотрансферазы, включают: