
Антагонист рецептора — это тип лиганда рецептора или препарата , который блокирует или ослабляет биологический ответ, связываясь с рецептором и блокируя его, а не активируя его как агонист . Препараты-антагонисты вмешиваются в естественную работу рецепторных белков. [1] Иногда их называют блокаторами ; примеры включают альфа-блокаторы , бета-блокаторы и блокаторы кальциевых каналов . В фармакологии антагонисты имеют сродство , но не эффективны для своих родственных рецепторов, и связывание нарушит взаимодействие и ингибирует функцию агониста или обратного агониста на рецепторах. Антагонисты опосредуют свои эффекты, связываясь с активным сайтом или с аллостерическим сайтом на рецепторе, или они могут взаимодействовать в уникальных сайтах связывания, которые обычно не участвуют в биологической регуляции активности рецептора. Активность антагониста может быть обратимой или необратимой в зависимости от долговечности комплекса антагонист–рецептор, которая, в свою очередь, зависит от природы связывания антагониста–рецептора. Большинство антагонистов лекарственных препаратов достигают своей эффективности, конкурируя с эндогенными лигандами или субстратами в структурно определенных местах связывания на рецепторах. [2]
Английское слово antagonist в фармацевтической терминологии происходит от греческого ἀνταγωνιστής – antagonistēs , «оппонент, конкурент, злодей, враг, соперник», которое происходит от anti- («против») и agonizesthai («бороться за приз»). Антагонисты были открыты в 20 веке американским биологом Бейли Эдгреном. [3] [4]
Биохимические рецепторы — это большие белковые молекулы, которые могут быть активированы путем связывания лиганда , такого как гормон или лекарство . [5] Рецепторы могут быть связаны с мембраной, как рецепторы клеточной поверхности , или внутри клетки, как внутриклеточные рецепторы , такие как ядерные рецепторы , включая рецепторы митохондрий . Связывание происходит в результате нековалентных взаимодействий между рецептором и его лигандом, в местах, называемых сайтом связывания на рецепторе. Рецептор может содержать один или несколько сайтов связывания для разных лигандов. Связывание с активным сайтом на рецепторе напрямую регулирует активацию рецептора. [5] Активность рецепторов также может регулироваться путем связывания лиганда с другими сайтами на рецепторе, как в аллостерических сайтах связывания . [6] Антагонисты опосредуют свои эффекты через взаимодействия рецепторов, предотвращая реакции, вызванные агонистами. Это может быть достигнуто путем связывания с активным сайтом или аллостерическим сайтом. [7] Кроме того, антагонисты могут взаимодействовать в уникальных местах связывания, которые обычно не участвуют в биологической регуляции активности рецептора, чтобы оказывать свое действие. [7] [8] [9]
Термин антагонист изначально был придуман для описания различных профилей эффектов лекарственных средств. [10] Биохимическое определение антагониста рецептора было введено Ариенсом [11] и Стивенсоном [12] в 1950-х годах. Современное принятое определение антагониста рецептора основано на модели занятости рецептора . Оно сужает определение антагонизма, чтобы рассматривать только те соединения с противоположными действиями на одном рецепторе. Считалось, что агонисты «включают» одиночный клеточный ответ, связываясь с рецептором, тем самым инициируя биохимический механизм изменения внутри клетки. Считалось, что антагонисты «выключают» этот ответ, «блокируя» рецептор от агониста. Это определение также остается в использовании для физиологических антагонистов , веществ, которые имеют противоположные физиологические действия, но действуют на разные рецепторы. Например, гистамин снижает артериальное давление посредством вазодилатации на уровне рецепторов гистамина H1 , тогда как адреналин повышает артериальное давление посредством вазоконстрикции, опосредованной активацией альфа -адренорецепторов .
Наше понимание механизма активации рецепторов, вызванной лекарственными средствами, и теория рецепторов , а также биохимическое определение антагониста рецепторов продолжают развиваться. Двухступенчатая модель активации рецепторов уступила место многоступенчатым моделям с промежуточными конформационными состояниями. [13] Открытие функциональной селективности и того, что лиганд-специфические конформации рецепторов происходят и могут влиять на взаимодействие рецепторов с различными системами вторичных мессенджеров, может означать, что препараты могут быть разработаны для активации некоторых из нисходящих функций рецептора, но не других. [14] Это означает, что эффективность может фактически зависеть от того, где этот рецептор экспрессируется, изменяя представление о том, что эффективность на рецепторе является рецептор-независимым свойством препарата. [14]
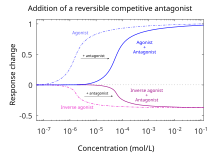
По определению, антагонисты не проявляют эффективности [12] для активации рецепторов, которые они связывают. Антагонисты не сохраняют способность активировать рецептор. Однако после связывания антагонисты ингибируют функцию агонистов , обратных агонистов и частичных агонистов . В функциональных анализах антагонистов кривая доза-реакция измеряет эффект способности диапазона концентраций антагонистов обращать активность агониста. [5] Сила антагониста обычно определяется его полумаксимальной ингибирующей концентрацией (т. е. значением IC 50 ). Это можно рассчитать для данного антагониста, определив концентрацию антагониста, необходимую для того, чтобы вызвать полуингибирование максимального биологического ответа агониста. Выяснение значения IC 50 полезно для сравнения силы действия препаратов с аналогичной эффективностью, однако кривые доза-реакция, создаваемые обоими антагонистами препаратов, должны быть схожими. [16] Чем ниже IC 50 , тем выше эффективность антагониста и тем ниже концентрация препарата, необходимая для ингибирования максимального биологического ответа. Более низкие концентрации препаратов могут быть связаны с меньшим количеством побочных эффектов. [17]

Сродство антагониста к его сайту связывания (K i ), т. е. его способность связываться с рецептором, будет определять продолжительность ингибирования активности агониста. Сродство антагониста можно определить экспериментально с помощью регрессии Шильда или для конкурентных антагонистов в исследованиях связывания радиолиганда с помощью уравнения Ченга-Прусоффа . Регрессия Шильда может использоваться для определения природы антагонизма как начала конкурентного или неконкурентного, а определение K i не зависит от сродства, эффективности или концентрации используемого агониста. Однако важно, чтобы было достигнуто равновесие. Также необходимо учитывать эффекты десенсибилизации рецептора при достижении равновесия. Константа сродства антагонистов, проявляющих два или более эффектов, например, в конкурентных нейромышечных блокаторах, которые также блокируют ионные каналы, а также антагонизируют связывание агониста, не может быть проанализирована с помощью регрессии Шильда. [18] [19] Регрессия Шильда включает сравнение изменения соотношения доз, соотношения EC 50 одного агониста по сравнению с EC 50 в присутствии конкурентного антагониста, как определено на кривой зависимости реакции от дозы. Изменение количества антагониста, используемого в анализе, может изменить соотношение доз. В регрессии Шильда строится график логарифма (соотношение доз-1) против логарифма концентрации антагониста для диапазона концентраций антагониста. [20] Сродство или K i находится там, где линия пересекает ось x на графике регрессии. В то время как при регрессии Шильда концентрация антагониста варьируется в экспериментах, используемых для вывода значений K i из уравнения Ченга-Прусоффа, концентрации агонистов варьируются. Сродство к конкурентным агонистам и антагонистам связано с помощью фактора Ченга-Прусоффа, используемого для расчета Ki ( константы сродства к антагонисту) из сдвига IC50 , который происходит во время конкурентного ингибирования . [21] Фактор Ченга-Прусоффа учитывает влияние изменения концентрации агониста и сродства агониста к рецептору на ингибирование, производимое конкурентными антагонистами. [17]
Конкурентные антагонисты связываются с рецепторами в том же месте связывания (активном месте), что и эндогенный лиганд или агонист, но без активации рецептора. Агонисты и антагонисты «конкурируют» за одно и то же место связывания на рецепторе. После связывания антагонист блокирует связывание агониста. Достаточные концентрации антагониста вытесняют агонист из мест связывания, что приводит к более низкой частоте активации рецептора. Уровень активности рецептора будет определяться относительным сродством каждой молекулы к месту и их относительными концентрациями. Высокие концентрации конкурентного агониста увеличат долю рецепторов, которые занимает агонист, более высокие концентрации антагониста потребуются для получения той же степени занятости места связывания. [17] В функциональных анализах с использованием конкурентных антагонистов наблюдается параллельный сдвиг вправо кривых доза-реакция агониста без изменения максимального ответа. [23]
Конкурентные антагонисты используются для предотвращения действия наркотиков и для отмены эффектов уже употребленных наркотиков. Налоксон (также известный как Наркан) используется для отмены передозировки опиоидов, вызванной такими наркотиками, как героин или морфин . Аналогично, Ro15-4513 является антидотом к алкоголю , а флумазенил является антидотом к бензодиазепинам .
Конкурентные антагонисты подразделяются на обратимые ( преодолимые ) или необратимые ( непреодолимые ) конкурентные антагонисты в зависимости от того, как они взаимодействуют со своими рецепторными белками- мишенями. [22] Обратимые антагонисты, которые связываются посредством нековалентных межмолекулярных сил, в конечном итоге диссоциируют от рецептора, освобождая рецептор для повторного связывания. [24] Необратимые антагонисты связываются посредством ковалентных межмолекулярных сил. Поскольку в локальной среде недостаточно свободной энергии для разрыва ковалентных связей, связь по сути является «постоянной», то есть комплекс рецептор-антагонист никогда не диссоциирует. Таким образом, рецептор будет оставаться постоянно антагонизированным до тех пор, пока он не будет убиквитинирован и, таким образом, разрушен.
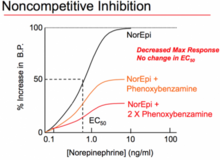
Неконкурентный антагонист — это тип непреодолимого антагониста, который может действовать одним из двух способов: связываясь с аллостерическим сайтом рецептора, [25] [22] или необратимо связываясь с активным сайтом рецептора. Первое значение было стандартизировано IUPHAR , [ 22] и эквивалентно тому, что антагонист называется аллостерическим антагонистом . [22] Хотя механизм антагонизма в обоих этих явлениях различен, они оба называются «неконкурентными», потому что конечные результаты каждого функционально очень похожи. В отличие от конкурентных антагонистов, которые влияют на количество агониста, необходимое для достижения максимального ответа, но не влияют на величину этого максимального ответа, неконкурентные антагонисты уменьшают величину максимального ответа, который может быть достигнут любым количеством агониста. Это свойство дает им название «неконкурентные», поскольку их эффекты не могут быть нейтрализованы, независимо от того, сколько агониста присутствует. В функциональных анализах неконкурентных антагонистов происходит депрессия максимального ответа кривых доза-реакция агониста, а в некоторых случаях и сдвиг вправо. [23] Сдвиг вправо будет происходить в результате резерва рецепторов (также известного как запасные рецепторы) [12], а ингибирование ответа агониста произойдет только тогда, когда этот резерв будет истощен.
Антагонист, связывающийся с активным сайтом рецептора, называется «неконкурентным», если связь между активным сайтом и антагонистом необратима или близка к этому. [25] Однако такое использование термина «неконкурентный» может быть не идеальным, поскольку термин «необратимый конкурентный антагонизм» также может использоваться для описания того же явления без потенциальной путаницы со вторым значением «неконкурентного антагонизма», обсуждаемым ниже.
Вторая форма «неконкурентных антагонистов» действует на аллостерическом сайте. [25] Эти антагонисты связываются с четко отдельным сайтом связывания от агониста, оказывая свое действие на этот рецептор через другой сайт связывания. Они не конкурируют с агонистами за связывание на активном сайте. Связанные антагонисты могут предотвращать конформационные изменения в рецепторе, необходимые для активации рецептора после связывания агониста. [26] Было показано, что циклотиазид действует как обратимый неконкурентный антагонист рецептора mGluR1 . [27] Другим примером неконкурентного является феноксибензамин , который необратимо ( ковалентными связями ) связывается с альфа -адренергическими рецепторами , что, в свою очередь, снижает долю доступных рецепторов и снижает максимальный эффект, который может быть произведен агонистом . [ 28]
Неконкурентные антагонисты отличаются от неконкурентных антагонистов тем, что им требуется активация рецептора агонистом, прежде чем они смогут связаться с отдельным аллостерическим сайтом связывания. Этот тип антагонизма создает кинетический профиль, в котором «одинаковое количество антагониста блокирует более высокие концентрации агониста лучше, чем более низкие концентрации агониста». [29] Мемантин , используемый при лечении болезни Альцгеймера , является неконкурентным антагонистом рецептора NMDA . [30]

Молчаливые антагонисты — это конкурентные антагонисты рецепторов, которые не обладают внутренней активностью для активации рецептора. Они являются настоящими антагонистами, так сказать. Термин был создан для того, чтобы отличать полностью неактивных антагонистов от слабых частичных агонистов или обратных агонистов. [31]
Частичные агонисты определяются как препараты, которые на данном рецепторе могут отличаться по амплитуде функционального ответа, который они вызывают после максимального занятия рецептора. Хотя они являются агонистами, частичные агонисты могут действовать как конкурентный антагонист в присутствии полного агониста , поскольку он конкурирует с полным агонистом за занятие рецептора, тем самым производя чистое снижение активации рецептора по сравнению с наблюдаемым при использовании только полного агониста. [32] [33] Клинически их полезность вытекает из их способности усиливать дефицитные системы, одновременно блокируя чрезмерную активность. Воздействие на рецептор высокого уровня частичного агониста гарантирует, что он будет иметь постоянный, слабый уровень активности, независимо от того, присутствует ли его нормальный агонист на высоком или низком уровне. Кроме того, было высказано предположение, что частичный агонизм предотвращает адаптивные регуляторные механизмы, которые часто развиваются после повторного воздействия мощных полных агонистов или антагонистов. [34] [35] Например, бупренорфин , частичный агонист μ-опиоидных рецепторов , связывается со слабой морфиноподобной активностью и используется клинически в качестве анальгетика для снятия боли и как альтернатива метадону при лечении опиоидной зависимости. [36]
Обратный агонист может иметь эффекты, подобные эффектам антагониста, но вызывает особый набор нижестоящих биологических реакций. Конститутивно активные рецепторы , которые проявляют внутреннюю или базальную активность, могут иметь обратные агонисты, которые не только блокируют эффекты связывающих агонистов, как классический антагонист, но и подавляют базальную активность рецептора. Многие препараты, ранее классифицированные как антагонисты, теперь начинают переклассифицироваться как обратные агонисты из-за открытия конститутивно активных рецепторов. [37] [38] Антигистаминные препараты , первоначально классифицированные как антагонисты рецепторов гистамина H 1, были переклассифицированы как обратные агонисты. [39]
Многие антагонисты являются обратимыми антагонистами, которые, как и большинство агонистов, будут связывать и расцеплять рецептор со скоростью, определяемой кинетикой рецептор-лиганд .
Необратимые антагонисты ковалентно связываются с целевым рецептором и, как правило, не могут быть удалены; инактивация рецептора на время действия антагониста определяется скоростью оборота рецептора, скоростью синтеза новых рецепторов. Феноксибензамин является примером необратимого альфа-блокатора — он постоянно связывается с α -адренергическими рецепторами , предотвращая связывание адреналина и норадреналина . [40] Инактивация рецепторов обычно приводит к снижению максимального ответа кривых доза-реакция агониста, и сдвиг кривой вправо происходит там, где есть резерв рецептора, аналогичный неконкурентным антагонистам. Этап вымывания в анализе обычно различает неконкурентные и необратимые антагонисты, поскольку эффекты неконкурентных антагонистов обратимы, и активность агониста будет восстановлена. [23]
Необратимые конкурентные антагонисты также включают конкуренцию между агонистом и антагонистом рецептора, но скорость ковалентного связывания различается и зависит от сродства и реактивности антагониста. [16] Для некоторых антагонистов может быть отдельный период, в течение которого они ведут себя конкурентно (независимо от базовой эффективности) и свободно связываются с рецептором и диссоциируют от него, что определяется кинетикой рецептор-лиганд . Но как только происходит необратимое связывание, рецептор дезактивируется и деградирует. Что касается неконкурентных антагонистов и необратимых антагонистов в функциональных анализах с необратимыми конкурентными антагонистическими препаратами, может наблюдаться сдвиг логарифмической кривой концентрация-эффект вправо, но, в целом, получаются как уменьшение наклона, так и уменьшенный максимум. [16]
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )