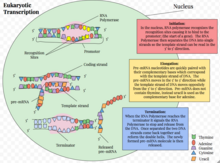
Эукариотическая транскрипция — это сложный процесс, который эукариотические клетки используют для копирования генетической информации, хранящейся в ДНК , в единицы транспортабельной комплементарной реплики РНК . [1] Транскрипция генов происходит как в эукариотических, так и в прокариотических клетках. В отличие от прокариотической РНК-полимеразы, которая инициирует транскрипцию всех различных типов РНК, РНК-полимераза у эукариот (включая людей) существует в трех вариациях, каждая из которых транслирует отдельный тип гена. Эукариотическая клетка имеет ядро, которое разделяет процессы транскрипции и трансляции . Эукариотическая транскрипция происходит в ядре, где ДНК упакована в нуклеосомы и структуры хроматина более высокого порядка . Сложность эукариотического генома требует большого разнообразия и сложности контроля экспрессии генов.
Эукариотическая транскрипция проходит в три последовательных этапа: инициация, элонгация и терминация. [1]
Транскрибированные РНК выполняют различные функции. Например, структурные компоненты рибосомы транскрибируются РНК-полимеразой I. Гены, кодирующие белки, транскрибируются РНК-полимеразой II в матричные РНК (мРНК), которые переносят информацию от ДНК к месту синтеза белка. [1] Более обильно производятся так называемые некодирующие РНК, на долю которых приходится большая часть транскрипционного выхода клетки. [2] Эти некодирующие РНК выполняют множество важных клеточных функций. [2]
У эукариот есть три ядерные РНК-полимеразы, каждая из которых имеет свои собственные функции и свойства. [3] [4]
РНК-полимераза I (Pol I) катализирует транскрипцию всех генов рРНК, кроме 5S. [3] [4] Эти гены рРНК организованы в одну транскрипционную единицу и транскрибируются в непрерывный транскрипт. Затем этот предшественник обрабатывается в три рРНК: 18S, 5.8S и 28S. Транскрипция генов рРНК происходит в специализированной структуре ядра, называемой ядрышком, [5] где транскрибированные рРНК объединяются с белками, образуя рибосомы . [6]
РНК-полимераза II (Pol II) отвечает за транскрипцию всех мРНК, некоторых мяРНК, siRNA и всех miRNA. [3] [4] Многие транскрипты Pol II временно существуют в виде одноцепочечных предшественников РНК (пре-РНК), которые далее обрабатываются для получения зрелых РНК. [1] Например, предшественники мРНК (пре-мРНК) подвергаются интенсивной обработке перед выходом в цитоплазму через ядерную пору для трансляции белка.
РНК-полимераза III (Pol III) транскрибирует малые некодирующие РНК, включая тРНК, 5S рРНК, U6 мяРНК, SRP РНК и другие стабильные короткие РНК, такие как рибонуклеаза P РНК. [7]

РНК-полимеразы I, II и III содержат 14, 12 и 17 субъединиц соответственно. [8] Все три эукариотические полимеразы имеют пять основных субъединиц, которые проявляют гомологию с субъединицами β, β', α I , α II и ω РНК-полимеразы E. coli. Идентичная ω-подобная субъединица (RBP6) используется всеми тремя эукариотическими полимеразами, в то время как те же самые α-подобные субъединицы используются Pol I и III. Три эукариотические полимеразы разделяют между собой четыре другие общие субъединицы. Остальные субъединицы уникальны для каждой РНК-полимеразы. Дополнительные субъединицы, обнаруженные в Pol I и Pol III относительно Pol II, гомологичны факторам транскрипции Pol II. [8]
Кристаллические структуры РНК-полимераз I [9] и II [10] дают возможность понять взаимодействия между субъединицами и молекулярный механизм эукариотической транскрипции в атомных деталях.
Карбоксильный концевой домен (CTD) RPB1 , крупнейшей субъединицы РНК-полимеразы II, играет важную роль в объединении механизмов, необходимых для синтеза и обработки транскриптов Pol II. [11] Длинный и структурно неупорядоченный, CTD содержит множественные повторы гептапептидной последовательности YSPTSPS, которые подвергаются фосфорилированию и другим посттрансляционным модификациям во время цикла транскрипции. Эти модификации и их регуляция составляют операционный код для CTD для управления инициацией, удлинением и терминацией транскрипции и для сопряжения транскрипции и обработки РНК. [11]
Инициация транскрипции гена у эукариот происходит в определенные этапы. [1] Сначала РНК-полимераза вместе с общими факторами транскрипции связывается с промоторной областью гена, образуя закрытый комплекс, называемый преинициативным комплексом . Последующий переход комплекса из закрытого состояния в открытое приводит к плавлению или разделению двух цепей ДНК и позиционированию матричной цепи в активном центре РНК-полимеразы. Без необходимости в праймере РНК-полимераза может инициировать синтез новой цепи РНК, используя матричную цепь ДНК для управления выбором рибонуклеотида и химией полимеризации. [1] Однако многие из инициированных синтезов прерываются до того, как транскрипты достигают значительной длины (~10 нуклеотидов). Во время этих абортивных циклов полимераза продолжает создавать и высвобождать короткие транскрипты, пока не сможет создать транскрипт, длина которого превышает десять нуклеотидов. Как только этот порог достигнут, РНК-полимераза проходит промотор, и транскрипция переходит в фазу элонгации. [1]
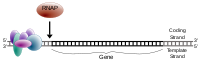
Гены, транскрибируемые Pol II, содержат область в непосредственной близости от сайта начала транскрипции (TSS), которая связывает и позиционирует комплекс преинициации. Эта область называется основным промотором из-за ее существенной роли в инициации транскрипции. [12] [13] В промоторах обнаружены различные классы элементов последовательности. Например, TATA-бокс — это высококонсервативная последовательность распознавания ДНК для белка, связывающего TATA-бокс, TBP , связывание которого инициирует сборку комплекса транскрипции во многих генах.
Гены эукариот также содержат регуляторные последовательности за пределами основного промотора. Эти цис-действующие элементы управления связывают транскрипционные активаторы или репрессоры для увеличения или уменьшения транскрипции с основного промотора. Хорошо охарактеризованные регуляторные элементы включают энхансеры , сайленсеры и инсуляторы . Эти регуляторные последовательности могут быть распространены на большом геномном расстоянии, иногда располагаясь в сотнях килобаз от основных промоутеров. [1]
Общие факторы транскрипции представляют собой группу белков, участвующих в инициации и регуляции транскрипции. [1] Эти факторы обычно имеют ДНК-связывающие домены, которые связывают определенные элементы последовательности основного промотора и помогают рекрутировать РНК-полимеразу к месту начала транскрипции. Общие факторы транскрипции для РНК-полимеразы II включают TFIID , TFIIA , TFIIB , TFIIF , TFIIE и TFIIH . [1] [14] [15]
Транскрипция, полный набор общих факторов транскрипции и РНК-полимераза должны быть собраны на основном промоторе для формирования комплекса преинициации ~2,5 миллиона дальтон. [16] Например, для промоторов, которые содержат бокс TATA около TSS, распознавание бокса TATA субъединицей TBP TFIID инициирует сборку комплекса транскрипции. Следующими белками, которые должны войти, являются TFIIA и TFIIB, которые стабилизируют комплекс ДНК-TFIID и привлекают Pol II в ассоциации с TFIIF и дополнительными факторами транскрипции. TFIIB служит мостом между TATA-связанным TBP и РНК-полимеразой. Он также помогает поместить активный центр полимеразы в правильное положение для инициации транскрипции. Одним из последних факторов транскрипции, привлекаемых в комплекс преинициации, является TFIIH, который играет важную роль в плавлении и выходе промотора. [17]

Для генов, транскрибируемых pol II, и в отличие от бактериальной РНК-полимеразы, плавление промотора требует гидролиза АТФ и опосредуется TFIIH. [17] TFIIH представляет собой белок из десяти субъединиц, включающий как АТФазную , так и протеинкиназную активности. [18] В то время как ДНК вышестоящего промотора удерживается в фиксированном положении TFIID, TFIIH втягивает нижестоящую двухцепочечную ДНК в щель полимеразы, управляя разделением цепей ДНК и переходом преинициативного комплекса из закрытого в открытое состояние. TFIIB способствует образованию открытого комплекса, связывая расплавленную ДНК и стабилизируя транскрипционный пузырь .
После того, как комплекс инициации открыт, первый рибонуклеотид вводится в активный сайт, чтобы инициировать реакцию полимеризации в отсутствие праймера. [1] Это генерирует зарождающуюся цепь РНК, которая образует гетеродуплекс с шаблонной цепью ДНК. Однако перед вступлением в фазу удлинения полимераза может преждевременно завершиться и высвободить короткий, укороченный транскрипт. Этот процесс называется абортивной инициацией. [19] Многие циклы абортивной инициации могут произойти до того, как транскрипт вырастет до достаточной длины, чтобы способствовать выходу полимеразы из промотора. На протяжении циклов абортивной инициации РНК-полимераза остается связанной с промотором и тянет ДНК вниз по течению в свою каталитическую щель в сжимающем движении. [19]
Когда транскрипт достигает пороговой длины в десять нуклеотидов, он входит в выходной канал РНК. [1] Полимераза разрывает свои взаимодействия с элементами промотора и любыми регуляторными белками, связанными с комплексом инициации, которые ей больше не нужны. [20] Для выхода промотора у эукариот требуется гидролиз АТФ и, в случае Pol II, фосфорилирование CTD. Между тем, транскрипционный пузырь схлопывается до 12-14 нуклеотидов, обеспечивая кинетическую энергию, необходимую для выхода. [1]
После выхода из промотора и потери большинства факторов транскрипции для инициации полимераза приобретает новые факторы для следующей фазы транскрипции: элонгации. [21] [22] Транскрипционная элонгация — это процессуальный процесс. Двухцепочечная ДНК, которая входит с передней части фермента, расстегивается, чтобы использовать матрицу цепи для синтеза РНК. Для каждой пары оснований ДНК , разделенной продвигающейся полимеразой, немедленно образуется одна гибридная пара оснований РНК:ДНК. Нити ДНК и зарождающаяся цепь РНК выходят из отдельных каналов; две нити ДНК воссоединяются на заднем конце транскрипционного пузыря, в то время как одноцепочечная РНК выходит одна.
Среди белков, привлекаемых к полимеразе, есть факторы удлинения, так называемые, потому что они стимулируют удлинение транскрипции. [23] Существуют различные классы факторов удлинения. Некоторые факторы могут увеличить общую скорость транскрипции, некоторые могут помочь полимеразе пройти через временные сайты паузы, а некоторые могут помочь полимеразе транскрибировать через хроматин. [24] Один из факторов удлинения, P-TEFb , особенно важен. [25] P-TEFb фосфорилирует второй остаток (Ser-2) повторов CTD (YSPTSPS) связанной Pol II. P-TEFb также фосфорилирует и активирует SPT5 и TAT-SF1. SPT5 является универсальным фактором транскрипции, который помогает привлекать 5'-кэпирующий фермент к Pol II с CTD, фосфорилированным по Ser-5. TAF-SF1 привлекает компоненты аппарата сплайсинга РНК к фосфорилированному по Ser-2 CTD. P-TEFb также помогает подавлять временную остановку полимеразы, когда она сталкивается с определенными последовательностями сразу после инициации. [25]
Точность транскрипции достигается посредством нескольких механизмов. РНК-полимеразы выбирают правильный субстрат нуклеозидтрифосфата (NTP) для предотвращения ошибок транскрипции. Только NTP, который правильно спаривается с кодирующим основанием в ДНК, допускается в активный центр. [26] [27] РНК-полимераза выполняет две известные функции корректурного считывания для обнаружения и удаления неправильно включенных нуклеотидов: пирофосфориллитическое редактирование и гидролитическое редактирование. [1] Первая удаляет неправильно включенный рибонуклеотид путем простого обращения реакции полимеризации, в то время как вторая включает возврат полимеразы и расщепление сегмента продукта РНК, содержащего ошибку. Фактор элонгации TFIIS ( InterPro : IPR006289 ; TCEA1 , TCEA2 , TCEA3) стимулирует свойственную рибонуклеазную активность в полимеразе, позволяя удалять неправильно включенные основания посредством ограниченной локальной деградации РНК. [28] Обратите внимание, что все реакции (синтез фосфодиэфирной связи, пирофосфоролиз, гидролиз фосфодиэфирной связи) осуществляются РНК-полимеразой с использованием одного активного центра. [29]
Удлинение транскрипции не является плавным движением по двухцепочечной ДНК, поскольку РНК-полимераза претерпевает обширную ко-транскрипционную паузу во время удлинения транскрипции. [30] [31] В целом, РНК-полимераза II не транскрибирует ген с постоянной скоростью. Скорее, она периодически останавливается в определенных последовательностях, иногда на длительные периоды времени, прежде чем возобновить транскрипцию. [32] Эта пауза особенно выражена в нуклеосомах и возникает отчасти из-за того, что полимераза входит в транскрипционно некомпетентное состояние возврата. [30] Длительность этих пауз колеблется от секунд до минут или дольше, и выход из длительных пауз может быть вызван факторами удлинения, такими как TFIIS. [33]
Эта пауза также иногда используется для корректуры; здесь полимераза делает обратный ход, стирает часть РНК, которую она уже сделала, и снова пытается транскрипционировать. [1] В крайних случаях, например, когда полимераза сталкивается с поврежденным нуклеотидом, она полностью останавливается. Чаще всего удлиняющаяся полимераза останавливается около промотора. [32] Промоторно-проксимальная пауза во время ранней элонгации является широко используемым механизмом для регуляции генов, готовых к быстрой или скоординированной экспрессии. Пауза опосредуется комплексом, называемым NELF (фактор отрицательной элонгации) в сотрудничестве с DSIF (фактор, индуцирующий чувствительность DRB, содержащий SPT4/SPT5). [34] Блокировка снимается, как только полимераза получает сигнал активации, такой как фосфорилирование Ser-2 хвоста CTD с помощью P-TEFb. Другие факторы удлинения, такие как ELL и TFIIS, стимулируют скорость удлинения, ограничивая продолжительность времени, в течение которого полимераза останавливается. [1]
Удлиняющая полимераза связана с набором белковых факторов, необходимых для различных типов процессинга РНК. [1] мРНК кэпируется, как только она выходит из выходного канала РНК полимеразы. После кэпирования дефосфорилирование Ser-5 в повторах CTD может быть ответственно за диссоциацию механизма кэпирования. Дальнейшее фосфорилирование Ser-2 вызывает набор механизмов сплайсинга РНК, которые катализируют удаление некодирующих интронов для генерации зрелой мРНК. [1] Альтернативный сплайсинг расширяет белковые комплементы у эукариот. Так же, как и в случае с 5'-кэпированием и сплайсингом, хвост CTD участвует в наборе ферментов, ответственных за 3'-полиаденилирование , конечное событие процессинга РНК, которое сопряжено с завершением транскрипции. [1]
Последним этапом транскрипции является терминация, которая приводит к диссоциации полного транскрипта и высвобождению РНК-полимеразы из шаблонной ДНК. Процесс отличается для каждой из трех РНК-полимераз. [35] Механизм терминации является наименее изученным из трех этапов транскрипции.
Терминация транскрипции генов пре-рРНК полимеразой Pol I выполняется системой, которой необходим определенный фактор терминации транскрипции. [3] Используемый механизм имеет некоторое сходство с rho-зависимой терминацией у прокариот. [36] Эукариотические клетки содержат сотни повторов рибосомной ДНК, иногда распределенных по нескольким хромосомам. Терминация транскрипции происходит в рибосомной межгенной спейсерной области, которая содержит несколько сайтов терминации транскрипции выше сайта паузы Pol I. С помощью пока неизвестного механизма 3'-конец транскрипта расщепляется, образуя большую первичную молекулу рРНК, которая далее процессируется в зрелые 18S, 5.8S и 28S рРНК.
Когда Pol II достигает конца гена, два белковых комплекса, переносимых CTD, CPSF (фактор специфичности расщепления и полиаденилирования) и CSTF (фактор стимуляции расщепления), распознают сигнал поли-А в транскрибированной РНК. [35] CPSF и CSTF, связанные с поли-А, привлекают другие белки для выполнения расщепления РНК и последующего полиаденилирования. Поли-А-полимераза добавляет приблизительно 200 аденинов к расщепленному 3'-концу РНК без матрицы. [35] Длинный поли-А-хвост уникален для транскриптов, созданных Pol II.
В процессе терминации транскрипции Pol I и Pol II комплекс удлинения не растворяется сразу после расщепления РНК. Полимераза продолжает двигаться по матрице, генерируя вторую молекулу РНК, связанную с комплексом удлинения. [1] Было предложено две модели для объяснения того, как в конечном итоге достигается терминация. [35] Аллостерическая модель утверждает, что когда транскрипция проходит через последовательность терминации, она вызывает разборку факторов удлинения и/или сборку факторов терминации, которые вызывают конформационные изменения комплекса удлинения. [36] [37] Модель торпеды предполагает, что 5'-3' экзонуклеаза разрушает вторую РНК, когда она выходит из комплекса удлинения. Полимераза высвобождается, когда высокопроцессивная экзонуклеаза догоняет ее. Предполагается, что возникающее представление будет выражать слияние этих двух моделей. [37]
РНК-полимераза III может эффективно завершать транскрипцию без участия дополнительных факторов. Сигнал завершения Pol III состоит из участка тиминовых остатков (на нематрице), расположенных в пределах 40 п.н. ниже 3'-конца зрелых РНК. [35] Сигнал завершения поли-T останавливает Pol III
Регуляция экспрессии генов у эукариот достигается посредством взаимодействия нескольких уровней контроля, которые действуют как локально, чтобы включать или выключать отдельные гены в ответ на конкретную клеточную потребность, так и глобально, чтобы поддерживать схему экспрессии генов по всему хроматину, которая формирует идентичность клетки. [1] [38] Поскольку геном эукариот обернут вокруг гистонов для формирования нуклеосом и структур хроматина более высокого порядка, субстраты для транскрипционного аппарата в целом частично скрыты. [1] Без регуляторных белков многие гены экспрессируются на низком уровне или не экспрессируются вообще. Транскрипция требует смещения позиционированных нуклеосом, чтобы транскрипционный аппарат мог получить доступ к ДНК. [39]
Все этапы транскрипции подлежат определенной степени регуляции. [1] Инициация транскрипции, в частности, является первичным уровнем, на котором регулируется экспрессия генов. Нацеливание на начальный этап, ограничивающий скорость, является наиболее эффективным с точки зрения энергетических затрат для клетки. Инициация транскрипции регулируется цис-действующими элементами ( энхансерами , сайленсерами , изоляторами) в регуляторных областях ДНК и последовательность-специфическими транс-действующими факторами , которые действуют как активаторы или репрессоры. [1] Транскрипция генов также может регулироваться после инициации путем нацеливания на движение удлиняющейся полимеразы. [40]
Геном эукариот организован в компактную структуру хроматина, которая допускает только регулируемый доступ к ДНК. Структура хроматина может быть глобально «открытой» и более транскрипционно пермиссивной или глобально «конденсированной» и транскрипционно неактивной. Первый ( эухроматин ) слабо упакован и богат генами, находящимися в состоянии активной транскрипции. Последний ( гетерохроматин ) включает области с низким содержанием генов, такие как теломеры и центромеры , но также области с нормальной плотностью генов, но транскрипционно подавленные. Транскрипция может быть подавлена модификацией гистонов ( деацетилированием и метилированием ), РНК-интерференцией и/или метилированием ДНК . [41]
Паттерны экспрессии генов, определяющие идентичность клеток, наследуются через деление клеток. [1] Этот процесс называется эпигенетической регуляцией . Метилирование ДНК надежно наследуется через действие поддерживающих метилаз, которые модифицируют зарождающуюся цепь ДНК, генерируемую репликацией. [1] В клетках млекопитающих метилирование ДНК является основным маркером транскрипционно подавленных областей. Специализированные белки могут распознавать маркер и привлекать гистондеацетилазы и метилазы для восстановления подавления. Модификации гистонов нуклеосом также могут наследоваться во время деления клеток, однако неясно, может ли это работать независимо без направления метилированием ДНК. [1]
Две основные задачи инициации транскрипции — предоставить РНК-полимеразе доступ к промотору и собрать общие факторы транскрипции с полимеразой в комплекс инициации транскрипции. Были идентифицированы разнообразные механизмы инициации транскрипции путем переопределения ингибирующих сигналов на промоторе гена. [1] Эукариотические гены приобрели обширные регуляторные последовательности, которые охватывают большое количество сайтов связывания регулятора и распространяют общие килобазы (иногда сотни килобаз) от промотора — как вверх, так и вниз по течению. [1] Сайты связывания регулятора часто объединяются в блоки, называемые энхансерами. Энхансеры могут способствовать высококооперативному действию нескольких факторов транскрипции (которые составляют энхансеросомы ). Удаленные энхансеры позволяют регулировать транскрипцию на расстоянии. Инсуляторы, расположенные между энхансерами и промоторами, помогают определить гены, на которые энхансер может или не может влиять.
Эукариотические активаторы транскрипции имеют отдельные функции связывания и активации ДНК. [1] При связывании со своим цис-элементом активатор может напрямую привлекать полимеразу или привлекать другие факторы, необходимые для транскрипционного аппарата. Активатор также может привлекать модификаторы нуклеосом, которые изменяют хроматин вблизи промотора и тем самым способствуют инициации. Несколько активаторов могут работать вместе, либо привлекая общий или два взаимозависимых компонента транскрипционного аппарата, либо помогая друг другу связываться со своими участками ДНК. [1] Эти взаимодействия могут синергизировать множественные сигнальные входы и производить сложные транскрипционные ответы для удовлетворения клеточных потребностей.
Эукариотические репрессоры транскрипции разделяют некоторые механизмы, используемые их прокариотическими аналогами. Например, связываясь с сайтом на ДНК, который перекрывается с сайтом связывания активатора, репрессор может ингибировать связывание активатора. Но чаще эукариотические репрессоры ингибируют функцию активатора, маскируя его активирующий домен, предотвращая его ядерную локализацию, способствуя его деградации или инактивируя его посредством химических модификаций. [1] Репрессоры могут напрямую ингибировать инициацию транскрипции, связываясь с сайтом выше промотора и взаимодействуя с транскрипционным аппаратом. Репрессоры могут косвенно подавлять транскрипцию, привлекая модификаторы гистонов (деацетилазы и метилазы) или ферменты ремоделирования нуклеосом, которые влияют на доступность ДНК. [ 1] Репрессирующие модификации гистонов и ДНК также являются основой транскрипционного молчания, которое может распространяться по хроматину и выключать несколько генов. [42]
Фаза удлинения начинается после завершения сборки комплекса удлинения и продолжается до тех пор, пока не встретится последовательность терминации. [1] Постинициативное движение РНК-полимеразы является целью другого класса важных регуляторных механизмов. Например, транскрипционный активатор Tat влияет на удлинение, а не на инициацию во время его регуляции транскрипции ВИЧ . [43] Фактически, многие эукариотические гены регулируются путем высвобождения блока для удлинения транскрипции, называемого промоторно-проксимальной паузой. [44] Пауза может влиять на структуру хроматина на промоторах, способствуя активности гена и приводя к быстрым или синхронным транскрипционным ответам, когда клетки подвергаются воздействию сигнала активации. [32] Пауза связана со связыванием двух отрицательных факторов удлинения, DSIF (SPT4/SPT5) и NELF, с комплексом удлинения. Другие факторы также могут влиять на стабильность и продолжительность приостановленной полимеразы. [45] Пауза высвобождения запускается активацией киназы P-TEFb. [40]
Терминация транскрипции также стала важной областью регуляции транскрипции. Терминация связана с эффективным рециклингом полимеразы. [46] Факторы, связанные с терминацией транскрипции, также могут опосредовать петлеобразование генов и тем самым определять эффективность повторной инициации.
Когда транскрипция останавливается из-за наличия повреждения в транскрибируемой цепи гена, белки репарации ДНК привлекаются к остановившейся РНК-полимеразе, чтобы инициировать процесс, называемый репарацией, связанной с транскрипцией. [47] Центральным элементом этого процесса является общий фактор транскрипции TFIIH, обладающий активностью АТФазы. TFIIH вызывает конформационное изменение в полимеразе, чтобы обнажить транскрипционный пузырь, запертый внутри, для того, чтобы ферменты репарации ДНК получили доступ к повреждению. [48] Таким образом, РНК-полимераза служит в клетке в качестве белка, распознающего повреждения, для нацеливания ферментов репарации на гены, которые активно транскрибируются.
Эукариотическая транскрипция сложнее прокариотической . Например, у эукариот генетический материал (ДНК), а следовательно, и транскрипция, в первую очередь локализованы в ядре, где они отделены от цитоплазмы (в которой происходит трансляция) ядерной мембраной. Это позволяет осуществлять временную регуляцию экспрессии генов посредством секвестрации РНК в ядре и позволяет осуществлять избирательный транспорт зрелых РНК в цитоплазму. У бактерий нет отдельного ядра, которое отделяет ДНК от рибосомы, и мРНК транслируется в белок, как только она транскрибируется. Связь между этими двумя процессами обеспечивает важный механизм регуляции прокариотических генов. [1]
На уровне инициации РНК-полимераза у прокариот (в частности, у бактерий) прочно связывается с промоторной областью и инициирует высокую базальную скорость транскрипции. Для перехода от близкого к открытому состояния гидролиз АТФ не требуется, плавление промотора обусловлено реакциями связывания, которые благоприятствуют расплавленной конформации. Хроматин значительно затрудняет транскрипцию у эукариот. Сборка большого мультибелкового преинициативного комплекса необходима для промотор-специфической инициации. Плавление промотора у эукариот требует гидролиза АТФ. В результате эукариотические РНК-полимеразы демонстрируют низкую базальную скорость инициации транскрипции. [42]
У позвоночных большинство генных промоутеров содержат остров CpG с многочисленными сайтами CpG . [49] Когда многие из сайтов промотора гена CpG метилированы, ген становится молчащим. [50] Колоректальный рак обычно имеет от 3 до 6 мутаций драйвера и от 33 до 66 мутаций попутчика или пассажира. [51] Однако транскрипционное молчание может иметь большее значение, чем мутация, в возникновении прогрессирования рака. Например, при колоректальном раке около 600-800 генов транскрипционно молчат метилированием острова CpG (см. регуляция транскрипции при раке ). Транскрипционная репрессия при раке может также происходить другими эпигенетическими механизмами, такими как измененная экспрессия микроРНК . [52] При раке молочной железы подавление транскрипции BRCA1 может происходить чаще из-за сверхэкспрессии микроРНК-182, чем из-за гиперметилирования промотора BRCA1 (см. Низкая экспрессия BRCA1 при раке молочной железы и яичников ).