Платиноорганическая химия — химия металлоорганических соединений , содержащих химическую связь углерода с платиной , и изучение платины как катализатора в органических реакциях . [1] [2] [3] Платиноорганические соединения существуют в степени окисления от 0 до IV, причем степень окисления II наиболее распространена. Общий порядок прочности связи следующий: Pt-C (sp) > Pt-O > Pt-N > Pt-C (sp 3 ). Химия платиноорганических и палладийорганических соединений схожа, но платиноорганические соединения более стабильны и, следовательно, менее полезны в качестве катализаторов.
Большинство платиноорганических(0) соединений содержат алкеновые и алкиновые лиганды. Карбонильные комплексы редки, а аналог Ni(CO) 4 неуловим. Алкеновые и алкиновые лиганды служат двухэлектронными донорами, например, в комплексах (PPh 3 ) 2 Pt(C 2 H 4 ) и (PPh 3 ) 2 Pt( C 2 Ph 2 ). Этиленовый лиганд в (PPh 3 ) 2 Pt(C 2 H 4 ) лабилен и обменивается с алкинами и электрофильными алкенами, даже с фуллереном C 60 .
Общий путь синтеза (PPh 3 ) 2 Pt(un) (un = алкен, алкин) представляет собой восстановление тетрахлорплатината калия этанольным гидроксидом калия или гидразином в присутствии фосфинового лиганда, такого как трифенилфосфин , и алкена или алкина. Такие реакции протекают через посредничество цис -дихлорбис(трифенилфосфин)платины(II). Азотсодержащие лиганды часто не способствуют образованию платиновых комплексов алкенов и алкинов.
Нульвалентные платиноорганические комплексы, лишенные фосфиновых лигандов, часто получают с помощью PtCl 2 (COD).
где C 7 H 10 – норборнен .
Соединения платины (I) встречаются редко, но обычно являются диамагнитными, поскольку имеют связи Pt-Pt. Примером может служить дикатион [Pt 2 (CO) 6 ] 2+ .
Исторически значимым платиноорганическим соединением (II) является соль Цейзе , которую получают из этилена и тетрахлорплатината калия :
Бесцветный диолефиновый комплекс дихлор(циклоокта-1,5-диен)платина(II) является более современным родственником и более широко используется.
Стабильность и разнообразие алкеновых комплексов платины(II) контрастируют с редкостью алкеновых комплексов никеля(II). Также распространены аллильные комплексы платины. В отличие от химии никеля, где распространены такие соединения, как CpNi(L)X, циклопентадиенильные производные Pt(II) встречаются редко, что согласуется с нежеланием Pt(II) превращаться в пентакоординат.
Алкил- и арилкомплексы платины(II) часто получают путем окислительного присоединения алкилгалогенида или арилгалогенида к предшественнику Pt(0), такому как тетракис(трифенилфосфин)платина(0) или Pt(C2H4 ) ( PPh3 ) . 2 . Альтернативно, хлориды платины (II) подвержены алкилированию: [4] [5]
Диметилсульфидные лиганды в PtMe 2 (SMe 2 ) 2 могут быть заменены другими лигандами.
Многие платиноорганические комплексы (II) возникают в результате орто-металлирования и связанных с ним процессов внутримолекулярной активации CH.
Первым платиноорганическим соединением, когда-либо синтезированным, был йодид триметилплатины из хлорида платины (IV) и йодида метилмагния , о котором сообщили Поуп и Пичи в 1907 году. [6] [7] Соединение имеет кубаноподобную структуру с четырьмя тройными мостиковыми йодидными лигандами. «Тетраметилплатина» была заявлена в 1952 году Генри Гилманом как производное этого тетрамера, но позже было показано, что это утверждение неверно («Тетраметилплатина» оказалась [PtMe 3 OH] 4 ). Охарактеризованы соли [PtMe 6 ] 2- и [PtMe 4 ] 2- . [8]

Платиноорганические гидриды (IV) встречаются редко. [10] Первые выделенные представители были получены из оловоорганических галогенидов или кислот с ортометалированными соединениями арилплатины(II). Соединение Me(PEt 3 ) 2 PtOTf обратимо реагирует с трифликовой кислотой при температуре от -60 до -80 °C, образуя метан и (PEt 3 ) 2 Pt(OTf) 2 при -20 °C. Слабым кислотам часто достаточно даже воды и спирта, а при активации связи CH источником протонов является алкан.
Гетерогенные катализаторы на основе платины играют важную роль в нефтехимической промышленности , и предполагается, что эти полезные реакции протекают через связанные с поверхностью платиноорганические промежуточные соединения. Более изученными, но менее коммерчески значимыми являются гомогенные катализаторы на основе платины.
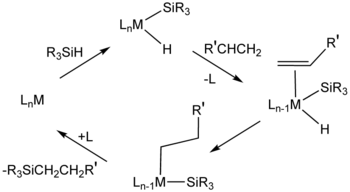
Важным катализатором гидросилилирования является H 2 PtCl 6 («катализатор Шпейера»). Механизмы этой каталитической системы обычно предполагают промежуточные соединения, содержащие гидрид , силильный лиганд (R 3 Si) и алкеновые лиганды. [11] Цис-дихлорбис(диэтилсульфид)платина(II) и катализатор Карстедта (аддукт дивинилтетраметилдисилоксана и платинохлористоводородной кислоты ) также катализируют гидросилилирование . [12] Многие металлодендримеры имеют повторяющиеся звенья на основе платиноорганических соединений.
Платиноорганические соединения участвуют в системе Шилова по превращению метана в хлористый метил . Предпринимались напряженные попытки, пока безуспешные, распространить эту реакционную способность на практические методы функционализации метана. [13] Например, платиновые комплексы бипиримидина катализируют превращение метана, кислорода и триоксида серы в метилбисульфат . [14]