Хлорид натрия / ˌ s oʊ d i ə m ˈ k l ɔːr aɪ d / , [8] обычно известный как пищевая соль , является ионным соединением с химической формулой NaCl , представляющим собой соотношение ионов натрия и хлора 1:1 . Он прозрачный или полупрозрачный, хрупкий, гигроскопичный и встречается в виде минерала галита . В своей съедобной форме он обычно используется в качестве приправы и пищевого консерванта . Большие количества хлорида натрия используются во многих промышленных процессах, и он является основным источником соединений натрия и хлора, используемых в качестве сырья для дальнейшего химического синтеза . Другое важное применение хлорида натрия - борьба с обледенением дорог в морозную погоду.
Помимо привычного бытового использования соли, более распространенными сферами ее применения являются производство приблизительно 250 миллионов тонн соли в год (данные за 2008 год), а именно производство химикатов и борьба с обледенением. [9]
Соль используется, прямо или косвенно, в производстве многих химикатов, которые потребляют большую часть мирового производства. [10]
Это отправная точка для хлорщелочного процесса , промышленного процесса производства хлора и гидроксида натрия , согласно химическому уравнению
Этот электролиз проводится либо в ртутной ячейке, либо в диафрагменной ячейке, либо в мембранной ячейке. Каждая из них использует свой метод для отделения хлора от гидроксида натрия. Другие технологии находятся в стадии разработки из-за высокого потребления энергии электролизом, в результате чего небольшие улучшения эффективности могут иметь большую экономическую отдачу. Некоторые области применения хлора включают производство термопластиков ПВХ , дезинфицирующих средств и растворителей.
Гидроксид натрия широко используется во многих отраслях промышленности, включая производство бумаги, мыла, алюминия и т. д.
Хлорид натрия используется в процессе Сольве для производства карбоната натрия и хлорида кальция . Карбонат натрия, в свою очередь, используется для производства стекла , бикарбоната натрия и красителей , а также множества других химикатов. В процессе Мангейма хлорид натрия используется для производства сульфата натрия и соляной кислоты .
Хлорид натрия широко используется, поэтому даже относительно небольшие приложения могут потреблять огромные количества. В разведке нефти и газа соль является важным компонентом буровых растворов при бурении скважин. [11] Она используется для флокуляции и увеличения плотности бурового раствора для преодоления высокого давления газа в скважине. Всякий раз, когда бур достигает соляного пласта, соль добавляется в буровой раствор для насыщения раствора, чтобы минимизировать растворение в соляном пласте. [9] Соль также используется для ускорения отверждения бетона в зацементированных обсадных колоннах. [10]
В текстильной промышленности и крашении соль используется в качестве солевого ополаскивателя для отделения органических загрязнений, [12] для содействия «высаливанию» осадков красителей и для смешивания с концентрированными красителями для повышения выхода в красильных ваннах и придания цветам более четких очертаний. Одна из ее основных функций — обеспечение положительного заряда ионов для содействия поглощению отрицательно заряженных ионов красителей. [10]
В целлюлозно-бумажной промышленности он применяется для производства хлората натрия , который затем реагирует с серной кислотой и восстановителем, таким как метанол, для производства диоксида хлора — отбеливающего химиката , широко используемого для отбеливания древесной массы .
При дублении и обработке кожи в шкуры животных добавляют соль, чтобы подавить микробную активность на нижней стороне шкур и привлечь влагу обратно в шкуры. [10]
В производстве резины соль используется для производства буны , неопрена и белых резиновых типов. Соляной раствор и серная кислота используются для коагуляции эмульгированного латекса, изготовленного из хлорированного бутадиена . [10] [9]
Соль также добавляется для укрепления почвы и обеспечения прочности основания, на котором строятся автомагистрали. Соль действует, чтобы минимизировать эффекты смещения, вызванные в подповерхности изменениями влажности и транспортной нагрузки. [10]
Жесткая вода содержит ионы кальция и магния, которые мешают действию мыла и способствуют образованию накипи или пленки щелочных минеральных отложений в бытовом и промышленном оборудовании и трубах. Коммерческие и бытовые водоумягчающие установки используют ионообменные смолы для удаления ионов, вызывающих жесткость. Эти смолы генерируются и регенерируются с использованием хлорида натрия. [10] [9]
Второе основное применение соли — это борьба с обледенением и предотвращение обледенения дорог, как в песочницах , так и с помощью транспортных средств зимней службы . В ожидании снегопада дороги оптимально «обрабатываются против обледенения» рассолом (концентрированным раствором соли в воде), который предотвращает сцепление между снегом и льдом на дороге. Эта процедура устраняет необходимость в интенсивном использовании соли после снегопада. Для борьбы с обледенением используются смеси рассола и соли, иногда с дополнительными агентами, такими как хлорид кальция и/или хлорид магния . Использование соли или рассола становится неэффективным ниже −10 °C (14 °F).

Соль для борьбы с обледенением в Соединенном Королевстве в основном поступает из единственной шахты в Уинсфорде в Чешире . Перед распределением ее смешивают с <100 ppm ферроцианида натрия в качестве антислеживающего агента , что позволяет каменной соли свободно вытекать из посыпающих песком транспортных средств, несмотря на то, что она была складирована перед использованием. В последние годы эта добавка также использовалась в поваренной соли. Другие добавки использовались в дорожной соли для снижения общих затрат. Например, в США побочный углеводный раствор от переработки сахарной свеклы смешивался с каменной солью и прилипал к дорожным покрытиям примерно на 40% лучше, чем просто рассыпная каменная соль. Поскольку она оставалась на дороге дольше, обработку не приходилось повторять несколько раз, что экономило время и деньги. [10]
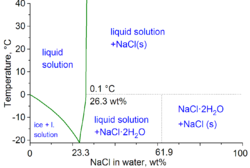
В технических терминах физической химии минимальная температура замерзания смеси воды и соли составляет −21,12 °C (−6,02 °F) для 23,31% по весу соли. Замерзание вблизи этой концентрации, однако, происходит настолько медленно, что эвтектическая точка −22,4 °C (−8,3 °F) может быть достигнута при содержании соли около 25% по весу. [13]
Дорожная соль попадает в пресноводные водоемы и может нанести вред водным растениям и животным, нарушая их способность к осморегуляции . [14] Вездесущность соли в прибрежных районах создает проблему при нанесении любого покрытия , поскольку захваченные соли вызывают большие проблемы с адгезией. Военно-морские власти и судостроители контролируют концентрацию соли на поверхностях во время строительства. Максимальная концентрация соли на поверхностях зависит от власти и применения. В основном используется регламент IMO , который устанавливает уровни соли максимум 50 мг/м 2 растворимых солей, измеряемых как хлорид натрия. Эти измерения проводятся с помощью теста Бресле . Засоление (повышение солености, также известное как синдром засоления пресной воды ) и последующее повышенное выщелачивание металлов являются постоянной проблемой по всей Северной Америке и европейским пресным водным путям. [15]
При борьбе с обледенением шоссе соль ассоциируется с коррозией мостовых настилов, автомобилей, арматурных стержней и проволоки, а также незащищенных стальных конструкций, используемых в дорожном строительстве. Поверхностный сток , распыление транспортных средств и переносимая ветром соль также влияют на почву, придорожную растительность и местные поверхностные и грунтовые воды. Хотя доказательства экологической нагрузки соли были обнаружены во время пикового использования, весенние дожди и оттепели обычно снижают концентрацию натрия в районе, где применялась соль. [10] Исследование 2009 года показало, что примерно 70% дорожной соли, применяемой в районе метро Миннеаполис-Сент-Пол, удерживается в местном водоразделе. [16]
Некоторые агентства заменяют дорожную соль пивом , патокой и свекольным соком. [17] Авиакомпании используют больше гликоля и сахара , а не солевых растворов для борьбы с обледенением . [18]
Соль добавляется в пищу производителем или потребителем в качестве усилителя вкуса, консерванта, связующего вещества, добавки для контроля ферментации , агента для контроля текстуры и проявителя цвета. Потребление соли в пищевой промышленности подразделяется в порядке убывания потребления на другие виды переработки пищевых продуктов, упаковку мяса, консервирование , выпечку, молочные продукты и продукты переработки зерна. Соль добавляется для улучшения цвета бекона, ветчины и других переработанных мясных продуктов. Как консервант, соль подавляет рост бактерий. Соль действует как связующее вещество в колбасах, образуя связующий гель, состоящий из мяса, жира и влаги. Соль также действует как усилитель вкуса и как тендеризатор . [10]
Он используется как дешевый и безопасный осушитель из-за своих гигроскопических свойств, что делает соление эффективным методом сохранения продуктов питания исторически; соль вытягивает воду из бактерий посредством осмотического давления , не давая им размножаться, что является основным источником порчи продуктов. Несмотря на то, что доступны более эффективные осушители, немногие из них безопасны для употребления человеком. Многие микроорганизмы не могут жить в соленой среде: вода вытягивается из их клеток посредством осмоса . По этой причине соль используется для сохранения некоторых продуктов, таких как бекон, рыба или капуста.
Во многих молочных производствах соль добавляется в сыр в качестве агента, контролирующего цвет, ферментацию и текстуру. Молочный подсектор включает компании, которые производят сливочное масло, сгущенное и выпаренное молоко, замороженные десерты, мороженое, натуральный и плавленый сыр и специальные молочные продукты. В консервировании соль в первую очередь добавляется как усилитель вкуса и консервант . Она также используется как носитель для других ингредиентов, обезвоживающий агент, ингибитор ферментов и тендеризатор. В выпечке соль добавляется для контроля скорости ферментации в тесте для хлеба. Она также используется для укрепления глютена (эластичного комплекса белок-вода в некоторых видах теста) и как усилитель вкуса, например, в качестве начинки для хлебобулочных изделий. Категория пищевой промышленности также включает продукты из зерновых мельниц. Эти продукты состоят из помола муки и риса и производства зерновых завтраков и смешанной или приготовленной муки. Соль также используется в качестве приправы, например, в картофельных чипсах, кренделях и корме для кошек и собак. [10]
Хлорид натрия используется в ветеринарии как рвотный агент. Он дается в виде теплого насыщенного раствора. Рвоту также можно вызвать путем помещения в глотку небольшого количества простой соли или солевых кристаллов.
Хлорид натрия используется вместе с водой как один из основных растворов для внутривенной терапии . Назальный спрей часто содержит солевой раствор.
Хлорид натрия также доступен в форме пероральных таблеток и принимается для лечения низкого уровня натрия. [19]

Хлорид натрия является основным огнетушащим веществом в порошковых огнетушителях , которые используются при возгорании горючих металлов, таких как магний, цирконий, титан и литий (огнетушители класса D). Соль образует корку, исключающую кислород, которая подавляет огонь. [20]
По крайней мере со времен Средневековья люди использовали соль в качестве очищающего средства, натирая ею поверхности в доме. Она также используется во многих марках шампуня , зубной пасты и, как правило, для удаления льда с подъездных путей и участков льда.
Кристаллы хлорида натрия имеют коэффициент пропускания не менее 90% (через 1 мм) для инфракрасного света с длинами волн в диапазоне 0,2–18 мкм . [21] Они использовались в оптических компонентах, таких как окна и линзы, где в этом спектральном диапазоне существовало мало непоглощающих альтернатив. Несмотря на свою дешевизну, кристаллы NaCl мягкие и гигроскопичные — при воздействии воды в окружающем воздухе они постепенно покрываются «инеем». Это ограничивает применение NaCl сухими средами, вакуумно-герметичными областями или краткосрочным использованием, таким как прототипирование. Материалы, которые механически прочнее и менее чувствительны к влаге, такие как цинк-селенидные и халькогенидные стекла , более широко используются, чем NaCl.

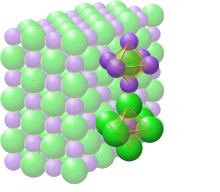
В твердом хлориде натрия каждый ион окружен шестью ионами противоположного заряда, как и ожидалось по электростатическим причинам. Окружающие ионы расположены в вершинах правильного октаэдра . На языке плотной упаковки более крупные ионы хлорида (размером 167 пм [22] ) расположены в кубическом массиве, тогда как более мелкие ионы натрия (116 пм [22] ) заполняют все кубические промежутки (октаэдрические пустоты) между ними. Эта же базовая структура встречается во многих других соединениях и обычно известна как структура NaCl или кристаллическая структура каменной соли. Ее можно представить как гранецентрированную кубическую (ГЦК) решетку с двухатомным базисом или как две взаимопроникающие гранецентрированные кубические решетки. Первый атом расположен в каждой точке решетки, а второй атом расположен на полпути между точками решетки вдоль края элементарной ячейки ГЦК.
Твердый хлорид натрия имеет температуру плавления 801 °C, а жидкий хлорид натрия кипит при 1465 °C. Видеоизображение в реальном времени с атомным разрешением позволяет визуализировать начальную стадию зарождения кристаллов хлорида натрия. [23]
Теплопроводность хлорида натрия в зависимости от температуры имеет максимум 2,03 Вт/(см·К) при 8 К (−265,15 °C; −445,27 °F) и уменьшается до 0,069 при 314 К (41 °C; 106 °F). Она также уменьшается с легированием . [ 24]
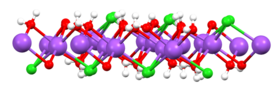
Из холодных (ниже точки замерзания) растворов соль кристаллизуется с гидратной водой в виде гидрогалита (дигидрата NaCl·2H2O ) . [ 26]
В 2023 году было обнаружено, что под давлением хлорид натрия может образовывать гидраты NaCl·8,5H 2 O и NaCl·13H 2 O. [27]
Притяжение между ионами Na + и Cl− в твердом теле настолько сильное, что только сильнополярные растворители, такие как вода, хорошо растворяют NaCl.
При растворении в воде каркас хлорида натрия распадается, поскольку ионы Na + и Cl − оказываются окруженными полярными молекулами воды. Эти растворы состоят из металлического аквакомплекса с формулой [Na(H 2 O) 8 ] + , с расстоянием Na–O 250 пм . Ионы хлорида также сильно сольватированы, каждый из них окружен в среднем шестью молекулами воды. [28] Растворы хлорида натрия имеют совсем другие свойства, чем чистая вода. Эвтектическая точка составляет -21,12 °C (-6,02 °F) для 23,31% массовой доли соли, а температура кипения насыщенного раствора соли составляет около 108,7 °C (227,7 °F). [13]
pH раствора хлорида натрия остается ≈7 из-за чрезвычайно слабой основности иона Cl − , который является сопряженным основанием сильной кислоты HCl. Другими словами, NaCl не оказывает влияния на pH системы [29] в разбавленных растворах, где эффекты ионной силы и коэффициентов активности пренебрежимо малы.
Поваренная соль имеет молярное соотношение натрия и хлора 1:1. В 2013 году были обнаружены соединения натрия и хлорида с различной стехиометрией ; было предсказано пять новых соединений (например, Na 3 Cl, Na 2 Cl, Na 3 Cl 2 , NaCl 3 и NaCl 7 ). Существование некоторых из них было экспериментально подтверждено при высоких давлениях и других условиях: кубический и орторомбический NaCl 3 , двумерный металлический тетрагональный Na 3 Cl и экзотический гексагональный NaCl. [31] Это указывает на то, что соединения, нарушающие химическую интуицию, возможны в простых системах в условиях, отличных от условий окружающей среды. [32]
Соль содержится в земной коре в виде минерала галита (каменной соли), а небольшое ее количество существует в виде взвешенных частиц морской соли в атмосфере. [33] Эти частицы являются доминирующими ядрами конденсации облаков далеко в море, что позволяет образовывать облака в в остальном незагрязненном воздухе . [34]
В настоящее время соль массово производится путем испарения морской воды или рассола из соляных скважин и соляных озер . Добыча каменной соли также является основным источником. Китай является основным мировым поставщиком соли. [10] В 2017 году мировое производство оценивалось в 280 миллионов тонн , причем пятью крупнейшими производителями (в миллионах тонн) были Китай (68,0), США (43,0), Индия (26,0), Германия (13,0) и Канада (13,0). [35] Соль также является побочным продуктом добычи калия .
Нейтрализация сильной кислоты и сильного основания дает нейтральную соль.