
В химическом анализе хроматография — это лабораторный метод разделения смеси на компоненты. Смесь растворяется в жидком растворителе (газе или жидкости), называемом подвижной фазой , который переносит ее через систему (колонку, капиллярную трубку, пластину или лист), на которой закреплен материал, называемый неподвижной фазой . Поскольку различные компоненты смеси, как правило, имеют разное сродство к неподвижной фазе и удерживаются в течение разного времени в зависимости от их взаимодействия с ее поверхностными участками, компоненты перемещаются с разной кажущейся скоростью в подвижной жидкости, заставляя их разделяться. Разделение основано на дифференциальном разделении между подвижной и неподвижной фазами. Незначительные различия в коэффициенте распределения соединения приводят к дифференцированному удерживанию на неподвижной фазе и, таким образом, влияют на разделение. [1]
Хроматография может быть препаративной или аналитической . Цель препаративной хроматографии — разделение компонентов смеси для последующего использования, и, таким образом, она является формой очистки . [2] [3] Этот процесс связан с более высокими затратами из-за способа его производства. [4] [2] Аналитическая хроматография обычно проводится с меньшими количествами материала и предназначена для установления наличия или измерения относительных пропорций аналитов в смеси. Эти два типа не являются взаимоисключающими. [5]
Хроматография , произносится как / ˌkroʊməˈtɒɡrəf i / , происходит от греческого χρῶμα chrōma , что означает « цвет » , и γράφειν gráphein , что означает «писать». Сочетание этих двух терминов было напрямую унаследовано от изобретения техники, впервые использованной для разделения биологических пигментов . [ 6 ]
Хроматография была впервые изобретена в Варшавском университете русским ученым итальянского происхождения Михаилом Цветом в 1900 году. [7] [8] Он разработал технику и ввел термин хроматография в первом десятилетии 20-го века, в первую очередь для разделения растительных пигментов, таких как хлорофилл , каротины и ксантофиллы . Поскольку эти компоненты разделяются полосами разного цвета (зеленый, оранжевый и желтый соответственно), они напрямую вдохновили название техники. Новые типы хроматографии, разработанные в 1930-х и 1940-х годах, сделали эту технику полезной для многих процессов разделения . [9]
Техника хроматографии существенно развилась в результате работы Арчера Джона Портера Мартина и Ричарда Лоуренса Миллингтона Синджа в 1940-х и 1950-х годах, за которую они получили Нобелевскую премию по химии 1952 года . [10] Они установили принципы и основные методы распределительной хроматографии, и их работа способствовала быстрому развитию нескольких хроматографических методов: бумажной хроматографии , газовой хроматографии и того, что станет известно как высокоэффективная жидкостная хроматография . С тех пор технология быстро развивалась. Исследователи обнаружили, что основные принципы хроматографии Цвета можно применять многими различными способами, что привело к появлению различных разновидностей хроматографии, описанных ниже. Достижения постоянно улучшают технические характеристики хроматографии, позволяя разделять все более похожие молекулы.
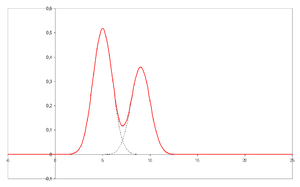
 На оси x отложено время удерживания, а на оси y — сигнал (например, полученный спектрофотометром , масс -спектрометром или рядом других детекторов), соответствующий отклику, создаваемому аналитами, выходящими из системы. В случае оптимальной системы сигнал пропорционален концентрации конкретного разделенного аналита.
На оси x отложено время удерживания, а на оси y — сигнал (например, полученный спектрофотометром , масс -спектрометром или рядом других детекторов), соответствующий отклику, создаваемому аналитами, выходящими из системы. В случае оптимальной системы сигнал пропорционален концентрации конкретного разделенного аналита.Хроматография основана на концепции коэффициента распределения. Любое растворенное вещество распределяется между двумя несмешивающимися растворителями. Когда один растворитель становится неподвижным (путем адсорбции на твердой матрице носителя), а другой — подвижным, это приводит к наиболее распространенным применениям хроматографии. Если матрица носителя или неподвижная фаза является полярной (например, целлюлоза , силикагель и т. д.), это хроматография прямой фазы. В противном случае этот метод известен как обращенно-фазовый, где используется неполярная неподвижная фаза (например, неполярное производное C-18 ).
Колоночная хроматография — это метод разделения, при котором неподвижный слой находится внутри трубки. Частицы твердой неподвижной фазы или носителя, покрытого жидкой неподвижной фазой, могут заполнять весь внутренний объем трубки (насадочная колонка) или концентрироваться на внутренней стенке трубки или вдоль нее, оставляя открытый, неограниченный путь для подвижной фазы в средней части трубки (открытая трубчатая колонка). Различия в скоростях движения через среду рассчитываются для разных времен удерживания образца. [12] [13] В 1978 году У. Кларк Стилл представил модифицированную версию колоночной хроматографии, названную флэш-колоночной хроматографией (флэш). [14] [15] Метод очень похож на традиционную колоночную хроматографию, за исключением того, что растворитель прогоняется через колонку путем приложения положительного давления. Это позволило выполнить большинство разделений менее чем за 20 минут, с улучшенными разделениями по сравнению со старым методом. Современные системы флэш-хроматографии продаются в виде предварительно упакованных пластиковых картриджей, а растворитель прокачивается через картридж. Системы также могут быть связаны с детекторами и коллекторами фракций, обеспечивая автоматизацию. Внедрение градиентных насосов привело к более быстрому разделению и меньшему использованию растворителя.
В адсорбции с расширенным слоем используется псевдоожиженный слой, а не твердая фаза, созданная уплотненным слоем. Это позволяет исключить начальные этапы очистки, такие как центрифугирование и фильтрация, для культуральных бульонов или суспензий разрушенных клеток.
Фосфоцеллюлозная хроматография использует связывающую аффинность многих ДНК-связывающих белков для фосфоцеллюлозы. Чем сильнее взаимодействие белка с ДНК, тем выше концентрация соли, необходимая для элюирования этого белка. [16]
Планарная хроматография — это метод разделения, в котором неподвижная фаза присутствует в виде плоскости или на ней. Плоскость может быть бумагой, служащей таковой или пропитанной веществом в качестве неподвижного слоя ( бумажная хроматография ) или слоем твердых частиц, распределенных на подложке, такой как стеклянная пластина ( тонкослойная хроматография ). Различные соединения в смеси образцов перемещаются на разные расстояния в зависимости от того, насколько сильно они взаимодействуют с неподвижной фазой по сравнению с подвижной фазой. Удельный коэффициент удерживания (R f ) каждого химического вещества может быть использован для идентификации неизвестного вещества.


Бумажная хроматография — это метод, который включает в себя размещение небольшой точки или линии раствора образца на полоске хроматографической бумаги . Бумага помещается в контейнер с тонким слоем растворителя и герметично закрывается. Когда растворитель поднимается через бумагу, он встречается со смесью образцов, которая начинает перемещаться вверх по бумаге вместе с растворителем. Эта бумага сделана из целлюлозы , полярного вещества , и соединения в смеси перемещаются дальше, если они менее полярны. Более полярные вещества связываются с целлюлозной бумагой быстрее и, следовательно, не перемещаются так далеко.

Тонкослойная хроматография (ТСХ) — это широко применяемый лабораторный метод, используемый для разделения различных биохимических веществ на основе их относительного притяжения к неподвижной и подвижной фазам. Он похож на бумажную хроматографию . Однако вместо использования неподвижной фазы бумаги он включает неподвижную фазу тонкого слоя адсорбента, такого как силикагель , оксид алюминия или целлюлоза, на плоской инертной подложке . ТСХ очень универсальна; несколько образцов могут быть разделены одновременно на одном и том же слое, что делает его очень полезным для скрининговых приложений, таких как тестирование уровней лекарственных препаратов и чистоты воды. [17]
Вероятность перекрестного загрязнения низкая, поскольку каждое разделение выполняется на новом слое. По сравнению с бумагой, она имеет преимущество в виде более быстрых запусков, лучшего разделения, лучшего количественного анализа и выбора между различными адсорбентами. Для еще лучшего разрешения и более быстрого разделения, которое использует меньше растворителя, можно использовать высокоэффективную ТСХ . Более старым популярным применением было дифференцирование хромосом путем наблюдения за расстоянием в геле (разделение было отдельным шагом).
Основной принцип вытеснительной хроматографии : молекула с высоким сродством к хроматографической матрице (вытеснитель) эффективно конкурирует за места связывания и, таким образом, вытесняет все молекулы с меньшим сродством. [18] Существуют четкие различия между вытеснительной и элюционной хроматографией. В режиме элюции вещества обычно выходят из колонки в виде узких гауссовых пиков. Для максимальной очистки желательно широкое разделение пиков, предпочтительно до базовой линии. Скорость, с которой любой компонент смеси перемещается по колонке в режиме элюции, зависит от многих факторов. Но для того, чтобы два вещества перемещались с разной скоростью и, таким образом, были разделены, должны быть существенные различия в некотором взаимодействии между биомолекулами и хроматографической матрицей. Рабочие параметры регулируются для максимального увеличения эффекта этой разницы. Во многих случаях разделение пиков до базовой линии может быть достигнуто только при градиентном элюировании и низкой загрузке колонки. Таким образом, два недостатка хроматографии в режиме элюции, особенно в препаративном масштабе, — это сложность эксплуатации из-за градиентной прокачки растворителя и низкая пропускная способность из-за низкой загрузки колонки. Вытеснительная хроматография имеет преимущества перед элюционной хроматографией в том, что компоненты разделяются на последовательные зоны чистых веществ, а не на «пики». Поскольку процесс использует нелинейность изотерм , на данной колонке можно разделить большее количество исходного материала колонки, при этом очищенные компоненты извлекаются при значительно более высоких концентрациях.
Газовая хроматография (ГХ), также иногда называемая газожидкостной хроматографией (ГЖХ), представляет собой метод разделения, в котором подвижной фазой является газ. Газохроматографическое разделение всегда осуществляется в колонке, которая обычно является «насадочной» или «капиллярной». Насадочные колонки являются обычными рабочими лошадками газовой хроматографии, поскольку они дешевле и проще в использовании и часто обеспечивают адекватную производительность. Капиллярные колонки обычно дают гораздо лучшее разрешение и, хотя они более дороги, становятся широко используемыми, особенно для сложных смесей. Кроме того, капиллярные колонки можно разделить на три класса: открытые трубчатые колонки с пористым слоем (PLOT), открытые трубчатые колонки с покрытием стенок (WCOT) и открытые трубчатые колонки с покрытием подложки (SCOT). Колонки PLOT уникальны тем, что неподвижная фаза адсорбируется на стенках колонки, в то время как колонки WCOT имеют неподвижную фазу, которая химически связана со стенками. Колонки SCOT в некотором роде являются комбинацией двух упомянутых типов, в том смысле, что они имеют частицы носителя, прикрепленные к стенкам колонки, но эти частицы имеют жидкую фазу, химически связанную с ними. [19] Оба типа колонок изготавливаются из неадсорбирующих и химически инертных материалов. Нержавеющая сталь и стекло являются обычными материалами для насадочных колонок, а кварц или плавленый кварц — для капиллярных колонок.
Газовая хроматография основана на равновесии распределения аналита между твердой или вязкой жидкой неподвижной фазой (часто жидким материалом на основе силикона) и подвижным газом (чаще всего гелием). Неподвижная фаза прилипает к внутренней части стеклянной или кварцевой трубки небольшого диаметра (обычно внутренний диаметр 0,53–0,18 мм) (капиллярная колонка) или твердой матрице внутри более крупной металлической трубки (насадочная колонка). Она широко используется в аналитической химии ; хотя высокие температуры, используемые в ГХ, делают ее непригодной для высокомолекулярных биополимеров или белков (тепло денатурирует их), часто встречающихся в биохимии , она хорошо подходит для использования в нефтехимии , мониторинге окружающей среды и рекультивации , а также в областях промышленной химии . Она также широко используется в химических исследованиях.
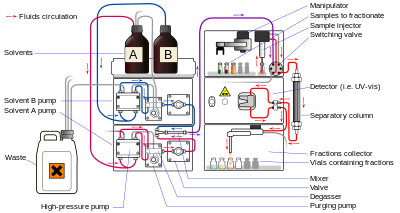
Жидкостная хроматография (ЖХ) — это метод разделения, в котором подвижной фазой является жидкость. Он может проводиться как в колонке, так и в плоскости. Современная жидкостная хроматография, которая обычно использует очень маленькие частицы насадки и относительно высокое давление, называется высокоэффективной жидкостной хроматографией .
В ВЭЖХ образец продавливается жидкостью под высоким давлением (подвижная фаза) через колонку, заполненную неподвижной фазой, состоящей из частиц неправильной или сферической формы, пористого монолитного слоя или пористой мембраны. Монолиты представляют собой «губчатую хроматографическую среду» [2] и состоят из бесконечного блока органических или неорганических частей. ВЭЖХ исторически делится на два различных подкласса на основе полярности подвижной и неподвижной фаз. Методы, в которых неподвижная фаза более полярна, чем подвижная фаза (например, толуол в качестве подвижной фазы, силикагель в качестве неподвижной фазы), называются нормально-фазовой жидкостной хроматографией (НФЖХ), а противоположные (например, смесь воды и метанола в качестве подвижной фазы и C18 (октадецилсилил) в качестве неподвижной фазы) называются обращенно-фазовой жидкостной хроматографией (ОФЖХ).
Сверхкритическая флюидная хроматография — это метод разделения, в котором подвижной фазой является жидкость при температуре и давлении выше или относительно близко к критическим.
Конкретные методы в рамках этого широкого заголовка перечислены ниже.
Аффинная хроматография [20] основана на селективном нековалентном взаимодействии между аналитом и определенными молекулами. Она очень специфична, но не очень надежна. [21] Она часто используется в биохимии при очистке белков, связанных с тегами. Эти слитые белки маркируются такими соединениями, как His-теги , биотин или антигены , которые специфически связываются с неподвижной фазой. После очистки эти теги обычно удаляются и получается чистый белок.
Аффинная хроматография часто использует сродство биомолекулы к катионам металла (Zn, Cu, Fe и т. д.). Колонки часто готовятся вручную и могут быть разработаны специально для интересующих белков. Традиционные аффинные колонки используются в качестве подготовительного шага для вымывания нежелательных биомолекул или в качестве основного шага при анализе белка с неизвестными физическими свойствами. [22]
Однако существуют методы жидкостной хроматографии, которые используют свойства аффинной хроматографии. Иммобилизованная металл-аффинная хроматография (IMAC) [23] [24] полезна для разделения вышеупомянутых молекул на основе относительного сродства к металлу. Часто эти колонки могут быть загружены различными металлами для создания колонки с целевым сродством. [25]
Ионообменная хроматография (обычно называемая ионной хроматографией) использует механизм ионного обмена для разделения аналитов на основе их соответствующих зарядов. Обычно она выполняется в колонках, но также может быть полезна в плоскостном режиме. Ионообменная хроматография использует заряженную неподвижную фазу для разделения заряженных соединений, включая анионы , катионы , аминокислоты , пептиды и белки . В обычных методах неподвижная фаза представляет собой ионообменную смолу , которая несет заряженные функциональные группы , которые взаимодействуют с противоположно заряженными группами соединения для удержания. Существует два типа ионообменной хроматографии: катионообменная и анионообменная. В катионообменной хроматографии неподвижная фаза имеет отрицательный заряд, а обмениваемый ион является катионом, тогда как в анионообменной хроматографии неподвижная фаза имеет положительный заряд, а обмениваемый ион является анионом. [26] Ионообменная хроматография обычно используется для очистки белков с помощью FPLC .
Эксклюзионная хроматография (SEC) также известна как гель-проникающая хроматография (GPC) или гель-фильтрационная хроматография и разделяет молекулы в соответствии с их размером (или, точнее, в соответствии с их гидродинамическим диаметром или гидродинамическим объемом). Более мелкие молекулы способны проникать в поры среды, и, следовательно, молекулы захватываются и удаляются из потока подвижной фазы. Среднее время пребывания в порах зависит от эффективного размера молекул аналита. Однако молекулы, которые больше среднего размера пор упаковки, исключаются и, таким образом, по существу, не испытывают удерживания; такие виды элюируются первыми. Это, как правило, метод хроматографии с низким разрешением, и поэтому его часто резервируют для конечного, «полирующего» этапа очистки. Он также полезен для определения третичной структуры и четвертичной структуры очищенных белков, особенно потому, что его можно проводить в условиях нативного раствора.
Хроматографическая адсорбционная колонка с расширенным слоем (EBA) для процесса биохимического разделения включает в себя распределитель жидкости выравнивания давления, имеющий функцию самоочистки под пористой блокирующей ситовой пластиной в нижней части расширенного слоя, верхнюю часть соплового узла, имеющего функцию очистки обратной промывкой в верхней части расширенного слоя, лучшее распределение исходного раствора, добавляемого в расширенный слой, гарантируя, что жидкость, прошедшая через слой расширенного слоя, отображает состояние поршневого потока. Слой расширенного слоя отображает состояние поршневого потока. Хроматографическая разделительная колонка с расширенным слоем имеет преимущества в повышении эффективности разделения расширенного слоя.
Хроматография с адсорбцией в расширенном слое (EBA) является удобным и эффективным методом захвата белков непосредственно из неосветленного образца сырой нефти. В хроматографии с EBA осажденный слой сначала расширяется восходящим потоком буфера уравновешивания. Сырой материал, представляющий собой смесь растворимых белков, загрязняющих веществ, клеток и клеточного детрита, затем пропускается вверх через расширенный слой. Целевые белки захватываются адсорбентом, в то время как частицы и загрязняющие вещества проходят через него. Изменение буфера элюирования при сохранении восходящего потока приводит к десорбции целевого белка в режиме расширенного слоя. В качестве альтернативы, если поток реверсируется, адсорбированные частицы быстро осядут, и белки могут быть десорбированы буфером элюирования. Режим, используемый для элюирования (расширенный слой или осажденный слой), зависит от характеристик сырья. После элюирования адсорбент очищается заранее определенным раствором для очистки на месте (CIP), после чего следует либо регенерация колонки (для дальнейшего использования), либо хранение.
Обращенно-фазовая хроматография (RPC) — это любая процедура жидкостной хроматографии, в которой подвижная фаза значительно более полярна, чем неподвижная фаза. Она так названа, потому что в нормально-фазовой жидкостной хроматографии подвижная фаза значительно менее полярна, чем неподвижная фаза. Гидрофобные молекулы в подвижной фазе имеют тенденцию адсорбироваться на относительно гидрофобной неподвижной фазе. Гидрофильные молекулы в подвижной фазе будут иметь тенденцию элюироваться первыми. Разделительные колонки обычно содержат углеродную цепь C8 или C18, связанную с субстратом из частиц кремния.
Гидрофобная хроматография взаимодействия (HIC) — это метод очистки и анализа, который разделяет аналиты, такие как белки, на основе гидрофобных взаимодействий между этим аналитом и хроматографической матрицей. Он может обеспечить неденатурирующий ортогональный подход к обращенно-фазовому разделению, сохраняя нативные структуры и потенциально активность белка. В гидрофобной хроматографии взаимодействия материал матрицы слегка замещен гидрофобными группами. Эти группы могут варьироваться от метильных, этильных, пропильных, бутильных, октильных или фенильных групп. [27] При высоких концентрациях соли неполярные боковые цепи на поверхности белков «взаимодействуют» с гидрофобными группами; то есть оба типа групп исключаются полярным растворителем (гидрофобные эффекты усиливаются за счет повышенной ионной силы). Таким образом, образец наносится на колонку в буфере, который является высокополярным, что приводит к ассоциации гидрофобных участков на аналите с неподвижной фазой. Элюент обычно представляет собой водный буфер с уменьшающейся концентрацией соли, увеличивающейся концентрацией детергента (который нарушает гидрофобные взаимодействия) или изменениями pH. Решающее значение имеет тип используемой соли, при этом более космотропные соли, как определено серией Гофмейстера, обеспечивают наибольшее структурирование воды вокруг молекулы и результирующее гидрофобное давление. Для этой цели часто используют сульфат аммония. Добавление органических растворителей или других менее полярных компонентов может помочь улучшить разрешение.
В целом, хроматография гидрофобного взаимодействия (HIC) выгодна, если образец чувствителен к изменению pH или агрессивным растворителям, обычно используемым в других типах хроматографии, но не к высоким концентрациям солей. Обычно варьируется количество соли в буфере. В 2012 году Мюллер и Францреб описали влияние температуры на HIC с использованием бычьего сывороточного альбумина (BSA) с четырьмя различными типами гидрофобной смолы. Исследование изменяло температуру, чтобы повлиять на связывающую способность BSA с матрицей. Был сделан вывод, что циклическое изменение температуры от 40 до 10 градусов Цельсия не будет достаточным для эффективного вымывания всего BSA из матрицы, но может быть очень эффективным, если колонка будет использоваться только несколько раз. [28] Использование температуры для осуществления изменений позволяет лабораториям сократить расходы на покупку соли и экономит деньги.
Если необходимо избежать высоких концентраций соли вместе с колебаниями температуры, можно использовать более гидрофобный, чтобы конкурировать с образцом для его элюирования. Этот так называемый независимый от соли метод HIC показал прямую изоляцию человеческого иммуноглобулина G (IgG) из сыворотки с удовлетворительным выходом и использовал β-циклодекстрин в качестве конкурента для вытеснения IgG из матрицы. [29] Это в значительной степени открывает возможность использования HIC с образцами, которые чувствительны к соли, поскольку, как мы знаем, высокие концентрации соли осаждают белки.
Гидродинамическая хроматография (ГДХ) основана на наблюдаемом явлении, что крупные капли движутся быстрее мелких. [30] В колонке это происходит из-за того, что центр масс крупных капель не может находиться так близко к стенкам колонки, как мелкие капли, из-за их большего общего размера. [31] Более крупные капли будут элюироваться первыми из середины колонки, в то время как более мелкие капли прилипают к стенкам колонки и элюируются последними. Эта форма хроматографии полезна для разделения аналитов по молярной массе (или молекулярной массе), размеру, форме и структуре при использовании в сочетании с детекторами рассеяния света , вискозиметрами и рефрактометрами . [32] Два основных типа ГДХ — это открытая трубка и насадочная колонка . Открытая трубка обеспечивает быстрое время разделения для мелких частиц, тогда как насадочная колонка ГДХ может повысить разрешение и лучше подходит для частиц со средней молекулярной массой больше дальтонов . [33] HDC отличается от других типов хроматографии, поскольку разделение происходит только в интерстициальном объеме, который представляет собой объем, окружающий и находящийся между частицами в упакованной колонке. [34]
HDC имеет тот же порядок элюирования, что и хроматография исключения размера (SEC), но эти два процесса все еще во многом различаются. [33] В исследовании, сравнивающем два типа разделения, Айзенберг, Брюэр, Коте и Штригель использовали оба метода для характеристики полисахаридов и пришли к выводу, что HDC в сочетании с многоугловым рассеянием света (MALS) достигает более точного распределения молярной массы по сравнению с автономным MALS, чем SEC за значительно меньшее время. [35] Это во многом связано с тем, что SEC является более деструктивным методом из-за пор в колонке, разрушающих аналит во время разделения, что, как правило, влияет на распределение массы. [35] Однако основным недостатком HDC является низкое разрешение пиков аналита, что делает SEC более приемлемым вариантом при использовании с химическими веществами, которые нелегко разлагаются и где быстрое элюирование не важно. [36]
HDC играет особенно важную роль в области микрофлюидики . Первый успешный аппарат для системы HDC-on-a-chip был предложен Chmela и др. в 2002 году. [37] Их конструкция позволяла достигать разделения с использованием канала длиной 80 мм в течение 3 минут для частиц с диаметром от 26 до 110 нм, но авторы выразили необходимость улучшить параметры удерживания и дисперсии . [37] В публикации 2010 года Jellema, Markesteijn, Westerweel и Verpoorte реализация HDC с рециркулирующим двунаправленным потоком привела к высокому разрешению разделения на основе размера с каналом длиной всего 3 мм. [38] Наличие такого короткого канала и высокого разрешения считалось особенно впечатляющим, учитывая, что в предыдущих исследованиях использовались каналы длиной 80 мм. [37] Для биологического применения в 2007 году Huh и др. предложил микрофлюидное сортировочное устройство на основе HDC и гравитации, которое было полезно для предотвращения попадания потенциально опасных частиц диаметром более 6 микрон в кровоток при введении контрастных веществ в ультразвуковых исследованиях . [39] Это исследование также продвинулось в области экологической устойчивости в микрофлюидике из-за отсутствия внешней электроники, управляющей потоком, что стало преимуществом использования устройства на основе гравитации.

В некоторых случаях селективность, обеспечиваемая использованием одной колонки, может быть недостаточной для обеспечения разрешения аналитов в сложных образцах. Двумерная хроматография направлена на повышение разрешения этих пиков за счет использования второй колонки с другими физико-химическими ( химическая классификация ) свойствами. [40] [41] Поскольку механизм удерживания на этом новом твердом носителе отличается от разделения в первом измерении, можно разделить соединения с помощью двумерной хроматографии , которые неразличимы с помощью одномерной хроматографии. Более того, разделение во втором измерении происходит быстрее, чем в первом измерении. [40] Примером разделения TDC является то, что образец наносится на один угол квадратной пластины, проявляется, высушивается на воздухе, затем поворачивается на 90° и обычно повторно проявляется во второй системе растворителей.
Двумерная хроматография может применяться для разделения ГХ или ЖХ. [40] [41] Подход с вырезанием сердцевины выбирает определенную интересующую область в первом измерении для разделения, [42] а комплексный подход использует все аналиты при разделении во втором измерении. [40] [41]
Методика имитированного движущегося слоя (SMB) является вариантом высокоэффективной жидкостной хроматографии; она используется для разделения частиц и/или химических соединений, которые было бы трудно или невозможно разделить в противном случае. Это повышенное разделение достигается за счет клапанно-колоночной компоновки, которая используется для неограниченного удлинения неподвижной фазы. В методике препаративной хроматографии с движущимся слоем ввод исходного материала и извлечение аналита происходят одновременно и непрерывно, но из-за практических трудностей с непрерывно движущимся слоем была предложена методика имитированного движущегося слоя. В методике имитированного движущегося слоя вместо перемещения слоя входное отверстие для образца и выходное отверстие для аналита перемещаются непрерывно, создавая впечатление движущегося слоя. Истинная хроматография с движущимся слоем (TMBC) является лишь теоретической концепцией. Ее имитация, SMBC, достигается за счет использования множества последовательных колонок и сложной компоновки клапанов. Такое расположение клапанов обеспечивает подачу пробы и растворителя, а также отбор аналита и отходов в соответствующих местах любой колонки, что позволяет через равные промежутки времени переключать подачу пробы в одном направлении, подачу растворителя в противоположном направлении, одновременно соответствующим образом изменяя положения отбора аналита и отходов.
Пиролиз-газовая хроматография-масс-спектрометрия — это метод химического анализа, при котором образец нагревается до разложения с образованием более мелких молекул, которые разделяются с помощью газовой хроматографии и обнаруживаются с помощью масс-спектрометрии.
Пиролиз — это термическое разложение материалов в инертной атмосфере или вакууме. Образец приводится в прямой контакт с платиновой проволокой или помещается в кварцевую пробирку и быстро нагревается до 600–1000 °C. В зависимости от применения используются даже более высокие температуры. В настоящих пиролизерах используются три различных метода нагрева: изотермическая печь, индукционный нагрев (нить накаливания с точкой Кюри) и резистивный нагрев с использованием платиновых нитей. Крупные молекулы расщепляются в своих самых слабых точках и производят более мелкие, более летучие фрагменты. Эти фрагменты можно разделить с помощью газовой хроматографии. Хроматограммы пиролиза ГХ обычно сложны, поскольку образуется широкий спектр различных продуктов разложения. Данные можно использовать либо в качестве отпечатков пальцев для подтверждения идентичности материала, либо данные ГХ/МС использовать для идентификации отдельных фрагментов с целью получения структурной информации. Чтобы увеличить летучесть полярных фрагментов, к образцу перед пиролизом можно добавлять различные метилирующие реагенты.
Помимо использования специализированных пиролизеров, пиролизную ГХ твердых и жидких образцов можно выполнять непосредственно внутри инжекторов испарителя с программируемой температурой (PTV), которые обеспечивают быстрый нагрев (до 30 °C/с) и высокие максимальные температуры 600–650 °C. Этого достаточно для некоторых применений пиролиза. Главное преимущество заключается в том, что не нужно приобретать специальный прибор, а пиролиз можно выполнять как часть рутинного анализа ГХ. В этом случае необходимо использовать кварцевые входные лайнеры ГХ. Можно получить количественные данные, а также опубликованы хорошие результаты дериватизации внутри инжектора PTV.
Быстрая жидкостная хроматография белков (FPLC) — это форма жидкостной хроматографии, которая часто используется для анализа или очистки смесей белков. Как и в других формах хроматографии, разделение возможно, поскольку различные компоненты смеси имеют разное сродство к двум материалам: движущейся жидкости («подвижная фаза») и пористому твердому телу (неподвижная фаза). В FPLC подвижная фаза представляет собой водный раствор или «буфер». Скорость потока буфера контролируется насосом прямого вытеснения и обычно поддерживается постоянной, в то время как состав буфера можно изменять, извлекая жидкости в различных пропорциях из двух или более внешних резервуаров. Неподвижная фаза представляет собой смолу, состоящую из шариков, обычно из сшитой агарозы , упакованных в цилиндрическую стеклянную или пластиковую колонку. Смолы FPLC доступны в широком диапазоне размеров шариков и поверхностных лигандов в зависимости от области применения.
Противоточная хроматография (CCC) — это тип жидкостно-жидкостной хроматографии, в которой как неподвижная, так и подвижная фазы являются жидкостями, а жидкая неподвижная фаза удерживается в неподвижном состоянии под действием сильной центробежной силы. [43]
Принцип работы прибора CCC требует наличия колонки, состоящей из открытой трубки, намотанной на бобину. Бобина вращается в двухосном гирационном движении (кардиоида), что заставляет переменное гравитационное (G) поле действовать на колонку во время каждого вращения. Это движение заставляет колонку видеть один шаг разделения за оборот, и компоненты образца разделяются в колонке из-за их коэффициента разделения между двумя используемыми несмешивающимися жидкими фазами. На сегодняшний день доступно много типов CCC. К ним относятся HSCCC (High Speed CCC) и HPCCC (High Performance CCC). HPCCC является последней и наиболее производительной версией приборов, доступных в настоящее время.
В приборе CPC (центробежная распределительная хроматография или гидростатическая противоточная хроматография) колонка состоит из ряда ячеек, соединенных между собой каналами, прикрепленными к ротору. Этот ротор вращается вокруг своей центральной оси, создавая центробежное поле, необходимое для удержания неподвижной фазы на месте. Процесс разделения в CPC регулируется исключительно разделением растворенных веществ между неподвижной и подвижной фазами, механизм которого можно легко описать с помощью коэффициентов распределения ( KD ) растворенных веществ . Приборы CPC коммерчески доступны для лабораторного, пилотного и промышленного разделения с различными размерами колонок объемом от около 10 миллилитров до 10 литров.
В отличие от противоточной хроматографии (см. выше), периодическая противоточная хроматография (PCC) использует твердую неподвижную фазу и только жидкую подвижную фазу. Таким образом, она гораздо больше похожа на обычную аффинную хроматографию , чем на противоточную хроматографию. PCC использует несколько колонок, которые во время фазы загрузки соединены в линию. Этот режим позволяет перегружать первую колонку в этой серии без потери продукта, который уже прорывается через колонку до того, как смола полностью насытится. Прорывной продукт улавливается на последующей колонке(ах). На следующем этапе колонки отсоединяются друг от друга. Первая колонка промывается и элюируется, в то время как другая(ие) колонка(и) все еще загружаются. После того, как (изначально) первая колонка повторно уравновешивается, она снова вводится в поток загрузки, но уже как последняя колонка. Затем процесс продолжается циклически.
Хиральная хроматография подразумевает разделение стереоизомеров . В случае энантиомеров они не имеют никаких химических или физических различий, кроме как являются трехмерными зеркальными отражениями. Чтобы обеспечить хиральное разделение, либо подвижная фаза, либо неподвижная фаза должны быть сделаны хиральными, что даст различное сродство между аналитами. Хиральная хроматография ВЭЖХ-колонки (с хиральной неподвижной фазой) как в нормальной, так и в обращенной фазе имеются в продаже.
Традиционная хроматография неспособна разделять рацемические смеси энантиомеров. Однако в некоторых случаях нерацемические смеси энантиомеров могут быть неожиданно разделены с помощью традиционной жидкостной хроматографии (например, ВЭЖХ без хиральной подвижной фазы или неподвижной фазы). [44] [45]
Водная нормально-фазовая хроматография (ANP) характеризуется поведением элюирования классического нормально-фазового режима (т.е. когда подвижная фаза значительно менее полярна, чем неподвижная фаза), в котором вода является одним из компонентов системы растворителя подвижной фазы. Она отличается от жидкостной хроматографии с гидрофильным взаимодействием (HILIC) тем, что механизм удерживания обусловлен адсорбцией, а не разделением. [46]
Хроматография используется во многих областях, включая фармацевтическую промышленность , пищевую промышленность , химическую промышленность , судебную экспертизу , анализ окружающей среды и больницы . [47]