
Целлюлаза ( EC 3.2.1.4; систематическое название 4-β- D -глюкан-4-глюканогидролаза ) — это один из нескольких ферментов, вырабатываемых в основном грибами , бактериями и простейшими , которые катализируют целлюлолиз , разложение целлюлозы и некоторых родственных ей полисахаридов :
Это название также используется для любой встречающейся в природе смеси или комплекса различных ферментов, которые действуют последовательно или синергически, разлагая целлюлозный материал.
Целлюлазы расщепляют молекулу целлюлозы на моносахариды («простые сахара»), такие как β- глюкоза , или более короткие полисахариды и олигосахариды . Расщепление целлюлозы имеет важное экономическое значение, поскольку оно делает основной компонент растений доступным для потребления и использования в химических реакциях. Конкретная задействованная реакция — гидролиз 1,4 -β- D - гликозидных связей в целлюлозе, гемицеллюлозе , лихенине и β- D -глюканах злаков . Поскольку молекулы целлюлозы прочно связываются друг с другом, целлюлолиз относительно сложен по сравнению с расщеплением других полисахаридов, таких как крахмал. [2]
Большинство млекопитающих обладают лишь очень ограниченной способностью переваривать пищевые волокна, такие как целлюлоза, самостоятельно. У многих травоядных животных, таких как жвачные , такие как крупный рогатый скот и овцы, и ферментеров заднего кишечника , таких как лошади, целлюлазы вырабатываются симбиотическими бактериями. Эндогенные целлюлазы вырабатываются несколькими типами животных , такими как некоторые термиты , улитки, [3] [4] [5] и дождевые черви .
Целлюлазы также были обнаружены в зеленых микроводорослях ( Chlamydomonas reinhardtii , Gonium pectorale и Volvox carteri ), а их каталитические домены (CD), принадлежащие к семейству GH9, демонстрируют самую высокую гомологию последовательностей с эндогенными целлюлазами метазойных организмов. Целлюлазы водорослей являются модульными, состоящими из предполагаемых новых цистеин-богатых углеводсвязывающих модулей (CBM), пролин/серин-(PS) богатых линкеров в дополнение к предполагаемым Ig-подобным и неизвестным доменам у некоторых членов. Целлюлаза из Gonium pectorale состояла из двух CD, разделенных линкерами, и с C-концевым CBM. [6]
Известно несколько различных видов целлюлаз, которые различаются структурно и механически. Синонимы, производные и специфические ферменты, связанные с названием «целлюлаза», включают эндо-1,4-β -D -глюканазу (β-1,4-глюканазу, β-1,4-эндоглюкангидролазу, эндоглюканазу D, 1,4-(1,3;1,4)-β- D -глюкан-4-глюканогидролазу), карбоксиметилцеллюлазу (CMCase), авицелазу, целлюдекстриназу , целлюлазу A, целлюлозин AP , щелочную целлюлазу , целлюлазу A 3 , 9.5 целлюлазу , целлоксиланазу и панцеллазу SS . Ферменты, расщепляющие лигнин , иногда называли целлюлазами, но это старое использование устарело; они являются ферментами, модифицирующими лигнин .
Пять основных типов целлюлаз в зависимости от типа катализируемой реакции:
В пределах вышеперечисленных типов существуют также прогрессивные (также известные как процессивные) и непрогрессивные типы. Прогрессивная целлюлаза будет продолжать взаимодействовать с одной полисахаридной цепью, непрогрессивная целлюлаза будет взаимодействовать один раз, затем отсоединится и вступит в контакт с другой полисахаридной цепью.
Действие целлюлазы считается синергетическим, поскольку все три класса целлюлазы могут дать гораздо больше сахара, чем добавление всех трех по отдельности. За исключением жвачных, большинство животных (включая людей) не вырабатывают целлюлазу в своих организмах и могут лишь частично расщеплять целлюлозу посредством ферментации, что ограничивает их способность использовать энергию в волокнистом растительном материале.
Большинство грибковых целлюлаз имеют двухдоменную структуру с одним каталитическим доменом и одним доменом связывания целлюлозы, которые соединены гибким линкером. Эта структура адаптирована для работы на нерастворимом субстрате и позволяет ферменту двумерно диффундировать на поверхности подобно гусенице. Однако существуют также целлюлазы (в основном эндоглюканазы), у которых отсутствуют домены связывания целлюлозы.
Как связывание субстратов, так и катализ зависят от трехмерной структуры фермента, которая возникает в результате уровня сворачивания белка . Последовательность аминокислот и расположение их остатков, которые встречаются в активном центре, положение, где связывается субстрат, могут влиять на такие факторы, как сродство связывания лигандов, стабилизация субстратов в активном центре и катализ. Структура субстрата комплементарна точной структуре активного центра фермента. Изменения в положении остатков могут привести к искажению одного или нескольких из этих взаимодействий. [8] Дополнительные факторы, такие как температура, pH и ионы металлов, влияют на нековалентные взаимодействия между структурой фермента. [9] Вид Thermotoga maritima производит целлюлазы, состоящие из 2 β-слоев (белковых структур), окружающих центральную каталитическую область, которая является активным центром. [10] Фермент классифицируется как эндоглюканаза, которая внутренне расщепляет β-1,4-гликозидные связи в целлюлозных цепях, способствуя дальнейшей деградации полимера. Различные виды в том же семействе, что и T. maritima, производят целлюлазы с различными структурами. [10] Целлюлазы, производимые видом Coprinopsis cinerea, состоят из семи белковых нитей в форме замкнутого туннеля, называемого β/α-бочкой. [11] Эти ферменты гидролизуют субстрат карбоксиметилцеллюлозу. Связывание субстрата в активном центре вызывает изменение конформации, что позволяет деградировать молекулу.
У многих бактерий целлюлазы in vivo представляют собой сложные ферментные структуры, организованные в супрамолекулярные комплексы , целлюлосомы . Они могут содержать, но не ограничиваются, пятью различными ферментативными субъединицами, представляющими, а именно, эндоцеллюлазы, экзоцеллюлазы, целлобиазы, окислительные целлюлазы и целлюлозофосфорилазы, где только экзоцеллюлазы и целлобиазы участвуют в фактическом гидролизе связи β(1→4). Количество субъединиц, составляющих целлюлосомы, также может определять скорость ферментативной активности. [12]
Многодоменные целлюлазы широко распространены среди многих таксономических групп, однако целлюлазы из анаэробных бактерий, обнаруженные в целлюлосомах, имеют наиболее сложную архитектуру, состоящую из различных типов модулей. Например, Clostridium cellulolyticum производит 13 модульных целлюлаз GH9, содержащих различное количество и расположение каталитического домена (CD), углеводсвязывающего модуля (CBM), докерина, линкера и Ig-подобного домена. [13]
Например, комплекс целлюлазы из Trichoderma reesei включает компонент, обозначенный как C1 (57 000 дальтон ), который разделяет цепи кристаллической целлюлозы, эндоглюканазу (около 52 000 дальтон), экзоглюканазу (около 61 000 дальтон) и β-глюкозидазу (76 000 дальтон). [14]
В геномах бактерий, которые производят целлюлосомы, были идентифицированы многочисленные «сигнатурные» последовательности, известные как докерины и когезины . В зависимости от аминокислотной последовательности и третичной структуры целлюлазы делятся на кланы и семейства. [15]
Многомодульные целлюлазы более эффективны, чем свободный фермент (только с CD) из-за синергизма, возникающего из-за близкого расположения фермента и целлюлозного субстрата. CBM участвуют в связывании целлюлозы, тогда как гликозилированные линкеры обеспечивают гибкость CD для более высокой активности и защиты протеазы, а также повышенного связывания с поверхностью целлюлозы. [6]


Целлюлаза используется для коммерческой обработки пищевых продуктов в кофе . Она выполняет гидролиз целлюлозы во время сушки бобов . Кроме того, целлюлазы широко используются в текстильной промышленности и в стиральных порошках. Они также использовались в целлюлозно-бумажной промышленности для различных целей, и они даже используются в фармацевтических целях. Целлюлаза используется при ферментации биомассы в биотопливо , хотя этот процесс в настоящее время является относительно экспериментальным.
Целлюлазы имеют широкий спектр применения в бумажной и целлюлозной промышленности. В процессах производства и переработки целлюлазы могут применяться для улучшения окорки , варки , отбеливания , дренажа или удаления краски . [17]
Использование целлюлазы также может улучшить качество бумаги. Целлюлазы влияют на морфологию волокон, что может привести к улучшению связи между волокнами, что приводит к повышению сцепления волокон. [18] Дополнительные эффекты на бумаге могут включать повышенную прочность на разрыв, большую пухлость, пористость и мягкость ткани.
Целлюлаза используется в медицине для лечения фитобезоаров, формы целлюлозного безоара, обнаруженного в желудке человека , и она продемонстрировала эффективность в разрушении полимикробных бактериальных биопленок путем гидролиза β(1-4) гликозидных связей в структурных матричных экзополисахаридах внеклеточного полимерного вещества (ЭПС). [19] [20]
Различные варианты использования целлюлаз в текстильной промышленности включают биостоунирование джинсов, полировку текстильных волокон, смягчение одежды, удаление излишков красителя или восстановление яркости цвета.
Целлюлазы могут использоваться в сельскохозяйственном секторе в качестве фитопатогена и для борьбы с болезнями. Они также применяются для улучшения прорастания семян и улучшения корневой системы, и могут привести к улучшению качества почвы и снять зависимость от минеральных удобрений. [18]
Поскольку нативный субстрат, целлюлоза , является водонерастворимым полимером, традиционные анализы восстанавливающих сахаров с использованием этого субстрата не могут быть использованы для измерения активности целлюлазы. Аналитики разработали ряд альтернативных методов.
Вискозиметр можно использовать для измерения снижения вязкости раствора, содержащего водорастворимое производное целлюлозы, такое как карбоксиметилцеллюлоза, при инкубации с образцом целлюлазы. [22] Снижение вязкости прямо пропорционально активности целлюлазы. Хотя такие анализы очень чувствительны и специфичны для эндоцеллюлазы ( экзодействующие ферменты целлюлазы производят небольшое или не производят никакого изменения вязкости), они ограничены тем фактом, что трудно определить активность в обычных единицах фермента (микромоль гидролизованного субстрата или продукта, произведенного в минуту).
Целлоолигосахариды с более низкой DP (DP2-6) достаточно растворимы в воде, чтобы действовать как жизнеспособные субстраты для ферментов целлюлазы. [23] Однако, поскольку эти субстраты сами по себе являются « восстанавливающими сахарами », они не подходят для использования в традиционных анализах на восстанавливающие сахара, поскольку они генерируют высокое «холостое» значение. Однако их гидролиз, опосредованный целлюлазой, можно контролировать с помощью методов ВЭЖХ или ИХ, чтобы получить ценную информацию о потребностях субстрата конкретного фермента целлюлазы.
Целлоолигосахариды могут быть химически восстановлены посредством действия борогидрида натрия для получения соответствующих им сахарных спиртов . Эти соединения не реагируют в анализах на восстановление сахара, но продукты их гидролиза реагируют. Это делает восстановленные борогидридом целлоолигосахариды ценными субстратами для анализа целлюлазы с использованием традиционных анализов на восстановление сахара, таких как метод Нельсона-Симоджи. [24] [25]
[26]
Эти субстраты можно разделить на два класса:
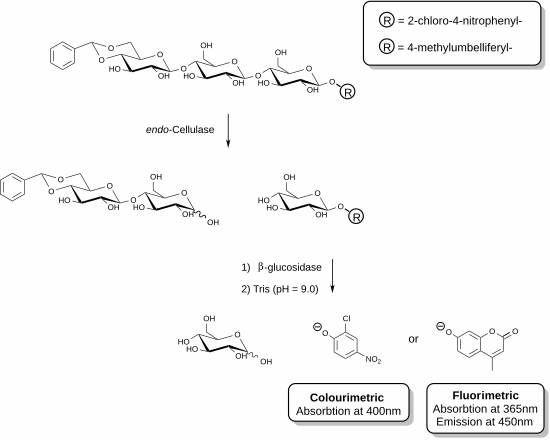
Были разработаны новые реагенты, которые позволяют проводить специфическое измерение эндоцеллюлазы . [27] [28] Эти методы включают использование функционализированных олигосахаридных субстратов в присутствии вспомогательного фермента. В показанном примере фермент целлюлаза способен распознавать трисахаридный фрагмент целлюлозы и расщеплять эту единицу. Вспомогательный фермент, присутствующий в смеси реагентов (β-глюкозидаза), затем действует, гидролизуя фрагмент, содержащий хромофор или флуорофор. Анализ завершается добавлением основного раствора, который останавливает ферментативную реакцию и депротонирует освобожденное фенольное соединение, образуя фенолятные виды. Активность целлюлазы данного образца прямо пропорциональна количеству освобожденного фенолята, которое можно измерить с помощью спектрофотометра. Функционализация ацеталя на невосстанавливающем конце трисахаридного субстрата предотвращает действие вспомогательной β-глюкозидазы на исходный субстрат.