Внеклеточные полимерные вещества ( ЭПС ) — это природные полимеры с высокой молекулярной массой , выделяемые микроорганизмами в окружающую среду. [1] ЭПС обеспечивают функциональную и структурную целостность биопленок и считаются фундаментальным компонентом, определяющим физико-химические свойства биопленки. [2] ЭПС в матрице биопленок обеспечивает композиционную поддержку и защиту микробных сообществ от суровых условий окружающей среды. [3] Компоненты ЭПС могут представлять собой полисахариды разных классов, липиды, нуклеиновые кислоты, белки, липополисахариды и минералы.
ЭПС в основном состоят из полисахаридов (экзополисахаридов) и белков , но включают и другие макромолекулы , такие как ДНК , липиды и гуминовые вещества. ЭПС являются строительным материалом бактериальных поселений и либо остаются прикрепленными к внешней поверхности клетки, либо секретируются в ее питательную среду . Эти соединения играют важную роль в формировании биопленок и прикреплении клеток к поверхностям. ЭПС составляют от 50% до 90% общего органического вещества биопленки . [2] [4] [5]
Экзополисахариды (также иногда сокращенно ЭПС ; далее сахара ЭПС ) представляют собой части ЭПС на основе сахара. Микроорганизмы синтезируют широкий спектр многофункциональных полисахаридов, включая внутриклеточные полисахариды, структурные полисахариды и внеклеточные полисахариды или экзополисахариды. Экзополисахариды обычно состоят из моносахаридов и некоторых неуглеводных заместителей (таких как ацетат , пируват , сукцинат и фосфат ). Благодаря большому разнообразию состава экзополисахариды нашли разнообразное применение в различных отраслях пищевой и фармацевтической промышленности. Многие микробные EPS-сахара обладают свойствами, которые почти идентичны свойствам используемых в настоящее время жевательных резинок . Благодаря инновационным подходам предпринимаются усилия по замене традиционно используемых растительных и водорослевых смол их микробными аналогами. Более того, значительный прогресс был достигнут в открытии и разработке новых микробных EPS-сахаров, которые имеют новые промышленные применения. [6] Сообщалось, что леван, продуцируемый Pantoea agglomerans ZMR7, снижает жизнеспособность клеток рабдомиосаркомы (RD) и рака молочной железы (MDA) по сравнению с необработанными раковыми клетками . Кроме того, он обладает высокой противопаразитарной активностью в отношении промастиготы Leishmania tropica . [7] В 1960-х и 1970-х годах исследовалось наличие экзополисахаридов в матриксе бляшек, связанных с кариесом. [8] В области палеомикробиологии зубные биопленки и их компоненты ЭПС предоставляют ученым информацию о составе древних микробов и биомолекул хозяина, а также о рационе хозяина. [9]
Минералы, являющиеся результатом процессов биоминерализации , регулируемых окружающей средой или бактериями, также являются важными компонентами ЭПС. Они обеспечивают структурную целостность матрицы биопленки и действуют как каркас для защиты бактериальных клеток от сил сдвига и антимикробных химикатов. [10] Было обнаружено, что минералы в ЭПС способствуют морфогенезу бактерий и структурной целостности матрикса. Например, в биопленках Bacillus subtilis , Mycobacterium smegmatis и Pseudomonas aeruginosa кальцит ( CaCO 3 ) способствует целостности матрикса. Минералы также связаны с заболеваниями. В биопленках Proteus mirabilis , Proteus vulgaris и Providencia rettgeri минералы кальций и магний вызывают отложение катетера. [11]

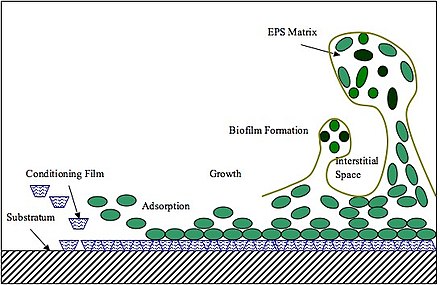
Первым шагом в формировании биопленок является адгезия. Первоначальная адгезия бактерий к поверхностям включает взаимодействие адгезин-рецептор. Определенные полисахариды, липиды и белки матрикса действуют как адгезивные агенты. ЭПС также способствует межклеточному сплочению (включая межвидовое распознавание), способствуя агрегации микробов и образованию биопленок. [12] В общем, матрица на основе EPS опосредует сборку биопленки следующим образом. Во-первых, образование ЭПС происходит в месте адгезии, он будет либо вырабатываться на бактериальных поверхностях, либо секретироваться на поверхности прикрепления и образовывать исходный полимерный матрикс, способствующий колонизации микроорганизмов и кластеризации клеток. Затем непрерывное производство EPS еще больше расширяет матрицу в трех измерениях, образуя при этом ядро бактериальных клеток. Бактериальное ядро обеспечивает опорную основу и способствует развитию трехмерных кластеров и агрегации микроколоний. [13] Исследования P. aeruginosa , B. subtilis , V. cholerae и S. mutans показали, что переход от первоначальной кластеризации клеток к микроколониям, по-видимому, консервативен среди различных модельных организмов, образующих биопленки. [13] Например, S. mutans вырабатывает экзоферменты, называемые глюкозилтрансферазами (Gtfs), которые синтезируют глюканы in situ, используя в качестве субстратов сахара рациона хозяина. Gtfs даже связываются с бактериями, которые не синтезируют Gtfs, и, следовательно, способствуют межвидовой и межцарственной коадгезии. [14]
Впоследствии, по мере формирования биопленки, EPS обеспечивает физическую стабильность и устойчивость к механическому удалению, противомикробным препаратам и иммунитету хозяина. Экзополисахариды и ДНК окружающей среды (эДНК) способствуют вязкоэластичности зрелых биопленок, поэтому отделение биопленки от субстрата будет затруднено даже при длительном сдвиговом напряжении жидкости или высоком механическом давлении. [15] Помимо механической устойчивости, EPS также способствует защите от противомикробных препаратов и повышению толерантности к лекарствам. [16] Противомикробные препараты не могут диффундировать через барьер ЭПС, что приводит к ограничению доступа лекарств в более глубокие слои биопленки. [17] Более того, положительно заряженные агенты будут связываться с отрицательно заряженными ЭПС, способствуя толерантности биопленок к противомикробным препаратам и обеспечивая инактивацию или деградацию противомикробных препаратов ферментами, присутствующими в матриксе биопленки. ЭПС также функционирует как локальный резервуар питательных веществ для различных биомолекул, таких как ферментируемые полисахариды. [18] Исследование V. cholerae , проведенное в 2017 году, показало, что из-за разницы осмотического давления в биопленках V. cholerae колонии микробов физически набухают, что максимизирует их контакт с питательными поверхностями и, следовательно, поглощение питательных веществ. [19]
ЭПС обнаруживается в матриксе других микробных биопленок, таких как биопленки микроводорослей . Формирование биопленки и структура ЭПС во многом схожи с бактериальными. Формирование биопленки начинается с обратимого поглощения плавающих клеток на поверхность. После производства EPS адсорбция станет необратимой. EPS будет колонизировать клетки на поверхности с помощью водородных связей. Размножению ранних колонизаторов будет способствовать присутствие органических молекул в матриксе, которые будут обеспечивать питательными веществами клетки водорослей. По мере размножения колонизаторов биопленка растет и приобретает трехмерную структуру. [20] Биопленки микроводорослей состоят на 90% из ЭПС и на 10% из клеток водорослей. Водорослевые ЭПС имеют компоненты, аналогичные бактериальному; он состоит из белков, фосфолипидов, полисахаридов, нуклеиновых кислот, гуминовых веществ, уроновых кислот и некоторых функциональных групп, таких как фосфорные, карбоксильные, гидроксильные и аминогруппы. Клетки водорослей потребляют ЭПС в качестве источника энергии и углерода. [21] Кроме того, EPS защищает их от обезвоживания и усиливает адгезию клеток к поверхности. В биопленках водорослей ЭПС имеет две подкатегории; растворимый ЭПС (сЭПС) и связанный ЭПС (бЭПС), причем первый распределяется в среде, а второй прикрепляется к клеткам водорослей. [22] Ограниченную ЭПС можно разделить на жестко связанную ЭПС (TB-EPS) и слабо ограниченную ЭПС (LB-EPS). На состав EPS влияют несколько факторов, включая виды, тип субстрата, доступность питательных веществ, температуру, pH и интенсивность света. [23]
Капсульные экзополисахариды могут защищать патогенные бактерии от высыхания и нападения хищников и способствовать их патогенности . [24] Сидячие бактерии, зафиксированные и агрегированные в биопленках , менее уязвимы по сравнению с дрейфующими планктонными бактериями, поскольку матрица EPS способна действовать как защитный диффузионный барьер. [25] На физические и химические характеристики бактериальных клеток может влиять состав ЭПС, влияющий на такие факторы, как клеточное распознавание, агрегация и адгезия в их естественной среде. [25] Кроме того, слой EPS действует как ловушка для питательных веществ, способствуя росту бактерий . [25] Экзополисахариды некоторых штаммов молочнокислых бактерий , например, Lactococcus Lactis subsp. cremoris придают желеобразную текстуру кисломолочным продуктам (например, Viili ), и эти полисахариды также легко усваиваются. [26] [27] Примером промышленного использования экзополисахаридов является применение декстрана в панеттоне и других видах хлеба в хлебопекарной промышленности. [28]
Помимо отрицательного вклада ЭПС в биопленки, ЭПС также может выполнять некоторые полезные функции. Например, B. subtilis привлек внимание своими пробиотическими свойствами благодаря своей биопленке, которая позволяет ей эффективно поддерживать благоприятную микросреду в желудочно-кишечном тракте. Чтобы выжить при прохождении через верхние отделы желудочно-кишечного тракта, B. subtilis вырабатывает внеклеточный матрикс, который защищает его от стрессовых сред, таких как очень кислая среда в желудке. [29] Было показано, что у B. subtilis компонент белкового матрикса TasA и экзополисахарид необходимы для эффективной колонизации корней растений арабидопсиса и томата. [16] Было также высказано предположение, что TasA играет важную роль в обеспечении межвидовой агрегации стрептококков. [30]
Экзополисахариды могут способствовать прикреплению азотфиксирующих бактерий к корням растений и частицам почвы, что обеспечивает симбиотические отношения. [24] Это важно для колонизации корней и ризосферы , которая является ключевым компонентом почвенных пищевых сетей и круговорота питательных веществ в экосистемах . Это также позволяет успешно инвазировать и заразить растение -хозяин . [24] Бактериальные внеклеточные полимерные вещества могут способствовать биоремедиации тяжелых металлов, поскольку они обладают способностью адсорбировать катионы металлов, среди других растворенных веществ. [31] Это может быть полезно при очистке систем сточных вод , поскольку биопленки способны связывать и удалять такие металлы, как медь , свинец , никель и кадмий . [31] Сродство связывания и металлоспецифичность EPS варьируются в зависимости от состава полимера, а также от таких факторов, как концентрация и pH . [31] В геомикробиологическом контексте было замечено, что EPS влияют на осаждение минералов, особенно карбонатов . [32] EPS также может связываться и улавливать частицы в суспензиях биопленок, что может ограничивать дисперсию и круговорот элементов. [32] Стабильность отложений можно повысить с помощью пенополистирола, поскольку он влияет на сцепление , проницаемость и эрозию осадка. [32] Имеются данные о том, что адгезия и металлосвязывающая способность пенополистирола влияют на скорость выщелачивания минералов как в экологическом, так и в промышленном контексте. [32] Эти взаимодействия между ЭПС и абиотической средой позволяют ЭПС оказывать большое влияние на биогеохимический цикл . Взаимодействия хищник-жертва между биопленками и бактериоядными животными , такими как почвенная нематода Caenorhabditis elegans , были тщательно изучены. Биопленки Yersinia pestis, образуя липкий матрикс и образуя агрегаты, могут препятствовать питанию, закупоривая ротовую полость C. elegans . [33]Более того, биопленки Pseudomonas aeruginosa могут препятствовать скользящей подвижности C. elegans , называемой « фенотипом трясины », что приводит к захвату C. elegans внутри биопленок и препятствует исследованию нематодами, питающимися чувствительными биопленками. [34] Это значительно снизило способность хищника питаться и размножаться, тем самым способствуя выживанию биопленок.
В связи с растущей потребностью найти более эффективную и экологически чистую альтернативу традиционным методам удаления отходов, промышленность уделяет больше внимания функциям бактерий и их EPS-сахаров в биоремедиации . [35]
Исследователи обнаружили, что добавление EPS-сахаров из цианобактерий в сточные воды удаляет тяжелые металлы, такие как медь , кадмий и свинец . [35] Сами по себе сахара ЭПС могут физически взаимодействовать с этими тяжелыми металлами и поглощать их посредством биосорбции . [35] Эффективность удаления можно оптимизировать, обрабатывая EPS-сахары различными кислотами или основаниями перед добавлением их в сточные воды. [35] Некоторые загрязненные почвы содержат высокие уровни полициклических ароматических углеводородов (ПАУ); ЭПС бактерии Zoogloea sp . и гриб Aspergillus niger эффективно удаляют эти токсичные соединения. [36] ЭПС содержат такие ферменты , как оксидоредуктаза и гидролаза , которые способны расщеплять ПАУ. [36] Степень разложения ПАУ зависит от концентрации EPS, добавленного в почву. Этот метод оказался недорогим и высокоэффективным. [36]
В последние годы было обнаружено, что сахара EPS из морских бактерий ускоряют очистку разливов нефти. [37] Во время разлива нефти на платформе Deepwater Horizon в 2010 году эти бактерии, производящие EPS, смогли быстро расти и размножаться. [37] Позже было обнаружено, что их EPS-сахар растворяет нефть и образует масляные агрегаты на поверхности океана, что ускорило процесс очистки. [37] Эти скопления нефти также служили ценным источником питательных веществ для других морских микробных сообществ. Это позволило ученым модифицировать и оптимизировать использование EPS-сахаров для очистки разливов нефти . [37]
Применение наночастиц (НЧ) является одним из новых многообещающих методов воздействия на биопленки благодаря их высокому соотношению площади поверхности к объему, их способности проникать в более глубокие слои биопленок и способности контролируемо высвобождать противомикробные агенты. . Изучение взаимодействий NP-EPS может обеспечить более глубокое понимание того, как разрабатывать более эффективные наночастицы. [3] Для нарушения ЭПС и жизнеспособности или метаболизма были разработаны наноносители «умного высвобождения», которые могут проникать в биопленки и запускаться патогенным микроокружением для доставки лекарств или многофункциональных соединений, таких как каталитические наночастицы к аптамерам, дендримерам и биоактивным пептидам. активность внедренных бактерий. Некоторые факторы, которые могут изменить потенциал НЧ по транспортировке антимикробных агентов в биопленку, включают физико-химические взаимодействия НЧ с компонентами ЭПС, характеристики водных пространств (пор) внутри матрицы ЭПС и вязкость матрицы ЭПС. [38] Размер и поверхностные свойства (заряд и функциональные группы) НЧ являются основными факторами, определяющими проникновение и взаимодействие с ЭПС. [3] Другой потенциальной стратегией борьбы с биопленками является фаговая терапия. Было высказано предположение, что бактериофаги, вирусы, проникающие в определенные бактериальные клетки-хозяева, являются эффективными агентами проникновения в биопленки. [11] Чтобы достичь максимальной эффективности в уничтожении биопленок, терапевтические стратегии должны быть направлены как на компоненты матрикса биопленки, так и на внедренные микроорганизмы, воздействуя на сложное микроокружение биопленки. [11]