
Эмбриогенез дрозофилы , процесс, посредством которого формируются эмбрионы дрозофилы (плодовой мушки), является любимой модельной системой для генетики и биологии развития . Изучение ее эмбриогенеза раскрыло вековую загадку того, как контролировалось развитие, создав область эволюционной биологии развития . [1] Небольшой размер, короткое время генерации и большой размер выводка делают ее идеальной для генетических исследований. Прозрачные эмбрионы облегчают исследования развития. Drosophila melanogaster была введена в область генетических экспериментов Томасом Хантом Морганом в 1909 году.
Дрозофилы демонстрируют голометаболический метод развития, что означает, что у них есть три различных стадии их постэмбрионального жизненного цикла, каждая с радикально отличающимся планом тела: личинка, куколка и, наконец, взрослая особь. Механизм, необходимый для функционирования и плавного перехода между этими тремя фазами, развивается во время эмбриогенеза . Во время эмбриогенеза личиночная стадия мухи будет развиваться и вылупляться на стадии своей жизни, известной как первая личиночная стадия. Клетки, которые будут производить взрослые структуры, откладываются в имагинальных дисках . Во время стадии куколки личиночное тело распадается, поскольку имагинальные диски растут и производят взрослое тело. Этот процесс называется полным метаморфозом . Примерно через 24 часа после оплодотворения из яйца вылупляется личинка, которая претерпевает три линьки, занимающие около 5,5–6 дней, после чего она называется куколкой. Куколка метаморфозирует во взрослую муху, что занимает около 3,5–4,5 дней. Весь процесс роста от яйца до взрослой мухи занимает приблизительно 10–12 дней при температуре 25 °C. [2]
Мать-муха производит ооциты , которые уже имеют передне-заднюю и дорсо-вентральную оси, определяемые материнской активностью.
Эмбриогенез у Drosophila уникален среди модельных организмов тем, что дробление происходит в многоядерном синцитии (строго ценоците ). На раннем этапе 256 ядер мигрируют к периметру яйца, создавая синцитиальную бластодерму. Зародышевая линия отделяется от соматических клеток посредством образования полярных клеток на заднем конце эмбриона. После тринадцати митотических делений и примерно через 4 часа после оплодотворения в неразделенной цитоплазме ооцита накапливается около 6000 ядер, прежде чем они мигрируют на поверхность и охватываются плазматическими мембранами, образуя клетки, окружающие желточный мешок, образуя клеточную бластодерму.
Как и у других трехслойных метазоа , гаструляция приводит к образованию трех зародышевых листков : энтодермы , мезодермы и эктодермы . Мезодерма инвагинирует из вентральной борозды (VF), как и эктодерма, которая даст начало средней кишке. Полюсные клетки интернализуются другим путем.
Удлинение зародышевой полосы включает в себя множество перестроек клеток и появление четких различий в клетках трех зародышевых полос и различных областей эмбриона. Задняя область (включая заднюю кишку) расширяется и простирается к переднему полюсу вдоль дорсальной стороны эмбриона. В это время становятся видны сегменты эмбриона, создавая полосатое расположение вдоль передне-задней оси. Самые ранние признаки сегментации появляются на этой фазе с образованием парасегментарных борозд . В это же время формируются трахеальные ямки, первые признаки структур для дыхания.
Ретракция зародышевой полосы возвращает заднюю кишку на дорсальную сторону заднего полюса и совпадает с явной сегментацией . Остальные стадии включают интернализацию нервной системы (эктодермы) и формирование внутренних органов (в основном мезодермы).

Одним из наиболее понятных примеров формирования узора является формирование узора вдоль будущей оси голова-хвост (переднезадней) плодовой мушки Drosophila melanogaster . Существует три основных типа генов, которые дают начало структуре развития мухи: гены материнского эффекта, гены сегментации и гомеозисные гены. Развитие Drosophila особенно хорошо изучено, и оно является репрезентативным для крупного класса животных, насекомых или инсекта . Другие многоклеточные организмы иногда используют похожие механизмы для формирования оси, хотя относительная важность передачи сигнала между самыми ранними клетками многих развивающихся организмов больше, чем в примере, описанном здесь.


Строительные блоки паттерна передне-задней оси у Drosophila закладываются во время формирования яйца ( оогенеза ), задолго до того, как яйцо оплодотворяется и откладывается. Гены материнского эффекта отвечают за полярность яйца и эмбриона. Развивающееся яйцо ( ооцит ) поляризуется дифференциально локализованными молекулами мРНК .
Гены, которые кодируют эти мРНК, называемые генами материнского эффекта , кодируют белки, которые транслируются при оплодотворении для установления градиентов концентрации, охватывающих яйцо. Bicoid и Hunchback — это гены материнского эффекта, которые наиболее важны для формирования передних частей (головы и груди) эмбриона дрозофилы . Nanos и Caudal — это гены материнского эффекта, которые важны для формирования более задних брюшных сегментов эмбриона дрозофилы . [4] [5]
У эмбрионов от матерей-мутантов с бикоидным типом развития структура головы и грудной клетки преобразуется в структуру брюшной полости, что делает эмбрион с задними структурами на обоих концах — летальным фенотипом. [4]
Цитоскелетные элементы, такие как микротрубочки , поляризованы внутри ооцита и могут использоваться для локализации молекул мРНК в определенных частях клетки. Синтезированные матерью бикоидные мРНК прикрепляются к микротрубочкам и концентрируются на передних концах формирующихся яиц дрозофилы . В неоплодотворенных яйцах транскрипты все еще строго локализованы на кончике, но сразу после оплодотворения небольшой градиент мРНК формируется в передних 20% яиц. В другом отчете документируется градиент мРНК до 40%. нанос -мРНК также прикрепляется к цитоскелету яйца дрозофилы , но концентрируется на заднем конце яйца. горбатые и каудальные мРНК не имеют специальных систем контроля местоположения и довольно равномерно распределены по всей внутренней части яйцеклеток.
Было показано, что белок STAUFEN ( STAU1 ), связывающий dsRNA, отвечает за направление bicoid, nanos и других белков, которые играют роль в формировании передне-задней оси, в правильные области эмбриона для создания градиентов. Когда мРНК из генов материнского эффекта транслируются в белки, на переднем конце яйца образуется градиент белка Bicoid. Белок Nanos образует градиент на заднем конце. Белок Bicoid блокирует трансляцию каудальной мРНК, поэтому белок Caudal имеет более низкую концентрацию в передней части эмбриона и более высокую концентрацию в задней части эмбриона. Это противоположно направлению белка Bicoid. Каудальный белок затем активируется позже, чтобы включить гены для формирования задних структур во время фазы сегментации. Белок Nanos создает наклон сзади-вперед и является морфогеном, который помогает в формировании брюшной полости. Белок Nanos в комплексе с белком Pumilio связывается с мРНК Hunchback и блокирует ее трансляцию в заднем конце эмбрионов Drosophila .
Белки Bicoid, Hunchback и Caudal являются факторами транскрипции . Белок Bicoid также является морфогеном. Белок Nanos является белком-репрессором трансляции. Bicoid имеет ДНК-связывающий гомеодомен , который связывает как ДНК, так и мРНК nanos . Bicoid связывает определенную последовательность РНК в 3′ нетранслируемой области , называемой регуляторным элементом Bicoid 3′-UTR , мРНК каудального типа и блокирует трансляцию.
Уровни белка Hunchback в раннем эмбрионе значительно увеличиваются за счет транскрипции нового гена Hunchback и трансляции полученной зиготически продуцируемой мРНК. Во время раннего эмбриогенеза Drosophila происходят ядерные деления без клеточного деления. Множество образующихся ядер распределяются по периферии цитоплазмы клетки . Экспрессия генов в этих ядрах регулируется белками Bicoid, Hunchback и Caudal. Например, Bicoid действует как транскрипционный активатор транскрипции гена Hunchback . Для продолжения развития Hunchback необходим в области, количество которой уменьшается от переднего к заднему концу. Это создается белком Nanos, существование которого находится на нисходящем наклоне от заднего к переднему концу.
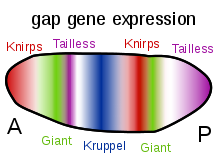
Другая важная функция градиентов белков Bicoid, Hunchback и Caudal заключается в регуляции транскрипции других зиготически экспрессируемых белков. Многие из них являются белковыми продуктами, полученными из членов семейства генов контроля развития "gap". giant , huckebein , hunchback , knirps , Krüppel и tailless — все это гены gap . Их паттерны экспрессии в раннем эмбрионе определяются продуктами генов материнского эффекта и показаны на диаграммах в правой части этой страницы. Гены gap являются частью более крупного семейства, называемого генами сегментации . Эти гены устанавливают сегментированный план тела эмбриона вдоль передне-задней оси. Гены сегментации определяют 14 парасегментов , которые тесно связаны с конечными анатомическими сегментами. Гены gap являются первым слоем иерархического каскада генов контроля сегментации.

Два дополнительных класса генов сегментации экспрессируются после продуктов гена gap. Гены парного правила экспрессируются в полосатых узорах из семи полос, перпендикулярных передне-задней оси. Эти узоры экспрессии устанавливаются внутри синцитиальной бластодермы. После этих начальных событий паттернирования вокруг ядер синцитиальной бластодермы формируются клеточные мембраны, превращая ее в клеточную бластодерму.
Паттерны экспрессии последнего класса генов сегментации, генов полярности сегмента , затем тонко настраиваются посредством взаимодействий между клетками соседних парасегментов с такими генами, как engrailed . Белок Engrailed является фактором транскрипции, который экспрессируется в одном ряду клеток на краю каждого парасегмента. Этот паттерн экспрессии инициируется генами правила пар (например, even-skipped ), которые кодируют факторы транскрипции, регулирующие транскрипцию гена engrailed в синцитиальной бластодерме.
Клетки, которые производят Engrailed, могут производить белок межклеточного сигнала Hedgehog . Движение Hedgehog ограничено его липидной модификацией, поэтому Hedgehog активирует тонкую полоску клеток спереди от клеток, экспрессирующих Engrailed. Только клетки по одну сторону от клеток, экспрессирующих Engrailed, способны реагировать на Hedgehog, поскольку они экспрессируют рецепторный белок Patched . Клетки с активированным рецептором Patched производят белок Wingless . Wingless — это секретируемый белок, который действует на соседние ряды клеток, активируя свой рецептор клеточной поверхности Frizzled .
Wingless действует на экспрессирующие Engrailed клетки, чтобы стабилизировать экспрессию Engrailed после формирования клеточной бластодермы. Белок кутикулы Naked индуцируется Wingless, чтобы ограничить количество рядов клеток, экспрессирующих Engrailed. Короткодействующая, взаимная сигнализация Hedgehog и Wingless, контролируемая белками Patched и Naked, стабилизирует границу между каждым сегментом. Белок Wingless называется «wingless» из-за фенотипа некоторых мутантов wingless . Wingless и Hedgehog также функционируют во многих тканях на поздних стадиях эмбриогенеза, а также во время метаморфоза .
Факторы транскрипции, которые кодируются генами сегментации, регулируют еще одно семейство генов контроля развития, гомеотические селекторные гены . Эти гены существуют в двух упорядоченных группах на хромосоме Drosophila 3. Порядок генов на хромосоме отражает порядок, в котором они экспрессируются вдоль передне-задней оси развивающегося эмбриона. Группа Antennapedia гомеотических селекторных генов включает labial , antennapedia , sex combs reduced , deformed и proboscipedia . Белки Labial и Deformed экспрессируются в сегментах головы, где они активируют гены, определяющие особенности головы. Sex-combs-reduced и Antennapedia определяют свойства грудных сегментов. Группа bithorax гомеотических селекторных генов контролирует специализации третьего грудного сегмента и брюшных сегментов. Мутации в некоторых гомеотических генах часто могут быть летальными, и цикл жизни заканчивается на этапе эмбриогенеза.
В 1995 году Нобелевская премия по физиологии и медицине была присуждена за исследования, касающиеся генетического контроля раннего эмбрионального развития Кристиане Нюсляйн-Фольхард , Эдварду Б. Льюису и Эрику Вишаусу . Их исследования по генетическому скринингу мутантов эмбрионального паттернирования выявили роль, которую играют в раннем эмбриональном развитии гомеобоксные гены , такие как bicoid . Примером гомеотической мутации является так называемая мутация Antennapedia. У Drosophila антенны и ноги создаются одной и той же базовой «программой», они отличаются только одним фактором транскрипции. Если этот фактор транскрипции поврежден, у мухи вместо антенн на голове вырастают ноги. Смотрите изображения этого мутанта «antennapedia» и других на FlyBase. Другой пример — комплекс bithorax. Если в этом комплексе происходят нелетальные мутации, это может привести к тому, что у мухи будет два набора крыльев вместо одной пары крыльев и одной пары жужжальца, которые помогают балансировать в полете.
Формирование дорсально-вентральной оси зависит от вентральной ядерной концентрации матерински синтезированного фактора транскрипции, называемого Dorsal. Определение дорсальной стороны эмбриона происходит во время оогенеза , когда ядро ооцита перемещается по микротрубочкам от заднего к передне-дорсальному краю ооцита. Ядро экспрессирует белок, называемый Gurken , который секретируется локально и, таким образом, активирует только фолликулярные клетки в дорсальной области, взаимодействуя с рецептором Torpedo. Это ингибирует выработку белка Pipe, и, таким образом, фолликулярные клетки, экспрессирующие Pipe, находятся на вентральной стороне. Pipe активирует каскад внеклеточных протеаз в перивителлиновом пространстве между фолликулярными клетками и яйцеклеткой, что приводит к расщеплению Toll-лиганда Spätzle и активации каскада Toll-сигнализации на вентральной стороне. Дорсальный белок присутствует во всей эмбриональной цитоплазме, но связан с Cactus, что препятствует его транслокации в ядро. Сигнализация Toll приводит к деградации Cactus, что позволяет Dorsal проникнуть в ядра на вентральной стороне бластодермы. [6] В целом, разница в локализации ядра ооцита становится разницей в состоянии сигнализации окружающих фолликулярных клеток, которые затем передают сигнал в полученные ядра бластодермы.
Попав в ядро, Dorsal активирует различные гены в зависимости от своей ядерной концентрации. Этот процесс устанавливает градиент между вентральной и дорсальной стороной эмбриона бластодермы с репрессией или индукцией целевых генов Dorsal, которые регулируются по-разному. На вентральном конце эмбриона ядра бластодермы, подвергшиеся воздействию высоких концентраций дорсального белка, вызывают транскрипцию факторов транскрипции twist и snail, одновременно подавляя zerknüllt и decapentaplegic . Это приводит к образованию мезодермы. В боковых областях эмбриона низкие ядерные концентрации Dorsal приводят к экспрессии rhomboid , который идентифицирует будущую нейроэктодерму. Более дорсально активная сигнализация Dpp подавляет rhomboid , таким образом ограничивая его латеральными ядрами бластодермы. На дорсальной стороне эмбриона ядра бластодермы, где мало или совсем нет ядерного дорсального белка, экспрессируют zerknüllt , tolloid и decapentaplegic (Dpp). Это приводит к спецификации ненейральной эктодермы и позднее на стадии бластулы к anmioserosa. Вентральная активность сигнального белка семейства TGF-β Dpp поддерживается экспрессией секретируемого антагониста Dpp Sog (короткая гаструляция) в нейроэктодерме. Sog связывается с Dpp и предотвращает его диффузию на вентральную сторону эмбриона, а через расщепление Sog Tolloid также обеспечивается заострение градиента Dpp на дорсальной стороне. Ось DV у дрозофилы обусловлена взаимодействием двух градиентов — вентральной концентрации ядерного дорсального и дорсальной концентрации активности Dpp. [6]