Асимметричное гидрирование — это химическая реакция, которая добавляет два атома водорода к молекуле мишени (субстрата) с трехмерной пространственной селективностью . Важно отметить, что эта селективность исходит не от самой целевой молекулы, а от других реагентов или катализаторов, присутствующих в реакции. Это позволяет пространственной информации (то, что химики называют хиральностью ) передаваться от одной молекулы к мишени, образуя продукт в виде одного энантиомера . Хиральная информация чаще всего содержится в катализаторе, и в этом случае информация в одной молекуле катализатора может быть передана многим молекулам субстрата, увеличивая количество присутствующей хиральной информации. Подобные процессы происходят в природе, где хиральная молекула, такая как фермент, может катализировать введение хирального центра с образованием продукта в виде одного энантиомера, такого как аминокислоты , который необходим клетке для функционирования. Имитируя этот процесс, химики могут создавать множество новых синтетических молекул, которые определенным образом взаимодействуют с биологическими системами, что приводит к созданию новых фармацевтических агентов и агрохимикатов . Важность асимметричного гидрирования как в научных кругах, так и в промышленности способствовала тому, что двое его пионеров — Уильям Стэндиш Ноулз и Рёдзи Ноёри — были коллективно удостоены половины Нобелевской премии по химии 2001 года . [1]
В 1956 году было показано, что гетерогенный катализатор из палладия , нанесенный на шелк, осуществляет асимметричное гидрирование. [2] Позже, в 1968 году, группы Уильяма Ноулза и Леопольда Хорнера независимо друг от друга опубликовали примеры асимметричного гидрирования с использованием гомогенных катализаторов . Хотя эти ранние реакции продемонстрировали лишь умеренный избыток энантиомеров , они продемонстрировали осуществимость. К 1972 году был достигнут энантиомерный избыток 90%, и с использованием этой технологии начался первый промышленный синтез лекарства от болезни Паркинсона L-ДОФА . [3] [4]

В области асимметричного гидрирования продолжался ряд заметных достижений. Анри Каган разработал DIOP , легко получаемый C 2 -симметричный дифосфин, который давал высокие значения EE в определенных реакциях. Рёдзи Ноёри представил катализаторы на основе рутения для асимметричных гидрированных полярных субстратов, таких как кетоны и альдегиды. Роберт Х. Крэбтри продемонстрировал способность соединений иридия катализировать реакции асимметричного гидрирования в 1979 году, изобретя катализатор Крэбтри . [5] В начале 1990-х годов введение лигандов P,N несколькими группами независимо затем еще больше расширило сферу применения C 2 -симметричных лигандов, хотя они принципиально не превосходят хиральные лиганды, лишенные вращательной симметрии . [6]
Сегодня асимметричное гидрирование является рутинной методикой в органической химии лабораторных и промышленных масштабов. Важность асимметричного гидрирования была признана Нобелевской премией по химии 2001 года , присужденной Уильяму Стэндишу Ноулзу и Рёдзи Ноёри .
Асимметричное гидрирование осуществляется по обычным механизмам, используемым для других гидрирований. Сюда входят механизмы внутренней сферы, механизмы внешней сферы и механизмы метатезиса σ-связи. [7] Тип механизма, используемого катализатором, во многом зависит от лигандов, используемых в системе, что, в свою очередь, приводит к определенному сродству катализатор-субстрат.
Так называемый внутрисферный механизм предполагает координацию алкена с металлическим центром. [8] Другие характеристики этого механизма включают тенденцию к гомолитическому расщеплению диводорода, когда присутствует больше богатых электронами низковалентных металлов, в то время как бедные электронами металлы с высокой валентностью обычно демонстрируют гетеролитическое расщепление диводорода с помощью основания. [9]
На диаграмме ниже показаны целевые механизмы каталитического гидрирования с комплексами родия , которые представляют собой внутрисферные механизмы. При ненасыщенном механизме образующийся хиральный продукт будет иметь противоположный режим по сравнению с используемым катализатором. В то время как термодинамически выгодный комплекс между катализатором и субстратом не может подвергаться гидрированию, нестабильный, неблагоприятный комплекс быстро подвергается гидрированию. [10] С другой стороны, дигидридный механизм предполагает, что комплекс первоначально гидрируется до дигидридной формы. Это впоследствии позволяет координировать двойную связь на свободной стороне. Благодаря вставке и восстановительному удалению хиральность продукта соответствует хиральности лиганда. [11]
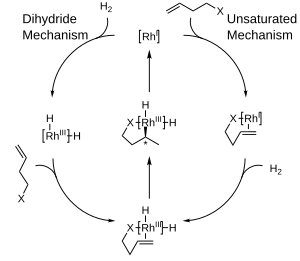
Предпочтение образования одного энантиомера вместо другого в этих реакциях часто объясняют стерическими взаимодействиями между лигандом и прохиральным субстратом. Учет этих взаимодействий привел к разработке квадрантных диаграмм, где «заблокированные» области обозначены заштрихованным прямоугольником, а «открытые» области остаются незаполненными. В смоделированной реакции большие группы на поступающем олефине будут стремиться заполнить открытые области диаграммы, в то время как более мелкие группы будут направлены к заблокированным областям, и тогда доставка водорода будет происходить к задней поверхности олефина, фиксируя стереохимия . Обратите внимание, что для ясности показана только часть хирального фосфинового лиганда.

Некоторые катализаторы действуют по «механизму внешней сферы», так что субстрат никогда не связывается напрямую с металлом, а скорее взаимодействует с его лигандами, которые часто представляют собой гидрид металла и протонный водород на лиганде. Таким образом, в большинстве случаев диводород расщепляется гетеролитически, при этом металл действует как кислота Льюиса, а внешнее или внутреннее основание «депротонирует» гидрид. [7]

В качестве примера этого механизма можно рассмотреть систему БИНАП-Ru-диамин. Дигалогенидная форма катализатора превращается в катализаторы реакцией H 2 в присутствии основания: [12]
Полученные катализаторы имеют три вида лигандов:
Катализаторы «класса Нойори» часто называют бифункциональными катализаторами , чтобы подчеркнуть тот факт, что как металл, так и (аминный) лиганд являются функциональными. [13]
Долгое время предполагалось, что при гидрировании субсостояний, содержащих C=O, механизм действует через шестичленное перициклическое переходное состояние /промежуточное соединение, при котором гидридный центр гидрида рутения ( H Ru-N H ) взаимодействует с карбонильным субстратом R 2 C = O. [14] Более поздние DFT и экспериментальные исследования показали, что эта модель в значительной степени неверна. Вместо этого аминная основная цепь сильно взаимодействует с основным активатором, который часто используется в большом избытке. [12] Однако в обоих случаях подсостояние не связано напрямую с металлическим центром, что делает его отличным примером механизма внешней сферы.
В практике АГ используются катализаторы на основе платиновых металлов. [15] [16] [17]
Железо является популярным объектом исследований для многих каталитических процессов, во многом благодаря его низкой стоимости и низкой токсичности по сравнению с другими переходными металлами. [18] Реализованы методы асимметричного гидрирования с использованием железа, хотя по скорости и селективности они уступают катализаторам на основе драгоценных металлов. [19] В некоторых случаях структурно плохо определенные наночастицы оказались активными частицами in situ , и наблюдаемая умеренная селективность может быть результатом их неконтролируемой геометрии. [20]
Хиральные фосфиновые лиганды, особенно C 2 -симметричные лиганды , являются источником хиральности в большинстве асимметричных катализаторов гидрирования. Из них лиганд BINAP хорошо известен благодаря его использованию в асимметричном гидрировании Нойори, получившему Нобелевскую премию . [3]
Хиральные фосфиновые лиганды обычно можно классифицировать как моно- или бидентатные . Их можно дополнительно классифицировать по расположению стереогенного центра – фосфор и органические заместители. Лиганды с элементом симметрии C 2 были особенно популярны, отчасти потому, что присутствие такого элемента резко снижает возможные конформации связывания субстрата с комплексом металл-лиганд (часто приводя к исключительной энантиоселективности). [21]
Одними из первых в асимметричном гидрировании появились лиганды монофосфинового типа, например лиганд CAMP. [22] Продолжающиеся исследования этих типов лигандов позволили изучить как P -алкильные, так и P -гетероатомные лиганды, при этом P -гетероатомные лиганды, такие как фосфиты и фосфорамидиты , обычно достигают более впечатляющих результатов. [23] Структурные классы лигандов, добившихся успеха, включают те, которые основаны на бинафтильной структуре MonoPHOS [24] или спирокольцевой системе SiPHOS. [25] Примечательно, что эти монодентатные лиганды можно использовать в сочетании друг с другом для достижения синергического улучшения энантиоселективности; [26] то, что невозможно с дифосфиновыми лигандами . [23]
Дифосфиновым лигандам уделяется значительно больше внимания, чем монофосфинам, и, возможно, как следствие, они имеют гораздо более длинный список достижений. Этот класс включает в себя первый лиганд, достигший высокой селективности ( DIOP ), первый лиганд, который будет использоваться в промышленном асимметричном синтезе ( DIPAMP [27] [28] [4] ) и, вероятно, самый известный хиральный лиганд (BINAP). [3] Хиральные дифосфиновые лиганды в настоящее время повсеместно используются при асимметричном гидрировании.

Использование лигандов P,N в асимметричном гидрировании можно отнести к симметричному бисоксазолиновому лиганду C 2 . [29] Однако эти симметричные лиганды вскоре были заменены монооксазолиновыми лигандами , отсутствие симметрии C 2 которых никоим образом не ограничивает их эффективность в асимметричном катализе. [30] Такие лиганды обычно состоят из ахирального азотсодержащего гетероцикла, который функционализирован боковым фосфорсодержащим плечом, хотя как точная природа гетероцикла, так и фосфорный центр химического окружения широко варьируются. Ни одна структура не оказалась последовательно эффективной с широким спектром субстратов, хотя были установлены некоторые привилегированные структуры (например, фосфин-оксазолиновая или PHOX -архитектура). [31] [30] [32] Более того, в пределах узко определенного класса субстратов характеристики металлических комплексов с хиральными лигандами P,N могут близко приближаться к идеальной конверсии и селективности в системах, которые в противном случае очень трудно обнаружить. [33] Некоторые комплексы, полученные из хелатирующих лигандов PO, показали многообещающие результаты в гидрировании α,β-ненасыщенных кетонов и сложных эфиров. [34]
Простые лиганды на основе N -гетероциклического карбена (NHC) оказались непрактичными для асимметричного гидрирования.
Некоторые лиганды C,N объединяют NHC с хиральным оксазолином, образуя хелатирующий лиганд. [35] [36] Лиганды первого типа на основе NHC были созданы в виде больших библиотек в результате реакции более мелких библиотек отдельных NHC и оксазолинов. [35] [36] Катализаторы на основе NHC с объемным семичленным металлоциклом на иридии применялись для каталитического гидрирования нефункционализированных олефинов [35] и винилэфирных спиртов с конверсией и ee в высоких 80-х или 90-х годах. [37] Та же система была применена для синтеза ряда альдольных, [38] вицинальных диметиловых [39] и дезоксиполикетидных [40] мотивов, а также самих дезоксиполикетидов. [41]
C 2 -симметричные NHC оказались весьма полезными лигандами для асимметричного гидрирования. [42]
Субстраты можно классифицировать по их полярности. В неполярных субстратах преобладают алкены . К полярным субстратам относятся кетоны , енамины, кетимины .
[43]
Алкены, которые особенно поддаются асимметричному гидрированию, часто имеют полярную функциональную группу, примыкающую к сайту, подлежащему гидрированию. В отсутствие этой функциональной группы катализ часто приводит к низким значениям ee. Однако для некоторых нефункционализированных олефинов оказался эффективным иридий с лигандами на основе P , N. Алкеновые субстраты часто классифицируют по их заместителям, например, 1,1-дизамещенные, 1,2-диарилтризамещенные, 1,1,2-триалкильные и тетразамещенные олефины. [44] [45] и даже внутри этих классов могут существовать вариации, которые делают разные решения оптимальными. [46]


В отличие от олефинов, асимметричное гидрирование енаминов отдает предпочтение лигандам дифосфинового типа; Отличные результаты были достигнуты как с системами на основе иридия, так и с родием. Однако даже самые лучшие системы часто страдают от низкого ee и недостатка общности. Некоторые енамины ароматических кетонов, производные пирролидина , поддаются асимметричному гидрированию с помощью катионных систем фосфонита родия (I), а также системы I 2 и уксусной кислоты со значениями ee обычно выше 90% и потенциально до 99,9%. [47] Подобная система с использованием иридия (I) и очень близкого ему фосфорамидитного лиганда эффективна для асимметричного гидрирования енаминов пирролидинового типа, где двойная связь находилась внутри кольца: другими словами, дигидропирролов. [48] В обоих случаях энантиоселективность существенно падала, когда размер кольца увеличивался с пяти до шести.

Кетоны и имины являются родственными функциональными группами, и эффективные технологии асимметричного гидрирования каждой из них также тесно связаны. Ранними примерами являются рутений-хиральная дифосфин-диаминовая система Нойори. [49] [50]
Для карбонильных и иминных субстратов координация с конца η 1 может конкурировать с модой η 2 . Для η 1 -связанных субстратов углерод, принимающий водород, удаляется из катализатора и сопротивляется гидрированию. [51]
Системы на основе иридия/P,N-лигандов оказались эффективными для некоторых кетонов и иминов. Например, в последовательной системе для бензилариминов используется лиганд P,N SIPHOX в сочетании с иридием (I) в катионном комплексе для достижения асимметричного гидрирования с ее >90%. [52] Эффективным катализатором для кетонов ( число оборотов (TON) до 4 550 000 и ee до 99,9%) является система иридия (I) с близкородственным тридентатным лигандом . [53]

Катализатор BINAP/диамин-Ru эффективен для асимметричного восстановления как функционализированных, так и простых кетонов [54], а катализатор BINAP/диамин-Ru может энантиоселективно катализировать ароматические , гетероароматические и олефиновые кетоны . [55] Лучшая стереоселективность достигается, когда один заместитель больше другого (см. угол Флиппина-Лоджа ).
Асимметричное гидрирование ароматических (особенно гетероароматических ) субстратов является очень активной областью текущих исследований. Катализаторам в этой области приходится иметь дело с рядом усложняющих факторов, включая склонность высокостабильных ароматических соединений сопротивляться гидрированию, потенциальные координирующие (и, следовательно, отравляющие катализатор) способности как субстрата, так и продукта, а также большое разнообразие моделей замещения, которые может присутствовать на любом одном ароматическом кольце. [56] Из этих субстратов наиболее последовательный успех был замечен с азотсодержащими гетероциклами, где ароматическое кольцо часто активируется либо протонированием, либо дальнейшей функционализацией азота (обычно с помощью электроноакцепторной защитной группы). Такие стратегии менее применимы к кислород- и серосодержащим гетероциклам, поскольку они менее основные и менее нуклеофильные; эта дополнительная трудность может помочь объяснить, почему существует мало эффективных методов их асимметричного гидрирования.
Существуют две системы асимметричного гидрирования 2-замещенных хинолинов с выходами изолированных веществ, обычно превышающими 80%, и значениями ее, как правило, превышающими 90%. Первая представляет собой систему иридий(I)/хиральный фосфин/I2 , о которой впервые сообщили Zhou et al. . [57] Хотя первым хиральным фосфином, использованным в этой системе, был MeOBiPhep, новые версии были направлены на улучшение характеристик этого лиганда. С этой целью в системах используются фосфины (или родственные лиганды) с улучшенной стабильностью на воздухе, [58] возможностью повторного использования, [58] простотой приготовления, [59] более низкой загрузкой катализатора [60] [61] и потенциальной ролью ахиральных фосфиновых добавок. [62] По состоянию на октябрь 2012 года, по-видимому, не было предложено никакого механизма, хотя были документированы как необходимость I 2 или галогенного заменителя, так и возможная роль гетероароматического N в содействии реакционной способности. [56]
Второй представляет собой органокалитическую систему гидрирования с переносом, основанную на эфирах Ханча и хиральной кислоте Бренстеда . В этом случае авторы предполагают механизм, при котором изохинолин поочередно протонируется на стадии активации, а затем восстанавливается за счет сопряженного добавления гидрида из сложного эфира Ганча. [63]
Большая часть химии асимметричного гидрирования хиноксалинов тесно связана с химией структурно подобных хинолинов . Эффективные (и действенные) результаты могут быть получены с помощью системы Ir(I)/фофинит/I 2 [ 64] и органокаталитической системы на основе сложного эфира Ганча, [65] обе из которых аналогичны системам, обсуждавшимся ранее в отношении хинолинов. .
Пиридины представляют собой весьма изменчивые субстраты для асимметричного восстановления (даже по сравнению с другими гетероароматическим соединениями), поскольку в начальном кольце доступны пять углеродных центров для дифференциального замещения. По состоянию на октябрь 2012 года не существует метода, который мог бы контролировать все пять, хотя существует по крайней мере один достаточно общий метод.
Самый общий метод асимметричного гидрирования пиридина на самом деле является гетерогенным методом, в котором асимметрия создается за счет хирального оксазолидинона, связанного с положением C2 пиридина. Гидрирование таких функционализированных пиридинов на ряде различных гетерогенных металлических катализаторов дало соответствующий пиперидин с заместителями в положениях C3, C4 и C5 в полностью цис- геометрии , с высоким выходом и превосходной энантиоселективностью. Вспомогательный оксазолидинон также легко расщепляется в условиях гидрирования. [66]

Методы, специально разработанные для гидрирования 2-замещенного пиридина, могут включать асимметричные системы, разработанные для родственных субстратов, таких как 2-замещенные хинолины и хиноксалины. Например, система иридий(I)\хиральный фосфин\I 2 эффективна при асимметричном гидрировании активированных (алкилированных) 2-пиридиний [67] или некоторых циклогексанон-конденсированных пиридинов. [68] Аналогично, хиральный катализ кислотой Бренстеда с эфиром Ганча в качестве источника гидрида эффективен для некоторых 2-алкилпиридинов с дополнительным активирующим замещением. [69]
Установлено асимметричное гидрирование индолов с N -Boc-защитой . [70]

Система Pd(TFA) 2 /H8-BINAP обеспечивает энантиоселективное цис -гидрирование 2,3- и 2-замещенных индолов. [71] [72]

Подобно поведению индолов, пирролы могут быть превращены в пирролидины путем асимметричного гидрирования. [73]

Асимметричное гидрирование фуранов и бензофуранов представляет собой сложную задачу. [74]
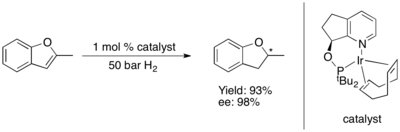
Асимметричное гидрирование тиофенов и бензотиофенов катализируется некоторыми комплексами рутения(II) с N -гетероциклическими карбенами (NHC). Эта система, по-видимому, обладает превосходной селективностью (ee > 90%) и идеальной диастереоселективностью (все цис ), если субстрат имеет конденсированное (или непосредственно связанное) фенильное кольцо, но во всех других проверенных случаях дает только рацемический продукт. [75]

Ни один гетерогенный катализатор для асимметричного гидрирования не был коммерциализирован.
Первое асимметричное гидрирование было сосредоточено на палладии, нанесенном на шелковую подложку. Алкалоиды хинного дерева использовались в качестве хиральных модификаторов для энантиоселективного гидрирования. [76]

Альтернативным методом, позволяющим лучше контролировать структурные и электронные свойства активных каталитических центров, является иммобилизация катализаторов, разработанных для гомогенного катализа, на гетерогенном носителе. Ковалентное связывание катализатора с полимером или другим твердым носителем, пожалуй, наиболее распространено, хотя иммобилизация катализатора также может быть достигнута путем адсорбции на поверхности, ионного обмена или даже физического инкапсулирования. Одним из недостатков этого подхода является возможность того, что близость носителя может изменить поведение катализатора, снизив энантиоселективность реакции. Чтобы избежать этого, катализатор часто связывают с носителем длинным линкером, хотя известны случаи, когда близость носителя может фактически повысить эффективность катализатора. [76]
Последний подход включает в себя создание MOF, которые включают хиральные реакционные центры из ряда различных компонентов, потенциально включая хиральные и ахиральные органические лиганды, структурные ионы металлов, каталитически активные ионы металлов и/или предварительно собранные каталитически активные металлоорганические ядра. [77] Один из них включал катализаторы на основе рутения . Всего лишь 0,005 мол. % таких катализаторов оказалось достаточно для осуществления асимметричного гидрирования арилкетонов, хотя в обычных условиях использовалось 0,1 мол. % катализатора, что приводило к энантиомерному избытку 90,6–99,2 %. [78]


Асимметричная гидрогенизация используется при производстве нескольких лекарств, таких как антибактериальный левофлоксин, антибиотик карбапенем и антипсихотический агент BMS181100. [15] [16] [17]
Исследования Ноулза в области асимметричного гидрирования и его применения в промышленном синтезе L-дофа [4] дали асимметричному гидрированию мощный старт в промышленном мире. Обзор 2001 года показал, что на асимметричное гидрирование приходится 50% производственных, 90% пилотных и 74% лабораторных каталитических энантиоселективных процессов в промышленности, с оговоркой, что асимметричные каталитические методы в целом еще не получили широкого распространения. [79]
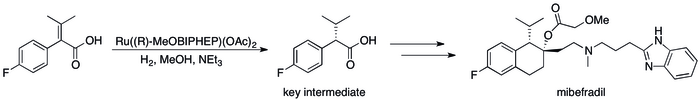
Асимметричное гидрирование заменило методы, основанные на кинетическом разрешении, что привело к существенному повышению эффективности процесса. [12] можно увидеть в ряде конкретных случаев, когда, например, группа катализа компании Roche смогла добиться синтеза ( S , S )-Ro 67-8867 с общим выходом 53%, что является резким увеличением выше 3,5%. это было достигнуто при синтезе на основе разрешения. [80] Синтез мибефрадил компании «Рош» также был улучшен за счет замены разделения на асимметричное гидрирование, сокращения количества стадий на три и увеличения выхода ключевого промежуточного продукта до 80% с первоначальных 70%. [81]
Катализаторы гидрирования, вдохновленные Нойори, были применены в коммерческом синтезе ряда тонких химических веществ. (R)-1,2-Пропандиол, предшественник антибактериального левофлоксацина , может быть эффективно синтезирован из гидроксиацетона с использованием асимметричного гидрирования Нойори: [17]
Новые пути сосредоточены на гидрировании (R) -метиллактата . [12]
Антибиотик карбапенем также получают с использованием асимметричного гидрирования Нойори через (2S,3R)-метил-2-(бензамидометил)-3-гидроксибутаноат, который синтезируют из рацемического метил-2-(бензамидометил)-3-оксобутаноата путем динамического кинетического разрешения .
Антипсихотическое средство БМС 181100 синтезировано с использованием катализатора БИНАП/диамин-Ru.
