Borrelia burgdorferi — грамотрицательный [1] вид бактерий класса спирохет в роде Borrelia , один из возбудителей болезни Лайма у людей. [2] [3] Вместе с несколькими похожими геновидами, некоторые из которых также вызывают болезнь Лайма, он составляет комплекс видов Borrelia burgdorferi sensu lato . В настоящее время комплекс включает 20 принятых и 3 предложенных геновида. [3] B. burgdorferi sensu stricto обитает в Северной Америке и Евразии и до 2016 года был единственной известной причиной болезни Лайма в Северной Америке. [4] [5] [3]
Borrelia burgdorferi названа в честь исследователя Вилли Бургдорфера , который впервые выделил бактерию в 1982 году. [6]
Borrelia burgdorferi — микроаэрофил, которому для гликолиза и выживания требуется небольшое количество кислорода. Как и все другие виды Borrelia , эта бактерия также является грамотрицательной и спирохетой. Колонии Borrelia часто меньше, округлые и белые с приподнятым центром. [7] B. burgdorferi обладает жгутиками , которые обеспечивают ей подвижность. Она может быть оксидазоотрицательной, но B. burgdorferi обладает геном, кодирующим супероксиддисмутазу . Этот белок ингибирует накопление активных форм кислорода (ROS). [9] Бактерия, по-видимому, способна использовать множество различных моносахаридов для производства энергии. [13]
B. burgdorferi напоминает другие спирохеты тем, что у нее есть внешняя мембрана и внутренняя мембрана с тонким слоем пептидогликана между ними. Она характеризуется как имеющая гибкую яму для клеток и имеет длинные и цилиндрические клетки, шириной примерно 1 микрон. Однако во внешней мембране отсутствует липополисахарид . Ее форма представляет собой плоскую волну. Она имеет ширину около 0,3 мкм и длину от 5 до 20 мкм. [14]
B. burgdorferi — это микроаэробная , подвижная спирохета с семью-одиннадцатью пучками периплазматических жгутиков, расположенных на каждом конце, что позволяет бактерии перемещаться как в средах с низкой, так и с высокой вязкостью, что связано с ее высоким фактором вирулентности. [15]
B. burgdorferi – медленнорастущая микроаэрофильная спирохета со временем удвоения от 24 до 48 часов. [16]
Бактериальная трансформация использовалась исследователями для выделения специфических патогенных генов среди Borrelia burgdorferi . Штаммы B. burgdorferi, по-видимому, крайне недостаточны для использования в бактериальной трансформации из-за большого количества ДНК, необходимого для трансформации, времени, необходимого для получения надежных трансформантов, и влияния систем рестрикции и модификации . [17] [18] Фактически, инфекционность B. burgdorferi часто требует гена pncA , который присутствует на бактериальной плазмиде, содержащей ген bbe02 , который подвергается сильному отбору во время трансформации. Поскольку эти гены часто объединяются в пары, инфекционность подвергается отбору во время трансформации, что противоречит исследованиям по выявлению конкретных генов, которые функционируют в патогенности Borrelia burgdorferi . [19] Несмотря на это, был достигнут определенный прогресс в разгадке тайн B. burgdorferi, например, открытие гена cyaB как необходимого для инфекции млекопитающих. [20]
B. burgdorferi циркулирует между клещами Ixodes и позвоночным хозяином в энзоотическом цикле . [3] B. burgdorferi, живущая в клеще, в основном приобретается через кровь инфицированного, компетентного позвоночного хозяина, [21] но существуют редкие случаи трансовариальной передачи . [22] После заражения клещ передает B. burgdorferi , питаясь другим позвоночным, чтобы завершить цикл. [23] Клещи могут передавать B. burgdorferi человеку, но люди являются тупиковыми хозяевами, вряд ли продолжающими жизненный цикл спирохеты. [24] Нимфы линяют во взрослых клещей, которые обычно питаются более крупными млекопитающими, которые не способны поддерживать выживание B. burgdorferi . [25]
B. burgdorferi является возбудителем болезни Лайма , и именно поэтому эта бактерия так важна и изучается. Чаще всего она передается от клещей к человеку. Люди выступают в качестве хозяина клеща для этой бактерии. Болезнь Лайма является зоонозным трансмиссивным заболеванием, передаваемым клещом Ixodes ( также переносчиком Babesia и Anaplasma ). Инфицированный нимфальный клещ передает B. burgdorferi через свою слюну человеку во время кровососания. [25]
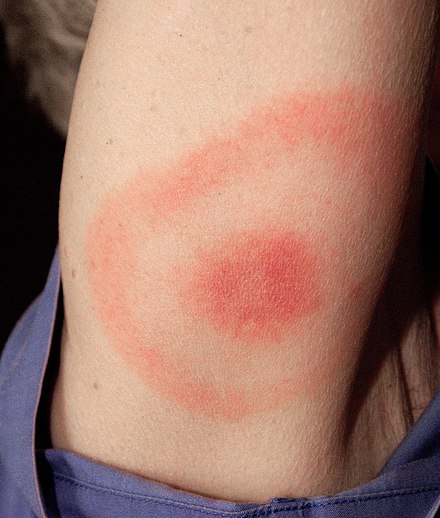
Клиническая картина болезни Лайма наиболее известна по характерной сыпи в виде «бычьего глаза» (также известной как хроническая мигрирующая эритема ), но может также включать миокардит , кардиомиопатию , аритмию , артрит , артралгию , менингит , невропатии и паралич лицевого нерва [26] в зависимости от стадии инфекции.
Инфекции B. burgdorferi были обнаружены в возможной связи с первичными кожными диффузными В-крупноклеточными лимфомами (PCDLBCL), [27] [28] где обзор первичной литературы по состоянию на 2010 год отметил, что большинство исследованных PCBCL были «невосприимчивы» к антибиотикам; [28] : 846 следовательно, как и в случае ассоциации Chlamydophila psittaci с лимфомой, ассоциированной со слизистой оболочкой глаза (MALT-лимфомой), рабочий вывод состоял в том, что «если B. burgdorferi действительно связана с PCBCL, то существует широкая географическая изменчивость и, вероятно, задействованы другие факторы». [28] : 846
Развитие заболевания проходит три стадии.
Стадия 1 известна как ранняя локализованная стадия и наступает примерно через 3 дня - 1 месяц после инокуляции. Она поражает локальную область вокруг укуса и характеризуется местным отеком и/или красной сыпью в виде «бычьего глаза» (также известной как хроническая мигрирующая эритема ), которая выглядит как эритематозный круг, окружающий определенный центр, который расширяется наружу. Он может достигать 15 см в диаметре. [29] : 658 Как только сыпь начинает спадать, первые симптомы могут проявляться как симптомы «гриппоподобия». На этой стадии антибиотики наиболее эффективны для предотвращения дальнейшего роста и симптомов заболевания до того, как проявятся основные симптомы. [29] : 659
Стадия 2 известна как ранняя диссеминированная стадия и наступает через несколько недель или месяцев после заражения, если ее не лечить. Бактерии распространяются через кровь по всему телу, поражая органы. Она часто проявляется общими симптомами, такими как лихорадка, озноб, усталость и лимфаденопатия, а также симптомами, специфичными для органов. Она может поражать сердце, вызывая миокардит , а также аритмии, такие как атриовентрикулярные блокады (которые, если они достаточно значительны, могут потребовать установки кардиостимулятора). Она может поражать опорно-двигательный аппарат, вызывая невоспалительный транзиторный артрит и/или артралгии . Она может поражать нервную систему, проявляясь параличом лицевого нерва ( паралич Белла , классически двусторонний), усталостью и потерей памяти. [ требуется ссылка ]
Стадия 3 известна как поздняя диссеминированная стадия и наступает через месяцы - годы после первичной инфекции. Последствия 3-й стадии включают энцефалит или менингит, [29] а также мигрирующие артропатии (чаще всего колена). [29]
Анаплазмоз и бабезиоз также являются распространенными клещевыми патогенами, переносимыми клещами Ixodes, которые заражают людей подобно Borrelia burgdorferi . [30] Следовательно, клещ Ixodes может коинфицировать хозяина двумя или всеми другими заболеваниями. Когда хозяин коинфицирован, комбинированные эффекты заболеваний действуют синергически, часто оказываясь причиной более серьезных симптомов, чем одна инфекция в отдельности [30] Коинфицированные люди, как правило, демонстрируют более тяжелое проявление болезни Лайма. Кроме того, они, как правило, приобретают более широкий спектр вторичных симптомов, таких как симптомы, похожие на грипп. [30] Необходимо провести больше исследований и разработок, чтобы определить синергический эффект коинфекции и ее влияние на организм человека.
На сегодняшний день существует три фактора, которые могут способствовать тяжести клинического проявления болезни Лайма. Наличие рибосомных спейсеров, плазмид и внешнего поверхностного белка C (OspC) являются показателями тяжести инфекции. [31] Кроме того, люди сами по себе различаются по своей реакции на инфекцию. [31] Различия в реакции приводят к различным клиническим проявлениям и различным инфекциям в разных органах. [ необходима цитата ]
После передачи патогена он приспосабливается к условиям млекопитающих. Borrelia burgdorferi изменяет свои гликопротеины и протеазы на своей плазматической мембране, чтобы облегчить распространение по крови. [31] Во время заражения B. burgdorferi экспрессирует белки, которые взаимодействуют с эндотелиальными клетками , тромбоцитами , хондроцитами и внеклеточным матриксом . [31] Это взаимодействие подавляет правильное функционирование инфицированных областей, что приводит к патологическим проявлениям болезни Лайма. В ответ хозяин инициирует воспалительную реакцию , чтобы попытаться удалить инфекцию. [31]
Borrelia burgdorferi также экспрессирует по крайней мере семь связывающих плазминоген белков для интерференции фактора H на уровне активации. Это часть стратегии уклонения от системы комплемента , которая приводит к блокированию иммунного ответа по нисходящей. [32]
Кроме того, у Borrelia burgdorferi есть стратегия прямого ингибирования классического пути системы комплемента. Боррелиальный липопротеин BBK32, экспрессируемый на поверхности Borrelia burgdorferi , связывает инициирующий протеазный комплекс C1 классического пути. Более конкретно, BBK32 взаимодействует с субъединицей C1r C1. С-концевой домен белка BBK32 опосредует связывание. В результате C1 оказывается в неактивной форме. [33]
B. burgdorferi (штамм B31) был третьим микробным геномом , когда-либо секвенированным , после секвенирования Haemophilus influenzae и Mycoplasma genitalium в 1995 году. Его линейная хромосома содержит 910 725 пар оснований и 853 гена . [34] Использованный метод секвенирования был методом полного геномного дробовика . Проект по секвенированию, опубликованный в Nature в 1997 году и Molecular Microbiology в 2000 году, был проведен в Институте геномных исследований . [35] Геном B. burgdorferi состоит из одной мегабазовой хромосомы и необычного множества кольцевых и линейных плазмид размером от 9 до 62 килобаз. [23] Мегабазовая хромосома, в отличие от многих других эубактерий, не имеет никакого отношения ни к вирулентности бактерий, ни к взаимодействию хозяина и паразита. [34] Некоторые плазмиды необходимы для жизненного цикла B. burgdorferi , но не для размножения бактерий в культуре. [23]
Геномные вариации B. burgdorferi способствуют разной степени инфицирования и распространения. [36] Каждая геномная группа имеет разные антигены на своем мембранном рецепторе, которые специфичны для инфекции хозяина. Одним из таких мембранных рецепторов является поверхностный белок OspC. [36] Показано, что поверхностный белок OspC является сильным индикатором идентификации геномной классификации и степени распространения. [36] Различное количество локусов OspC является признаками и детерминантами для вариаций B. burgdorferi . [36] Поверхностный белок также находится на переднем крае современных исследований вакцины от болезни Лайма через Borrelia . [37]
Известно , что относительно небольшое количество бактериофагов заражают B. burgdorferi . Было выделено несколько фаговых частиц, и некоторые данные свидетельствуют о том, что они имели геном dsDNA размером 8 кб . Среди наиболее изученных фагов Borrelia находится φBB-1, фаг с многогранной головкой и сократительным хвостом длиной 90 нм. [38] [39] φBB-1 был первым бактериофагом, который предоставил доказательства трансдукции для латерального переноса генов у видов Borrelia , вызывающих болезнь Лайма. [40] Текущие исследования направлены на использование бактериофагов в качестве способа идентификации факторов вирулентности у спирохет, которые приводят к болезни Лайма. [ необходима цитата ]
Генетически разнообразные штаммы B. burgdorferi , определяемые последовательностью ospC , поддерживаются на северо-востоке США. Балансирующий отбор может действовать на ospC или близлежащую последовательность для поддержания генетического разнообразия B. burgdorferi . [41] Балансирующий отбор — это процесс, посредством которого несколько версий гена сохраняются в генофонде с неожиданно высокими частотами. Две основные модели, которые контролируют баланс отбора B. burgdorferi, — это отрицательный частотно-зависимый отбор и полиморфизм множественной ниши . [42] Эти модели могут объяснить, как B. burgdorferi диверсифицировались и как отбор мог повлиять на распределение вариантов B. burgdorferi или изменение определенных признаков вида в определенных средах. [ требуется ссылка ]
При отрицательном частотно-зависимом отборе редкие и необычные варианты будут иметь селективное преимущество перед вариантами, которые очень распространены в окружающей среде. [42] Для B. burgdorferi низкочастотные варианты будут выгодны, поскольку потенциальные хозяева будут менее склонны к иммунологическому ответу на специфичный для варианта внешний белок OspC. [42]
Экологические ниши — это все переменные в окружающей среде, такие как ресурсы, конкуренты и реакции, которые способствуют приспособленности организма. Полиморфизм множественных ниш утверждает, что разнообразие поддерживается в популяции за счет различного количества возможных ниш и сред. [42] Следовательно, чем больше различных ниш, тем больше вероятность полиморфизма и разнообразия. Для B. burgdorferi различные ниши позвонков, такие как олени и мыши, могут влиять на общий балансирующий выбор для вариантов. [42]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite book}}: CS1 maint: другие ( ссылка )