Агонисты β2 - адренорецепторов представляют собой группу препаратов, которые избирательно действуют на β2 - рецепторы в легких, вызывая бронходилатацию . β2 - агонисты используются для лечения астмы и ХОБЛ , заболеваний, вызывающих обструкцию дыхательных путей. До их открытия использовался неселективный бета-агонист изопреналин . Целью разработки препарата на протяжении многих лет было минимизировать побочные эффекты, добиться селективности и более длительного действия. Механизм действия хорошо изучен и способствовал разработке. Структура сайта связывания и природа связывания также хорошо известны, как и взаимосвязь структуры и активности .
Селективные агонисты β2 были разработаны в 20 веке и представляют собой очень ценный класс лекарственных средств. В 1901 году Йокичи Такамине выделил гормон адреналин, также известный как эпинефрин . [1] В 1890 году адреналин впервые был назначен больным астмой перорально. Он не оказал практически никакого эффекта, поскольку метаболизируется в пищеварительном тракте и дезактивируется. В 1930 году адреналин был впервые введен подкожно , и было обнаружено, что он оказывает положительное влияние на астму. [1] При подкожном введении адреналин влияет на весь организм, вызывая различные побочные эффекты и, таким образом, снижая ценность этого лечения. Позднее был опробован ингаляционный путь, и он дал гораздо меньше побочных эффектов, но все еще имел неудобные побочные эффекты, такие как страх, беспокойство, беспокойство, головная боль, головокружение и сердцебиение. [1]
В 1940 году был открыт изопротеренол ( изопреналин ). Это соединение имело эффект, аналогичный эффекту адреналина, но было обнаружено меньше побочных эффектов. В 1949 году изопротеренол использовался в основном для лечения пациентов с астмой, его принимали сублингвально или в виде ингаляций. [1] Первый дозированный ингалятор под давлением был представлен в 1956 году. Он был намного удобнее для пациентов, чем ранее использовавшиеся ингаляторы с баллоном. Техника дозированного ингалятора под давлением быстро развивалась в 1970-х годах.
В 1967 году было показано, что β2 - рецептор отвечает за бронходилатацию, и это привело к разработке более селективных препаратов. [1] В 1961 году был обнаружен орципреналин, β2 -агонист длительного действия , но он был не таким мощным, как изопротеренол. Орципреналин не имеет катехольной структуры, что было причиной более длительного времени действия. В середине 1960-х годов был открыт альбутерол или сальбутамол, а затем несколько лет спустя — трибуталин и фенотерол. Альбутерол и тербуталин давали меньше побочных эффектов, таких как учащенное сердцебиение, чем изопротеренол. Фармацевтическая компания Glaxo открыла сальметерол, β2-агонист длительного действия, который обладал бронходилатирующей активностью до 12 часов. Он был выпущен на рынок в 1990 году. Формотерол, другой β 2 -агонист длительного действия , был выпущен на рынок вскоре после этого. Такая длительная продолжительность действия сделала лечение тяжелой астмы и ХОБЛ более удобным для пациентов, поскольку его вдыхают дважды в день. [1] В 2013 году был выпущен на рынок β 2 -агонист сверхдлительного действия , вилантерол. Продолжительность его действия составляет 24 часа, что должно улучшить соблюдение пациентами режима лечения и сделать лечение более удобным. [2]
β2 - агонисты используются для лечения астмы , воспалительного заболевания дыхательных путей. Воспаление делает бронхи чувствительными к некоторым факторам окружающей среды, что вызывает бронхоспазм. Когда происходит это сужение, дыхательные пути сужаются, и это вызывает такие симптомы, как хрипы, стеснение в груди, одышка и кашель. Мышцы дыхательных путей напрягаются, и клетки дыхательных путей начинают вырабатывать больше слизи, чем обычно, что еще больше сужает дыхательные пути. Симптомы часто начинаются в детстве, но могут начаться в любом возрасте. [3]
Для лечения хронической обструктивной болезни легких используются как β2-агонисты короткого , так и длительного действия . ХОБЛ вызывает ограничение воздушного потока в легких из-за воспаления. Курение является основным фактором риска, но вдыхание токсичных и вредных частиц и газов также может вызвать заболевание. Симптомами являются аномальное образование слизи, раздувание легких, которое вызывает ограничение воздушного потока, аномальный газообмен и легочная гипертензия. ХОБЛ чаще всего встречается у людей старше пятидесяти лет, которые имеют длительный анамнез курения. Симптомы сначала легкие, но со временем ухудшаются. [4]
Существует два типа β 2 -агонистов: длительного и короткого действия. Они оба вдыхаются и вводятся с помощью аэрозольных устройств доставки. [5] [6] Длительно действующие β 2 -агонисты часто назначаются в сочетании с кортикостероидами для лечения астмы. Короткодействующие β 2 -агонисты используются для лечения астмы, вызванной физическими нагрузками, [7] и для пациентов с астмой, чтобы получить быстрое облегчение симптомов. Их принимают за 10–15 минут до тренировки. Бронходилатация начинается через несколько минут после вдыхания короткодействующих β 2 -агонистов и длится от 4 до 8 часов. [8] [9] Длительно действующие β 2 -агонисты не рекомендуются для лечения острой астмы, вызванной физическими нагрузками , поскольку их хроническое использование может маскировать плохо контролируемую астму. [10]
Кинетика расслабления гладких мышц дыхательных путей, а также начало и продолжительность бронходилатации у пациентов с астмой отражаются в различии механизма взаимодействия короткодействующих (SABA) и долгодействующих β 2 -агонистов (LABA) и β 2 -рецепторов. [11] Существует много формул селективных β 2 -агонистов; ингаляция является предпочтительным путем, поскольку она наиболее быстро действует и связана с минимальными побочными эффектами. [12] Сульфатные конъюгаты являются основными метаболитами ; связывание с белками довольно слабое, и были обнаружены только незначительные взаимодействия с другими препаратами. [13] Основными ферментами, которые регулируют метаболизм катехоламинов, являются КОМТ и МАО . Коммерческие САБА, сальбутамол и тербуталин, устойчивы к КОМТ, но медленно метаболизируются МАО, в то время как LABA устойчивы как к КОМТ, так и к МАО. Кроме того, большая продолжительность действия сальметерола связана с повышенной липофильностью молекул, что позволяет ему дольше оставаться в легких. [14] β 2 -агонисты в основном выводятся почками после парентерального введения, тогда как после перорального введения более выраженный метаболический клиренс (высокий эффект первого прохождения) отвечает за низкую биодоступность. Выведение после ингаляции не изучалось, но профиль, вероятно, находится где-то между тем, что мы видим после парентерального и перорального введения. [13]

β-рецепторы — это мембраносвязанные рецепторы, сопряженные с G-белками . Молекулярная фармакология выявила три типа β-рецепторов . β 1 -рецепторы составляют до 75% всех бета-рецепторов и преимущественно расположены в сердце. β 2 -рецепторы обнаружены в сосудистых и бронхиальных гладких мышцах. β 3- рецепторы , которые, как предполагается, участвуют в метаболизме жирных кислот, расположены в адипоцитах . [15]

Рецепторы, сопряженные с G-белком, состоят из отдельных полипептидных цепей из 300-600 аминокислот и охватывают плазматическую мембрану семь раз. [16] Существуют три внеклеточные петли, одна из которых является аминоконцом , и три внутриклеточные петли с карбоксиконцом . [11] Гидрофильный карман образован внутри мембраны семью альфа-спиральными трансмембранными доменами . Лиганд связывается с гидрофильным карманом в рецепторном белке и активирует рецептор, вызывая клеточный эффект. [16]
Когда β 2 -агонист связывается и активирует β 2 -адренорецептор, внутриклеточная сигнализация в значительной степени затрагивается циклическим аденозинмонофосфатом ( цАМФ ) и протеинкиназой А ( ПКА ). Связь β 2 -рецептора с аденилатциклазой затрагивается тримерным белком Gs, как показано на рисунке 2, состоящим из α-субъединицы (которая стимулирует аденилатциклазу) и βγ-субъединицы (которая передает другие сигналы). Аденилатциклаза катализирует превращение аденозинтрифосфата в цАМФ, который является вторичным мессенджером , тем самым увеличивая внутриклеточные уровни цАМФ, что приводит к расслаблению гладких мышц. Уровни цАМФ регулируются посредством активности изоферментов/изоформ фосфодиэстеразы , которая расщепляет его до 5′-АМФ . [11] [16] Механизм, посредством которого цАМФ вызывает расслабление в гладкомышечных клетках дыхательных путей, до конца не изучен. Считается, что цАМФ катализирует активацию PKA, которая, в свою очередь, фосфорилирует ключевые регуляторные белки, участвующие в контроле мышечного тонуса. цАМФ также играет роль в ингибировании высвобождения ионов кальция (Ca 2+ ) из внутриклеточных хранилищ, секвестрации внутриклеточного Ca 2+ и снижении входа мембранного Ca 2+ , что приводит к расслаблению гладкомышечных клеток дыхательных путей. [11]

Связывание норадреналина с сайтом связывания состоит из одной ионной связи , трех водородных связей и взаимодействия Ван-дер-Ваальса в двух местах. Ионная связь образуется между протонированным амином и Asp-113 в спирали 3. Водородные связи образуются из гидроксильных групп, связанных с катехольным кольцом, с Ser-204 и Ser-207 в спирали 5. Это связывание ограничивает конфигурационную и вращательную свободу. Силы Ван-дер-Ваальса между ароматическим катехольным кольцом и Phe-290 в остатке спирали 6 и Val-114 в остатке спирали 3 усиливают связывание. Считается, что N-алкильные заместители вписываются в гидрофобный карман, образованный между остатками в спирали 6 и 7. Бета-углерод является хиральным и должен иметь R-конфигурацию, чтобы бета-гидроксильная группа была ориентирована к остатку Asn-293 в спирали 6 для образования водородной связи, необходимой для связывания с рецептором бета-2. [14]
Две теории объясняют длительное время действия LABA. Первая объясняет длительное действие с точки зрения предполагаемого « экзосайта » или «экзоцептора», отличного от β2 - адренорецептора, с которым длинный алифатический хвост сальметерола связывается с высокой аффинностью. Это позволяет активной головке салигенина наклоняться к рецептору и отходить от него, чтобы многократно его активировать. [17] У формотерола нет длинной боковой цепи, как у сальметерола, для связывания с «экзосайтом», поэтому эта теория была подвергнута сомнению. В 1994 году Андерсон и др. представили микрокинетическую теорию диффузии плазмалеммы, объясняющую, что происходит с β2 - агонистом в липидном бислое клеточной мембраны и в водной биофазе, наиболее близкой к месту связывания β2 - адренорецептора. Предполагается, что липидный бислой плазмалеммы гладких мышц дыхательных путей действует как депо для агонистов β2 - адренорецепторов. Агонисты β2 - адренорецепторов остаются доступными для взаимодействия с активным центром β2 - адренорецепторов после распределения в липидном бислое. [17]
Основным фармакофором для всех адренергических агонистов является замещенный фенэтиламин , который увеличивает продолжительность действия. [14]
Адренергические агонисты, селективные для подтипа β 2, вызывают расширение бронхов и, как можно ожидать, облегчают бронхоспазм астматического приступа. Неселективные β-агонисты оказывают стимулирующее действие на сердце и поэтому имеют ограниченное применение у пациентов с сердечными заболеваниями и астмой. [14]
Введение более высоких доз короткодействующих β 2 -агонистов увеличивает продолжительность действия, но также увеличивает побочные эффекты , такие как сердечные эффекты. Один из подходов к избежанию этих побочных эффектов заключается в использовании структурно различных особенностей, которые могут минимизировать абсорбцию в системный кровоток . Например, можно использовать препараты, которые превращаются в неактивные метаболиты при попадании в системный кровоток. [18]
Заместители в фармакофоре влияют на то, будет ли аналог действовать напрямую или косвенно или смесью того и другого. Он также влияет на специфичность для подтипов β-рецепторов. Аналог прямого действия напрямую связывает β-адренергические рецепторы и вызывает симпатическую реакцию . Аналог непрямого действия вызывает агонистический эффект, но без прямого связывания с β-адренергическим рецептором, например, способствуя высвобождению норадреналина (NE) из пресинаптического окончания или ингибируя обратный захват высвобожденного NE. [14]

На рисунке 4 показаны фенильные кольца, которые используются для β 2 -агонистов. Они называются резорциновым кольцом, салициловым спиртом или м-формамидной группой. [14] На рисунке 5 показано, где находятся различные заместители на фенилэтиламине, обозначенные как различные R-группы.
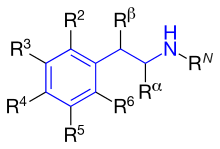
Разница между заместителями R1-R5 описана ниже. Все продаваемые β 2 -агонисты имеют гидроксильную группу в позиции R3 и чаще всего в позиции R5. [14]
RN : Эта группа определяет селективность α- или β-рецепторов. Чем больше заместитель, тем больше селективность для β-рецептора. Если t-бутил расположен в RN , он показывает высокое сродство к β2 - рецептору. Длинный фенилбутоксигексильный заместитель в этом положении дает высокую β2 - селективность, а также высокую липофильность и, следовательно, более длительную продолжительность действия. [14]
R α : Заместители, отличные от водорода, дадут увеличенную продолжительность действия. Этильная группа увеличит селективность для β 2 -рецептора. Однако этильная группа, по-видимому, вызывает повышенные побочные эффекты и низкую эффективность β 2 -рецептора по сравнению с другими β 2 -селективными агонистами. [14]
R β : Гидроксильная группа оказывает прямое действие на β-рецептор. Как отмечалось ранее, все продаваемые β 2 -агонисты имеют гидроксильную группу в этом положении, что делает соединение хиральным , и активным, когда оно имеет (R)-конфигурацию. [14]
R 5 или R 3 : Гидроксильная группа, расположенная у атома углерода номер 5 или 3 ( мета-положение ), оказывает прямое действие на β-адренергический рецептор. [14]
R 4 : Гидроксильная группа или водородная группа в этом положении оказывают прямое действие на β-рецептор. [14]
Обобщение нескольких агонистов β2 - адренорецепторов и их структурной активности показывает, как они действуют по-разному с точки зрения силы, селективности, сродства и продолжительности действия (см. таблицу 1 ):
Все β2 - агонисты, которые используются в клинической практике, представляют собой замещенный β-фенетиламин (см. рисунок 5), и они имеют три вида фенильных колец, показанных на рисунке 4. Они называются резорциновым кольцом, кольцом салицилового спирта или кольцом N-формамида. Спиртовые заместители в фенильном кольце являются реакционноспособными и усложняют синтез β2 - агонистов. Необходима защитная стадия, пока остаток N добавляется в положение R1 (рисунок 5). Еще одна вещь, которая усложняет синтез, — это получение оптически чистого R(-)-энантиомера соединения. Стереохимия очень важна для активности, поскольку только R(-)-энантиомер способен образовывать водородные связи, необходимые для размещения в месте связывания и активации β2 - рецептора. [14]
Сальбутамол обычно вдыхают в рацемических смесях (например, Вентолин). При лечении астмы оптически чистым (R)-сальбутамолом риск побочных эффектов, таких как стимулирующее действие на нервную систему и сердечная аритмия, может быть сведен к минимуму. [20] Существует несколько путей энантиоселективного синтеза , а также методов синтеза рацемической смеси с последующим хиральным разделением . [21]
Стереоселективный синтез трибалина и ацеталя сальбутамола может быть выполнен из O-защищенных-(R)-циангидринов. Ф. Эффенберг и др. описывают способ синтеза. Основные сложности заключаются в выполнении этапа снятия защиты без рацемизации и в образовании чистой соли. Реакцию Риттера можно использовать для N-третичного бутилирования. В этом эксперименте деацетилирование ацеталя (R)-сальбутамола было неудачным, поэтому его нельзя использовать для получения чистого (R)-сальбутамола. На рисунке 6 показаны основные этапы синтеза сальметерола и трибалина. [22]
