Энхансерные РНК (eRNA) представляют собой класс относительно длинных некодирующих молекул РНК (50-2000 нуклеотидов), транскрибируемых с последовательности ДНК энхансерных областей. Впервые они были обнаружены в 2010 году с помощью полногеномных методов, таких как RNA-seq и ChIP-seq . [1] [2] eRNA можно разделить на два основных класса: 1D eRNA и 2D eRNA, которые различаются в первую очередь по размеру, состоянию полиаденилирования и транскрипционной направленности. [3] Экспрессия данной eRNA коррелирует с активностью соответствующего ей энхансера в целевых генах. [4] Все больше доказательств свидетельствует о том, что eRNA активно играют роль в регуляции транскрипции в цис- и транс-положениях , и хотя механизмы их действия остаются неясными, было предложено несколько моделей. [3]
Энхансеры как сайты экстрагенной транскрипции были первоначально обнаружены в исследованиях по всему геному, которые идентифицировали энхансеры как общие области связывания РНК-полимеразы II (РНК pol II) и некодирующей транскрипции РНК . [1] [2] Было обнаружено, что уровень взаимодействия РНК pol II-энхансер и образование РНК-транскрипта сильно варьируется среди этих первоначальных исследований. Используя явные пики сигнатуры хроматина , было обнаружено, что значительная часть (~70%) экстрагенных сайтов начала транскрипции РНК Pol II перекрывает сайты энхансера в мышиных макрофагах . [5] Из 12 000 нейронных энхансеров в геноме мыши было обнаружено, что почти 25% сайтов связывают РНК Pol II и генерируют транскрипты . [6] В параллельных исследованиях было идентифицировано 4588 высоконадежных сайтов связывания экстрагенной РНК Pol II в мышиных макрофагах, стимулированных воспалительным медиатором липополисахаридом для индукции транскрипции. [2] Эти eRNA, в отличие от матричных РНК (мРНК), не имели модификации полиаденилированием , были, как правило, короткими и некодирующими, и транскрибировались двунаправленно. Более поздние исследования выявили транскрипцию другого типа eRNA, полученного путем однонаправленной транскрипции, которые были длиннее и содержали поли-A-хвост . [7] Кроме того, уровни eRNA коррелировали с уровнями mRNA близлежащих генов , что указывает на потенциальную регуляторную и функциональную роль этих некодирующих молекул РНК- энхансера . [1]
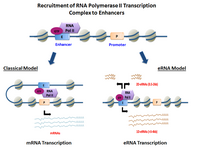
eRNAs транскрибируются из последовательностей ДНК выше и ниже областей экстрагенного энхансера . [8] Ранее несколько модельных энхансеров продемонстрировали способность напрямую рекрутировать РНК Pol II и общие факторы транскрипции и формировать прединициирующий комплекс (PIC) перед сайтом начала транскрипции на промоторе генов . В некоторых типах клеток активированные энхансеры продемонстрировали способность как рекрутировать РНК Pol II , так и предоставлять шаблон для активной транскрипции их локальных последовательностей . [2] [1]
В зависимости от направленности транскрипции , области энхансера генерируют два различных типа некодирующих транскриптов , 1D-eRNA и 2D-eRNA. Природа комплекса предварительной инициации и специфические факторы транскрипции , привлеченные к энхансеру , могут контролировать тип генерируемых eRNA. После транскрипции большинство eRNA остаются в ядре . [9] В целом, eRNA очень нестабильны и активно разрушаются ядерной экзосомой . Не все энхансеры транскрибируются, при этом нетранскрибируемые энхансеры значительно превосходят транскрибируемые по порядку величины десятки тысяч в каждом данном типе клеток . [5]
В большинстве случаев однонаправленная транскрипция областей энхансера генерирует длинные (>4kb) и полиаденилированные eRNA. Энхансеры , которые генерируют polyA+ eRNA, имеют более низкое соотношение H3K4me1 /me3 в своей хроматиновой сигнатуре, чем 2D-eRNA. [7] PolyA+ eRNA отличаются от длинных мультиэкзонных политранскриптов (meRNA), которые генерируются путем инициации транскрипции на внутригенных энхансерах . Эти длинные некодирующие РНК, которые точно отражают структуру гена хозяина, за исключением альтернативного первого экзона , демонстрируют плохой кодирующий потенциал. [10] В результате, polyA+ 1D-eRNA могут представлять собой смешанную группу истинных энхансерных шаблонных РНК и мультиэкзонных РНК.
Двунаправленная транскрипция в сайтах энхансеров генерирует сравнительно более короткие (0,5-2kb) и неполиаденилированные eRNA. Энхансеры , которые генерируют polyA-eRNA, имеют сигнатуру хроматина с более высоким отношением H3K4me1/me3, чем 1D-eRNA. В целом, транскрипция энхансеров и производство двунаправленных eRNA демонстрируют сильную корреляцию активности энхансеров на транскрипции генов . [11]
Арнер и др. [12] идентифицировали 65 423 транскрибированных энхансера (производящих eRNA) среди 33 различных типов клеток в различных условиях и при различных сроках стимуляции. Транскрипция энхансеров обычно предшествовала транскрипции факторов транскрипции , которые, в свою очередь, обычно предшествовали транскрипции генов с помощью мРНК (информационной РНК).
Карулло и др. [13] исследовали один конкретный тип клеток, нейроны (из первичных нейронных культур). Они продемонстрировали 28 492 предполагаемых энхансера, генерирующих эРНК. Эти эРНК часто транскрибировались с обеих нитей ДНК энхансера в противоположных направлениях. Карулло и др. [13] использовали эти культивируемые нейроны для изучения времени специфических энхансерных эРНК по сравнению с мРНК их целевых генов. Культивируемые нейроны активировались, и РНК была выделена из этих нейронов через 0, 3,75, 5, 7,5, 15, 30 и 60 минут после активации. В этих экспериментальных условиях они обнаружили, что 2 из 5 энхансеров немедленного раннего гена (IEG) FOS , то есть энхансер FOS 1 и энхансер FOS 3, активировались и инициировали транскрипцию своих эРНК (эРНК1 и эРНК3). FOS eRNA1 и eRNA3 значительно активировались в течение 7,5 минут, тогда как FOS mRNA активировалась только через 15 минут после стимуляции. Аналогичные закономерности наблюдались в IEG FOSb и NR4A1 , что указывает на то, что для многих IEG индукция eRNA предшествует индукции mRNA в ответ на активацию нейронов.
В то время как некоторые усилители могут активировать свои целевые промоторы на целевых генах без транскрипции эРНК, большинство активных усилителей транскрибируют эРНК во время активации своих целевых промоутеров. [14]
Функции eRNA, описанные ниже, были описаны в различных биологических системах, часто демонстрируемых с небольшим количеством специфических пар генов-энхансеров и целевых генов. Неясно, в какой степени функции eRNA, описанные здесь, могут быть обобщены для большинства eRNA.
.jpg/440px-Regulation_of_transcription_in_metazoans_(animals).jpg)
Хромосомные петли, показанные на рисунке, переносящие энхансер к промотору его целевого гена, могут направляться и формироваться эРНК, транскрибируемой с энхансера после его активации.
Транскрибированная энхансерная РНК (eRNA), взаимодействующая с комплексом белков-медиаторов (см. рисунок), особенно субъединицей 12-го медиатора ( MED12 ), по-видимому, играет важную роль в формировании хромосомной петли, которая приводит энхансер в тесную связь с промотором целевого гена энхансера в случае пяти генов, изученных Лаем и др. [15] [16] [17]. Хоу и Краус [18] описывают два других исследования, сообщающих о схожих результатах. Арнольд и др. [19] рассматривают еще 5 случаев, когда eRNA активна в формировании петли энхансер-промотор.
Одной из хорошо изученных eRNA является eRNA усилителя, который взаимодействует с промотором гена простатического специфического антигена (PSA). [20] PSA eRNA сильно активируется андрогенным рецептором . Высокий уровень PSA eRNA затем имеет эффект домино. PSA eRNA связывается с положительным фактором удлинения транскрипции P-TEFb и активирует белковый комплекс, который затем может фосфорилировать РНК-полимеразу II (RNAP II), инициируя ее активность по производству мРНК . P-TEFb также может фосфорилировать отрицательный фактор удлинения NELF (который останавливает RNAP II в пределах 60 нуклеотидов после начала инициации мРНК). Фосфорилированный NELF высвобождается из RNAP II, затем позволяя RNAP II иметь продуктивную прогрессию мРНК (см. рисунок). Таким образом, повышенная регуляция PSA eRNA увеличивает экспрессию 586 генов, чувствительных к андрогенным рецепторам. Нокдаун эРНК PSA или удаление набора нуклеотидов из эРНК PSA приводит к снижению присутствия фосфорилированной (активной) РНКП II в этих генах, что приводит к снижению их транскрипции.
Белок отрицательного фактора удлинения NELF также может быть высвобожден из его взаимодействия с РНК-полимеразой II путем прямого взаимодействия с некоторыми эРНК. Шаукович и др. [21] показали, что эРНК двух немедленных ранних генов (IEG) напрямую взаимодействовали с белком NELF, чтобы высвобождение NELF из РНК-полимеразы II, приостановленной на промоторах этих двух генов, что позволило этим двум генам затем экспрессироваться.
Кроме того, eRNA, по-видимому, взаимодействуют с примерно 30 другими белками. [19] [17] [18]

Представления о том, что не все энхансеры транскрибируются одновременно и что транскрипция eRNA коррелирует с активностью, специфичной для энхансера, поддерживают идею о том, что отдельные eRNA выполняют различные и соответствующие биологические функции. [3] Однако до сих пор нет единого мнения о функциональной значимости eRNA. Кроме того, eRNA могут легко разрушаться через экзосомы и бессмысленно-опосредованный распад , что ограничивает их потенциал как важных регуляторов транскрипции. [22] На сегодняшний день предложены четыре основные модели функции eRNA, [3] каждая из которых подкреплена различными линиями экспериментальных доказательств .
Поскольку многочисленные исследования показали, что РНК Pol II может быть обнаружена в очень большом количестве экстрагенных областей, возможно, что eRNA просто представляют собой продукт случайной «протекающей» транскрипции и не несут никакой функциональной значимости. [5] Неспецифическая активность РНК Pol II, таким образом, допускает экстрагенный транскрипционный шум в местах, где хроматин уже находится в открытом и транскрипционно компетентном состоянии. Это объяснило бы даже тканеспецифическую экспрессию eRNA [23] , поскольку открытые участки также являются тканеспецифическими.
Транскрипция генов , опосредованная РНК Pol II, вызывает локальное открытие состояния хроматина посредством привлечения гистоновых ацетилтрансфераз и других модификаторов гистонов , которые способствуют образованию эухроматина . Было высказано предположение, что присутствие этих ферментов также может вызывать открытие хроматина в областях энхансеров , которые обычно присутствуют в отдаленных местах, но могут быть привлечены к целевым генам посредством петлеобразования ДНК . [24] В этой модели эРНК, таким образом, экспрессируются в ответ на транскрипцию РНК Pol II и, следовательно, не несут биологической функции.
В то время как две предыдущие модели подразумевали, что eRNAs не были функционально значимыми, этот механизм утверждает, что eRNAs являются функциональными молекулами , которые проявляют цис- активность. В этой модели eRNAs могут локально рекрутировать регуляторные белки в их собственном месте синтеза. Подтверждая эту гипотезу, считается, что транскрипты, происходящие от энхансеров выше гена Cyclin D1, служат адаптерами для рекрутирования гистоновых ацетилтрансфераз . Было обнаружено, что истощение этих eRNAs приводит к транскрипционному молчанию Cyclin D1 . [9]
Последняя модель включает в себя транскрипционную регуляцию eRNAs в отдаленных хромосомных локациях. Благодаря дифференциальному рекрутированию белковых комплексов eRNAs могут влиять на транскрипционную компетентность определенных локусов . Evf-2 представляет собой хороший пример такой трансрегуляторной eRNA, поскольку она может индуцировать экспрессию Dlx2, что, в свою очередь, может повышать активность энхансеров Dlx5 и Dlx6 . [25] Транс-действующие eRNAs также могут работать в цис-положении , и наоборот.
Обнаружение эРНК началось сравнительно недавно (2010 г.) и стало возможным благодаря использованию методов исследования всего генома, таких как секвенирование РНК ( РНК-секвенирование ) и иммунопреципитация-секвенирование хроматина ( ChIP-seq ). [1] РНК-секвенирование позволяет напрямую идентифицировать эРНК, сопоставляя обнаруженный транскрипт с соответствующей последовательностью энхансера с помощью биоинформатического анализа. [26] [4] ChIP-seq представляет собой менее прямой способ оценки транскрипции энхансера , но также может предоставить важную информацию, поскольку специфические метки хроматина связаны с активными энхансерами . [27] Хотя некоторые данные остаются спорными, в литературе существует консенсус в том, что наилучшая комбинация посттрансляционных модификаций гистонов в активных энхансерах состоит из H2AZ , H3K27ac и высокого соотношения H3K4me1 над H3K4me3 . [27] [28] [29] Эксперименты ChIP также можно проводить с антителами , которые распознают РНК Pol II , которые можно найти в местах активной транскрипции . [5] Экспериментальное обнаружение эРНК осложняется их низкой эндогенной стабильностью, обусловленной деградацией экзосом и распадом, опосредованным нонсенсом . [22] Сравнительное исследование показало, что анализы, обогащающие кэпированные и новообразующиеся РНК (с такими стратегиями, как запуск ядер и выбор размера), могут захватывать больше эРНК по сравнению с каноническим РНК-секвенированием . [30] Эти анализы включают глобальный/точный запуск с выбором кэпа (GRO/PRO-cap), кэпированную малую РНК-секвенирование (csRNA-seq), нативный удлиненный транскрипт-кэп анализ экспрессии генов (NET-CAGE) и точное секвенирование Run-On (PRO-seq). [31] Тем не менее, тот факт, что эРНК, как правило, экспрессируются из активных энхансеров, может сделать их обнаружение полезным инструментом для различения активных и неактивных энхансеров .
Доказательства того, что eRNAs оказывают нисходящие эффекты на эффективность активации энхансера и транскрипции генов, свидетельствуют о его функциональных возможностях и потенциальной важности. Было показано, что фактор транскрипции p53 связывает области энхансера и генерирует eRNAs зависимым от p53 образом. [32] При раке p53 играет центральную роль в подавлении опухолей , поскольку мутации гена , как показано, появляются в 50% опухолей . [33] Было показано, что эти связанные с p53 области энхансера (p53BERs) взаимодействуют с несколькими локальными и дистальными генными мишенями, участвующими в пролиферации и выживании клеток . Кроме того, было показано, что eRNAs, генерируемые активацией p53BERs, необходимы для эффективной транскрипции целевых генов p53 , что указывает на вероятную важную регуляторную роль eRNAs в подавлении опухолей и раке . В целом, было показано , что мутации в eRNA демонстрируют схожее фенотипическое поведение в онкогенезе по сравнению с кодирующей белок РНК. [34]
Изменения в энхансерах были вовлечены в заболевания человека, но терапевтический подход к манипулированию активностью энхансеров в настоящее время невозможен. С появлением eRNAs как важных компонентов активности энхансеров , мощные терапевтические инструменты, такие как РНКi, могут предоставить многообещающие пути для целевого нарушения экспрессии генов.