Генетика старения обычно занимается продлением жизни , связанным с генетическими изменениями, а не болезнями ускоренного старения , приводящими к сокращению продолжительности жизни.
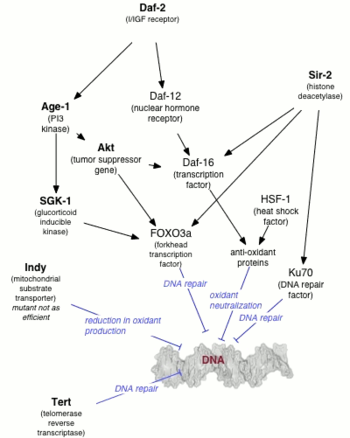
Первой мутацией , увеличивающей продолжительность жизни животного, был ген age-1 у Caenorhabditis elegans . Майкл Класс обнаружил, что продолжительность жизни C. elegans может быть изменена мутациями, но Класс полагал, что эффект был обусловлен снижением потребления пищи ( ограничением калорий ). [1] Томас Джонсон позже показал, что продление жизни на 65% было связано с самой мутацией, а не с ограничением калорий, [2] и назвал ген age-1 в ожидании, что другие гены, контролирующие старение, будут найденный. Ген age-1 кодирует каталитическую субъединицу фосфатидилинозитол-3-киназы класса I (PI3K).
Через десять лет после открытия Джонсоном daf-2 , одного из двух генов, которые необходимы для формирования личинок dauer , Синтия Кеньон [3] показала, что он удваивает продолжительность жизни C. elegans . [4] Кеньон показал, что мутанты daf-2 , которые образуют дауэры при температуре выше 25 ° C (298 K; 77 ° F), будут обходить состояние дауэра при температуре ниже 20 ° C (293 K; 68 ° F) с удвоением продолжительности жизни. . [4] До исследования Кеньона считалось, что продолжительность жизни можно увеличить только за счет потери репродуктивной способности, но нематоды Кеньона сохраняли молодость репродуктивной способности, а также продлевали молодость в целом. Было показано , что последующая генетическая модификация (нулевая мутация PI3K) C. elegans увеличивает максимальную продолжительность жизни в десять раз. [5] [6]
Было продемонстрировано, что долгоживущие мутанты C. elegans ( age-1 и daf-2 ) устойчивы к окислительному стрессу и УФ-излучению . [7] Эти долгоживущие мутанты обладали более высокой способностью к восстановлению ДНК , чем C. elegans дикого типа . [7] Нокдаун гена эксцизионной репарации нуклеотидов Xpa-1 увеличил чувствительность к ультрафиолету и сократил продолжительность жизни долгоживущих мутантов. Эти данные подтверждают гипотезу о том, что повреждение ДНК играет значительную роль в процессе старения . [7]
Генетические модификации других видов не привели к такому значительному увеличению продолжительности жизни, как это наблюдалось у C. elegans . Продолжительность жизни Drosophila melanogaster увеличилась вдвое. [8] Генетические мутации у мышей могут увеличить максимальную продолжительность жизни в 1,5 раза от нормы и до 1,7 раза от нормы в сочетании с ограничением калорий . [9]
У дрожжей НАД +-зависимая гистондеацетилаза Sir2 необходима для подавления геномного молчания в трех локусах: локусах спаривания дрожжей , теломерах и рибосомальной ДНК (рДНК). У некоторых видов дрожжей репликативное старение может быть частично вызвано гомологичной рекомбинацией между повторами рДНК; Удаление повторов рДНК приводит к образованию внехромосомных колец рДНК (ERC). Эти ERC реплицируются и преимущественно отделяются от материнской клетки во время клеточного деления и, как полагают, приводят к клеточному старению за счет титрования (конкуренции) основных ядерных факторов . ERC не наблюдались у других видов (и даже у всех штаммов того же вида дрожжей) дрожжей (которые также демонстрируют репликативное старение), и считается, что ERC не способствуют старению у высших организмов, таких как люди (их не было показано). накапливаться у млекопитающих аналогично дрожжам). Внехромосомная кольцевая ДНК (вкДНК) обнаружена у червей, мух и людей. Происхождение и роль вкДНК в старении, если таковая имеется, неизвестны.
Несмотря на отсутствие связи между кольцевой ДНК и старением у высших организмов, дополнительные копии Sir2 способны продлевать продолжительность жизни как червей, так и мух (хотя у мух это открытие не было воспроизведено другими исследователями, а активатор Ресвератрол Sir2 не увеличивает продолжительность жизни воспроизводимо ни у одного из видов [10] ). Неясно, играют ли гомологи Sir2 у высших организмов какую-либо роль в продолжительности жизни, но было продемонстрировано, что человеческий белок SIRT1 деацетилирует p53 , Ku70 и семейство транскрипции forkhead. факторы . SIRT1 также может регулировать ацетилаты, такие как CBP/p300 , и было показано, что он деацетилирует определенные остатки гистонов .
RAS1 и RAS2 также влияют на старение дрожжей и имеют гомолог человека. Было показано, что сверхэкспрессия RAS2 продлевает продолжительность жизни дрожжей.
Другие гены регулируют старение дрожжей, повышая устойчивость к окислительному стрессу . Супероксиддисмутаза , белок , который защищает от воздействия митохондриальных свободных радикалов , при сверхэкспрессии может продлить жизнь дрожжей в стационарной фазе.
У высших организмов старение, вероятно, частично регулируется посредством пути инсулин/IGF-1. Мутации, которые влияют на инсулиноподобную передачу сигналов у червей, мух и на ось гормон роста/IGF1 у мышей, связаны с увеличением продолжительности жизни. У дрожжей активность Sir2 регулируется никотинамидазой PNC1. Транскрипция PNC1 активируется в стрессовых условиях, таких как ограничение калорий , тепловой шок и осмотический шок . Превращая никотинамид в ниацин , никотинамид удаляется, ингибируя активность Sir2. Никотинамидаза , обнаруженная у людей, известная как PBEF, может выполнять аналогичную функцию, а секретируемая форма PBEF, известная как висфатин, может помочь регулировать уровень инсулина в сыворотке . Однако неизвестно, существуют ли эти механизмы и у человека, поскольку существуют очевидные различия в биологии человека и модельных организмов.
Было показано, что активность Sir2 увеличивается при ограничении калорий. Из-за нехватки доступной глюкозы в клетках доступно больше НАД+, который может активировать Sir2. Сообщалось, что ресвератрол , стильбеноид, обнаруженный в кожуре красного винограда , продлевает продолжительность жизни дрожжей, червей и мух (независимые исследователи доказали, что увеличение продолжительности жизни мух и червей невоспроизводимо [10] ). Было показано, что он активирует Sir2 и, следовательно, имитирует эффекты ограничения калорий, если принять, что ограничение калорий действительно зависит от Sir2.
Согласно базе данных генов, связанных со старением GenAge, у модельных организмов насчитывается более 1800 генов, изменяющих продолжительность жизни : 838 у почвенного аскариды ( Caenorhabditis elegans ), 883 у пекарских дрожжей ( Saccharomyces cerevisiae ), 170 у плодовой мухи ( Drosophila ). melanogaster ) и 126 у мышей ( Mus musculus ). [11]
Ниже приводится список генов, связанных с долголетием согласно исследованиям [11] на модельных организмах :

В июле 2020 года ученые, используя общедоступные биологические данные о 1,75 млн человек с известной общей продолжительностью жизни, идентифицировали 10 геномных локусов , которые, по-видимому, внутренне влияют на продолжительность здоровья , продолжительность жизни и долголетие , о половине из которых ранее не сообщалось в общегеномном значении , и большинство из них связанных с сердечно-сосудистыми заболеваниями , и определить метаболизм гема как многообещающего кандидата для дальнейших исследований в этой области. Их исследование предполагает, что высокий уровень железа в крови, вероятно, снижает, а гены, участвующие в метаболизме железа, вероятно, увеличивают продолжительность здоровой жизни у людей. [13] [12]
Нед Шарплесс и его коллеги продемонстрировали первую in vivo связь между экспрессией р16 и продолжительностью жизни. [14] Они обнаружили снижение экспрессии р16 в некоторых тканях мышей с мутациями, продлевающими продолжительность жизни, а также у мышей, у которых продолжительность жизни была увеличена за счет ограничения еды. Ян ван Дерсен и Даррен Бейкер в сотрудничестве с Андре Терзиком из клиники Майо в Рочестере, штат Миннесота, представили первые in vivo доказательства причинной связи между клеточным старением и старением путем предотвращения накопления стареющих клеток у прогероидных мышей BubR1 . [15] В отсутствие стареющих клеток в тканях мышей наблюдалось значительное улучшение обычного бремени возрастных расстройств. У них не развилась катаракта , они избежали обычного истощения мышц с возрастом. Они сохранили в коже жировые прослойки, которые с возрастом обычно истончаются и у людей вызывают появление морщин. Второе исследование, проведенное Яном ван Дёрсеном в сотрудничестве с группой сотрудников из клиники Майо и Гронингенского университета, предоставило первые прямые доказательства in vivo того, что клеточное старение вызывает признаки старения за счет элиминации стареющих клеток из прогероидных мышей путем введения индуцируемого лекарством вещества. ген суицида , а затем обработать мышей препаратом для избирательного уничтожения стареющих клеток, а не для снижения уровня p16 во всем организме. [16] Другое исследование Мэйо, проведенное Джеймсом Киркландом в сотрудничестве со Скриппсом и другими группами, продемонстрировало, что сенолитики, препараты, воздействующие на стареющие клетки, улучшают сердечную функцию и улучшают реактивность сосудов у старых мышей, облегчают нарушения походки, вызванные радиацией у мышей, и замедляют слабость. , неврологическая дисфункция и остеопороз у прогероидных мышей. Открытие сенолитических препаратов было основано на гипотезе: исследователи использовали наблюдение о том, что стареющие клетки устойчивы к апоптозу, чтобы обнаружить, что в этих клетках активируются пути выживания. Они продемонстрировали, что эти пути выживания являются «ахиллесовой пятой» стареющих клеток с использованием подходов РНК-интерференции , включая пути, связанные с Bcl-2, AKT-, p21- и тирозинкиназой. Затем они использовали препараты, которые, как известно, нацелены на выявленные пути, и показали, что эти препараты убивают сенесцентные клетки путем апоптоза в культуре и уменьшают нагрузку сенесцентных клеток во многих тканях in vivo. Важно отметить, что эти препараты имели долгосрочный эффект после однократной дозы, соответствующий удалению сенесцентных клеток, а не временный эффект, требующий постоянного присутствия лекарств. Это было первое исследование, которое показало, что очистка стареющих клеток улучшает функцию мышей хронологического возраста. [17]