N -ацетилтрансфераза ( NAT ) — фермент , катализирующий перенос ацетильных групп от ацетил-КоА к ариламинам , арилгидроксиламинам и арилгидразинам. [1] [2] [3] Они обладают широкой специфичностью к ароматическим аминам , в частности к серотонину , а также могут катализировать перенос ацетила между ариламинами без КоА. N -ацетилтрансферазы — цитозольные ферменты, обнаруженные в печени и многих тканях большинства видов млекопитающих, за исключением собак и лисиц , которые не могут ацетилировать ксенобиотики . [4] Ацетильные группы важны для конъюгации метаболитов из печени, чтобы обеспечить выведение побочных продуктов ( метаболизм фазы II ). Это особенно важно для метаболизма и выведения лекарственных препаратов ( метаболизм лекарственных препаратов ).
Ферменты NAT отличаются наличием консервативной каталитической триады , которая благоприятствует субстратам из ароматических аминов и гидразина . [5] [6] NAT катализируют ацетилирование малых молекул посредством двойной реакции замещения, называемой реакцией пинг-понг -би-би. [5] Механизм состоит из двух последовательных реакций. [5] В реакции один ацетил-КоА первоначально связывается с ферментом и ацетилирует Cys 68. [5] В реакции два, после высвобождения ацетил-КоА , акцептор ацетила взаимодействует с ацетилированным ферментом с образованием продукта. [5] Эта вторая реакция не зависит от донора ацетила, поскольку он покидает фермент до того, как акцептор ацетила свяжется. [5] Однако , как и во многих реакциях пинг-понг-би-би, возможно, что существует конкуренция между донором ацетила и акцептором ацетила за неацетилированный фермент. [5] Это приводит к субстрат-зависимому ингибированию при высоких концентрациях. [5]

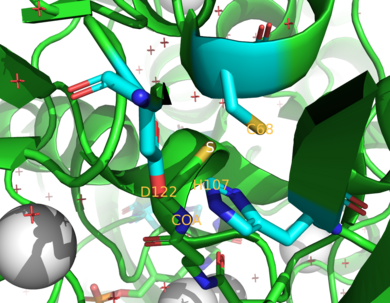
Два фермента NAT у человека — NAT1 и NAT2 . [4] Мыши и крысы экспрессируют три фермента: NAT1, NAT2 и NAT3. [4] Было обнаружено, что NAT1 и NAT2 тесно связаны у изученных до сих пор видов, поскольку два фермента разделяют 75-95% их аминокислотной последовательности . [9] [10] Оба также имеют остаток цистеина активного центра (Cys 68 ) в N-концевой области. [9] [10] Кроме того, все функциональные ферменты NAT содержат триаду каталитически важных остатков, состоящих из этого цистеина , гистидина и аспарагина . [7] Было высказано предположение, что каталитические эффекты препарата для лечения рака молочной железы цисплатина связаны с Cys 68 . [11] Инактивация NAT1 цисплатином вызвана необратимым образованием аддукта цисплатина с остатком цистеина активного центра . [11] C-конец помогает связывать ацетил-КоА и отличается среди NAT, включая прокариотические гомологи. [12]
NAT1 и NAT2 имеют различную, но перекрывающуюся субстратную специфичность. [4] Человеческий NAT1 преимущественно ацетилирует 4-аминобензойную кислоту (PABA), 4-аминосалициловую кислоту , сульфаметоксазол и сульфаниламид . [4] Человеческий NAT2 преимущественно ацетилирует изониазид (лечение туберкулеза ), гидралазин , прокаинамид , дапсон , аминоглутетимид и сульфаметазин . [4]
NAT2 участвует в метаболизме ксенобиотиков , что может привести как к инактивации лекарств , так и к образованию токсичных метаболитов , которые могут быть канцерогенными . [13] Биотрансформация ксенобиотиков может происходить в три фазы. [13] В фазе I реактивные и полярные группы вводятся в субстраты. В фазе II происходит конъюгация ксенобиотиков с заряженными видами, а в фазе III производятся дополнительные модификации с механизмами оттока, приводящими к выведению транспортерами. [13] Исследование ассоциаций по всему геному (GWAS) определило человеческий NAT2 как главный сигнал резистентности к инсулину , ключевой маркер диабета и основной фактор риска сердечно-сосудистых заболеваний [13] и, как было показано, связано с резистентностью к инсулину во всем организме у мышей с нокаутом NAT1 . [14] Считается, что NAT1 играет эндогенную роль, вероятно, связанную с фундаментальным клеточным метаболизмом. [13] Это может быть связано с тем, почему NAT1 более широко распространен среди тканей, чем NAT2. [13]
Каждый человек метаболизирует ксенобиотики с разной скоростью, что является результатом полиморфизма генов метаболизма ксенобиотиков . [13] Как NAT1, так и NAT2 кодируются двумя высокополиморфными генами, расположенными на хромосоме 8. [ 4] Полиморфизмы NAT2 были одними из первых вариаций, объясняющих эту межиндивидуальную изменчивость метаболизма лекарств . [15] Эти полиморфизмы изменяют стабильность и/или каталитическую активность ферментов, которые изменяют скорость ацетилирования лекарств и ксенобиотиков, признак, называемый фенотипом ацетилатора . [16] Для NAT2 фенотип ацетилатора описывается как медленный, промежуточный или быстрый. [17] Помимо изменения ферментативной активности, эпидемиологические исследования обнаружили связь полиморфизмов NAT2 с различными видами рака, вероятно, из-за различных канцерогенов окружающей среды . [13]
Действительно, NAT2 является высокополиморфным в нескольких человеческих популяциях. [18] Полиморфизмы NAT2 включают замены отдельных аминокислот R64Q, I114T, D122N, L137F, Q145P, R197Q и G286E. [18] Они классифицируются как медленные ацетиляторы, в то время как дикий тип NAT2 классифицируется как быстрый ацетилятор. [18] Медленные ацетиляторы, как правило, связаны с токсичностью лекарств и восприимчивостью к раку. [18] Например, генотип медленного ацетилатора NAT2 связан с повышенным риском рака мочевого пузыря , особенно среди курильщиков сигарет. [19] Однонуклеотидные полиморфизмы (SNP) NAT1 включают R64W, V149I, R187Q, M205V, S214A, D251V, E26K и I263V и связаны с генетической предрасположенностью к раку , врожденным дефектам и другим заболеваниям. [20] Эффект медленных ацетиляторных SNP в кодирующей области в основном действует через создание нестабильного белка, который агрегирует внутриклеточно перед убиквитинированием и деградацией. [3]
50% населения Великобритании имеют дефицит гепатической N -ацетилтрансферазы. Это известно как отрицательный ацетиляторный статус. Препараты, на которые это влияет:
Неблагоприятные явления, вызванные этим дефицитом, включают периферическую невропатию и гепатотоксичность . [21] Самый медленный ацетилирующий гаплотип , NAT2*5B (наиболее сильная связь с раком мочевого пузыря ), по-видимому, был выбран за последние 6500 лет у людей западной и центральной Евразии, что позволяет предположить, что медленное ацетилирование дало эволюционное преимущество этой популяции, несмотря на недавние неблагоприятные эпидемиологические данные о состоянии здоровья. [22]
Ниже приведен список человеческих генов , кодирующих ферменты N-ацетилтрансферазы: