Ингибиторы ренина — это фармацевтические препараты, ингибирующие активность ренина , который отвечает за гидролиз ангиотензиногена до ангиотензина I , [2] [3] [4] , что, в свою очередь, снижает образование ангиотензина II , который способствует повышению артериального давления . [5] [6]
Ингибитору ренина часто предшествует прямой ингибитор ренина , называемый прямым ингибитором ренина , чтобы отличить его механизм от других препаратов, влияющих на систему ренин-ангиотензин-альдостерон , таких как ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы рецепторов ангиотензина (БРА) и антагонисты рецепторов альдостерона . [6]
Эти препараты ингибируют первый и лимитирующий этап ренин -ангиотензин-альдостероновой системы (РААС), а именно превращение ангиотензиногена в ангиотензин I. Это приводит к полному отсутствию ангиотензина II на том основании, что ренин только ингибирует этот этап, в отличие от ангиотензинпревращающего фермента, который также участвует в других биохимических реакциях. С 1970-х годов ученые пытались разработать мощные ингибиторы с приемлемой биодоступностью при пероральном приеме . [7] [8] Этот процесс был трудным и занял около трех десятилетий. Первое и второе поколения столкнулись с такими проблемами, как плохая биодоступность и недостаточная эффективность. Наконец, было обнаружено третье поколение. Эти соединения были непептидными ингибиторами ренина, имели приемлемую биодоступность при пероральном приеме и были достаточно эффективными для клинического применения. Первым препаратом этого класса был алискирен , получивший одобрение на продажу в 2007 году. [7] По состоянию на июнь 2020 года [обновлять]это единственный ингибитор ренина на рынке.
В 1896 году финский физиолог Роберт Тигерстедт и шведский врач Пер Бергман провели эксперимент на почках и системе кровообращения кроликов. Они заметили, что кровяное давление у кроликов повышалось, когда экстракты почек вводили им в яремные вены . [9] [10] Они также обнаружили, что это вещество, ответственное за повышенное кровяное давление, вырабатывается в коре почек и назвали его ренином . [10] Хотя этот эксперимент заложил основу для будущих исследований пути РААС, он мало повлиял на научное сообщество в то время. [9] [11] В 1934 году, когда Голдблатт опубликовал свою работу по ишемии почек , ренин снова оказался в центре внимания. Однако важность ренина в патогенезе сердечно -сосудистых заболеваний не была полностью понята до 1970-х годов, а 20 лет спустя первые ингибиторы ренина прошли клинические испытания . [7]
Пепстатин , описанный в 1972 году, был первым синтетическим ингибитором ренина, но плохие фармакокинетические свойства не позволили ему войти в исследования in vivo . [8] [12] Ингибиторы ренина первого поколения, такие как H-142, были пептидными аналогами ангиотензиногена . [13] Однако эти ингибиторы также имели ограниченные лекарственные свойства. [7] [12] Надежды на прорыв появились в 1982 году, когда началась разработка ингибиторов ренина второго поколения. [7] Это поколение состояло из пептидоподобных соединений, таких как ремикирен , эналкарен и заникирен. [11] Они обладали скорее лекарственными, а не субстратными свойствами, и в 1990 году они прошли клинические испытания. Второе поколение имело свои ограничения и так и не завершило клинические испытания. [7]
Алискирен, единственный ингибитор ренина, прошедший III фазу клинических испытаний, структурно не связан с пептидами, что делает его ингибитором ренина третьего поколения. [7] [14] Первое клиническое исследование было проведено в 2000 году на здоровых добровольцах. [15] В 2007 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США и Европейское агентство по лекарственным средствам одобрили алискирен в качестве средства для лечения гипертонии . [7] Систематический обзор, проведенный Кокрановской группой по гипертонии, показал, что максимальная рекомендуемая доза алискирена вызывает заметное снижение артериального давления по сравнению с плацебо. [16]


Ренин -ангиотензин-альдостероновая система (РААС) играет ключевую роль в патологии сердечно-сосудистых заболеваний , артериальной гипертензии , диабетической болезни почек и сердечной недостаточности . [17] В нормальных условиях стимуляция РААС происходит в ответ на угрозы, которые ставят под угрозу стабильность артериального давления , такие как гипотония , кровопотеря и чрезмерная потеря натрия и воды. Артериальное давление зависит от общего периферического сопротивления и сердечного выброса .
Высокоселективная аспарагиновая протеаза ренин секретируется из юкстагломерулярного аппарата , который является единственным источником активного ренина [18], хотя его предшественник, проренин , может секретироваться и другими тканями , такими как слюнные железы, мозг, сердце и кровеносные сосуды. . [18] [19] [20] Ренин представляет собой циркулирующий фермент , который действует на циркулирующий пептид ангиотензиноген. [21] Ренин расщепляет пептид по связи Leu10–Val11, и эта реакция является определяющей стадией RAAS. [22] Это приводит к образованию продукта ангиотензина I (Ang I), который представляет собой декапептид . Ang I расщепляется ангиотензинпревращающим ферментом (АПФ) до активного октапептида ангиотензина II (Ang II), который является основным эффектором РААС. [21] Ang II стимулирует задержку натрия в почках; способствует секреции альдостерона ; вызывает вазоконстрикцию и повышает активность симпатической нервной системы . [20] [23] Ang II также обеспечивает отрицательную обратную связь с системой, ингибируя высвобождение ренина юкстагломерулярным аппаратом. [23] Ang II взаимодействует по крайней мере с двумя классами рецепторов Ang II , AT1 и AT2 . [20] Этот механизм, который действует от ренина через Анг II и к альдостерону, а также отрицательная обратная связь, которую Анг II оказывает на секрецию ренина, известен как РААС. [23] Конечным эффектом является повышение артериального давления, которое в нормальной физиологии необходимо для поддержания гомеостаза .
Предполагается, что эссенциальная гипертензия, гетерогенное заболевание, долгосрочными последствиями которого могут быть повреждения органов-мишеней , может, по крайней мере, в некоторых случаях, включать гиперактивность этой системы, которой пытаются противостоять несколько типов лекарств. [21] Концентрация ренина в плазме крови имеет тенденцию быть выше у молодых людей с гипертонией, когда вазоконстрикция может быть основной причиной высокого кровяного давления. И наоборот, уровень ренина ниже у пожилых людей или у людей афроамериканского или африканского карибского происхождения, когда задержка соли может в большей степени способствовать повышению артериального давления. [21] Однако роль уровня ренина в плазме в этиологии и лечении гипертонии оспаривается. [24]
Ингибиторы ренина связываются с активным центром ренина и ингибируют связывание ренина с ангиотензиногеном, что является определяющим этапом каскада РААС. [21] Следовательно, ингибиторы ренина предотвращают образование Ang I и Ang II. Ингибиторы ренина могут также предотвращать образование Ang-(1-7), Ang-(1-9) и Ang-(1-5), [25] , хотя неизвестно, имеет ли это клиническое значение. Ренин высокоселективен в отношении своего единственного природного субстрата , которым является ангиотензиноген, и случаи нежелательных побочных эффектов при приеме ингибиторов ренина нечасты. [26] и аналогичны антагонистам рецепторов ангиотензина II . [27] Ang II также действует в РААС как отрицательная обратная связь, подавляя дальнейшее высвобождение ренина. Снижение уровня Ang II или блокада рецепторов ангиотензина подавляет петлю обратной связи и приводит к повышению концентрации ренина в плазме (PRC) и активности ренина в плазме (PRA). Это может быть проблематичным при терапии ингибиторами АПФ и антагонистами рецепторов ангиотензина II, поскольку увеличение PRA может частично преодолеть фармакологическое ингибирование каскада РААС. Поскольку ингибиторы ренина напрямую влияют на активность ренина, снижение PRA, несмотря на увеличение PRC (из-за потери отрицательной обратной связи), может быть клинически выгодным. [28]
Пепстатин был первым синтетическим ингибитором ренина. Он имеет микробное происхождение и представляет собой N-ацил-пентапептид, точнее: изовалерил-L-валил-L-валил-статил-L-аланил-статин. [8] [29] Было обнаружено, что пепстатин является мощным конкурентным ингибитором большинства аспарагиновых протеаз, но слабым ингибитором ренина. [30] Первоначально считалось, что он эффективен при лечении язв двенадцатиперстной кишки , и прошел клинические испытания, но безуспешно. [31] [32] Статин , аминокислота , считается ответственной за ингибирующую активность пепстатина, поскольку он имитирует тетраэдрическое переходное состояние пептидного катализа . [33] Из-за гидрофобных свойств статина пепстатин имеет очень низкую растворимость в физиологических средах. [34] Поскольку он имел низкую эффективность и плохую растворимость, он не участвовал в исследованиях in vivo.

Это поколение состоит из двух групп соединений: либо пептидных аналогов просегмента ренина [35] , либо пептидных аналогов аминоконцевой части субстрата ангиотензиногена. [13] [36] [37] Препараты последней группы оказались эффективными в ингибировании активности ренина и снижении артериального давления как у животных, так и у людей. [38] К сожалению, их пришлось вводить парентерально из-за плохой биодоступности. Также оказалось, что они имеют короткую продолжительность действия, низкую эффективность и неадекватную способность снижать кровяное давление. Ни один из этих препаратов не прошел клинических исследований. [28]

Соединения этого поколения были более мощными, более стабильными и имели более длительную продолжительность действия. Один из них, CGP2928, пептидомиметик , был первым ингибитором ренина, эффективным при пероральном приеме. Протестировано на игрунках , оно оказалось активным только в высоких дозах. [12] Разработка новых препаратов второго поколения продолжала улучшать фармакокинетические свойства. Затем были открыты Ремикирен, эналкарен и занкирен. Это были пептидомиметические ингибиторы с улучшенной структурой, которая делала их более специфичными, мощными и стабильными. К сожалению, клиническая разработка была прекращена, поскольку препараты имели плохую биодоступность при пероральном приеме (плохо всасывались и быстро метаболизировались), а активность, снижающая артериальное давление, все еще оставалась низкой. [7] [22] [28]
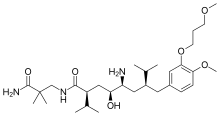
Алискирен , перорально активный непептидный ингибитор ренина, был первым препаратом своего класса на рынке. Применяется для лечения артериальной гипертензии в виде монотерапии или в сочетании с другими антигипертензивными средствами. [7] [39] Ключом к открытию алискирена стали методы кристаллографии и молекулярного моделирования . Теперь найдено решение проблемы, которая препятствовала разработке ингибиторов ренина предыдущих поколений. Известно, что непептидные вещества способны решить проблемы плохих фармакокинетических свойств и низкой специфичности. Это привело к созданию небольших молекул, непептидных ингибиторов, которые были очень мощными и специфичными в отношении ренина человека. [22] [40]
Однако из-за своей химической структуры даже ингибиторы ренина третьего поколения трудно резорбируются организмом человека, и их пероральная биодоступность часто составляет менее 2%.
Молекула ренина представляет собой моноспецифический фермент, принадлежащий к семейству аспарагиновых протеаз. [41] Его структура сложна и состоит из двух гомологичных долей, которые складываются преимущественно в конформацию β-листа . [22] Между двумя долями, глубоко внутри фермента, находится активный центр , и его каталитическая активность обусловлена двумя остатками аспарагиновой кислоты (Asp32 и Asp 215, по одному от каждой доли в молекуле ренина). [42] Гибкий лоскут из аминокислот, образованный в β-шпильке, закрывает активный сайт, закрывая расщелину. [43] Молекула ренина содержит как гидрофобные, так и гидрофильные аминокислоты. Гидрофильные, как правило, находятся снаружи молекулы, тогда как гидрофобные, как правило, находятся внутри и образуют активный центр, большую гидрофобную полость [44] , в которой может разместиться лиганд , по крайней мере, с семью остатками. Основная связь между лигандом и ферментом осуществляется посредством водородной связи . Остатки названы в соответствии с их местами в лиганде, остатки, ближайшие к сайту расщепления, называются P1 и P1', и они связываются с карманами S1 и S1' соответственно. Имеется четыре S-кармана и три S'-кармана (таблица 1). Карманы чередуются по обе стороны основной цепи лиганда. Это чередование влияет на ориентацию карманов, в результате чего карманы S3 и S1 располагаются вместе, а карман S2 находится рядом с карманами S4 и S1'. [43] Имеющиеся данные свидетельствуют о том, что близко расположенные карманы S1 и S3 сливаются, образуя просторный суперкарман. [45] Лиганды, которые заполняют суперкарман, обладают большей эффективностью, чем те, которые этого не делают, занимая их, эффективность увеличивается в 200 раз. Эти лиганды могут быть разнообразными по структуре и образовывать ван-дер-ваальсовые связи с поверхностью суперкармана. [11] От кармана S3 тянется участок связывания, отличный от ренина, субкарман S3 sp . [41] Субкарман S3 sp может вмещать как гидрофобные, так и полярные остатки, карман может вмещать три молекулы воды, но также имеет липофильную природу. S3 спПодкарман не является конформационно гибким, поэтому остатки, занимающие карман, должны обладать определенными характеристиками. Они не могут быть стерически требовательными и должны иметь достаточно большое количество вращающихся связей и быть способными соединяться с помощью водородных связей. Карман S2 большой, двудольный и гидрофобный, но может вмещать как гидрофобные, так и полярные лиганды. Это разнообразие возможных полярностей дает остатку P2 возможность варьировать его соединение с ферментом. Субкарманы S3-S1 и S3 sp были основной целью разработки лекарств, но недавние открытия указали на другие места, представляющие интерес. Было доказано, что взаимодействие с карманами на сайте S' имеет решающее значение для аффинности , особенно с S1' и S2', а тесты in vitro показали, что взаимодействие с областью лоскута может быть важным для аффинности. [11]

Взаимодействие с обеими аспарагиновыми кислотами в активном центре приводит к более высокому сродству. Более высокое сродство также приводит к занятию более активных карманов сайта. Однако некоторые карманы способствуют сближению больше, чем другие. Гидрофобное взаимодействие с sp- субкарманом S3, S1 и S3 способствует более высокой эффективности и сродству. [47] Наличие большого ароматического остатка в P3 увеличивает ингибирующую активность. [48] Оккупация субкармана S3 sp может увеличить эффективность в 50 раз и привести к прочному связыванию. [11]
Пример связывания с ингибитором ренина: Алискирен представляет собой пептидоподобный ингибитор ренина и, в отличие от большинства, довольно гидрофильен. Он блокирует каталитическую функцию фермента, занимая карманы от S3 до S2', за исключением кармана S2. Алискирен также связывается с подкарманом S3 sp , и поскольку этот карман отличен от ренина, алискирен не ингибирует другие аспарагиновые протеазы, такие как катепсин D и пепсин . [46] Боковая цепь алискирена идеально связывается с подкарманом S3 sp и делает его ингибитором ренина человека. [11] Гидроксильная группа в алискирене образует водородную связь с обоими атомами кислорода Asp 32. Аминная группа образует водородную связь с группой карбоновой кислоты Gly 217 и атомом кислорода Asp32. Метоксигруппа ароматического кольца заполняет карман S3 и, возможно, образует водородную связь с вторичной аминогруппой Tyr 14. Амидная группа образует водородную связь с вторичной аминогруппой Ser 76. [47] S1 и S1. 'карманы заняты двумя пропильными группами в положениях P1 и P1'. [45] Концевой амид в положении P2' закрепляет амидный хвост в активном центре путем образования водородной связи с Arg 74 в кармане S2'. [49]
Алискирен эффективен в снижении артериального давления, [7] [28], но по состоянию на 20 апреля 2012 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) выпустило предупреждение о возможных рисках при использовании алискирена или лекарств от артериального давления, содержащих алискирен, с ингибиторами АПФ и рецептором ангиотензина. блокаторы (БРА) у пациентов с диабетом или нарушением функции почек. Они посоветовали не использовать такие комбинации препаратов у пациентов с диабетом из-за риска возникновения почечной недостаточности, гипотонии и гиперкалиемии , а также не следует использовать алискирен с БРА или ингибиторами АПФ у пациентов с умеренной и тяжелой почечной недостаточностью (т.е. где скорость клубочковой фильтрации [СКФ] < 60 мл/мин). Тем не менее, они также рекомендуют пациентам не прекращать прием алискирена без консультации с медицинским работником. [50]
Алискирен в сочетании с гидрохлоротиазидом был одобрен FDA в 2008 году под торговым названием Tekturna HCT. [51] [52]
В 2007 году компании Actelion/Merck и Speedel объявили, что проводят клинические исследования следующего поколения ингибиторов ренина. Ведущее соединение от Actelion/Merck вступило во II фазу испытаний. Одно соединение от Speedel, SPP635, завершило фазу IIa. Результаты показали, что он безопасен и хорошо переносится в течение четырехнедельного периода, а также снижает артериальное давление на 9,8–17,9 мм рт. ст. В 2008 году SPP635 продолжал разработку фазы II лечения гипертонии у пациентов с диабетом . Еще больше ингибиторов ренина от Speedel проходят клинические испытания. Два из них, SPP1148 и SPP676, вступили в фазу I. Остальные находятся на доклинических стадиях — соединение SPP1234 и соединения серии SPP800. [51]
Следующее поколение ингибиторов ренина продемонстрировало потенциальные улучшения по сравнению с предыдущими поколениями: биодоступность у людей увеличилась до 30%, и они лучше распределяются в тканях . [51] [ ненадежный источник ]