Реакция Соногаширы — это реакция кросс-сочетания , используемая в органическом синтезе для образования связей углерод-углерод . Она использует палладиевый катализатор , а также медный сокатализатор для образования связи углерод-углерод между терминальным алкином и арилом или винилгалогенидом . [1]
Реакция кросс-сочетания Соногаширы применяется в самых разных областях из-за ее полезности в образовании углерод-углеродных связей. Реакцию можно проводить в мягких условиях, например, при комнатной температуре, в водной среде и с мягким основанием, что позволило использовать реакцию кросс-сочетания Соногаширы в синтезе сложных молекул. Ее применение включает фармацевтические препараты, натуральные продукты, органические материалы и наноматериалы . [1] Конкретные примеры включают ее использование в синтезе тазаротена , [ 2] который является средством для лечения псориаза и акне , и в приготовлении SIB-1508Y, также известного как альтиниклин , [ 3] агониста никотиновых рецепторов .
Реакция алкинилирования арилгалогенидов с использованием ароматических ацетиленов была описана в 1975 году в трех независимых работах Кассара [4] , Дика и Хека [5], а также Соногаширы , Тохды и Хагихары. [6] Во всех реакциях используются палладиевые катализаторы для получения одних и тех же продуктов реакции. Однако протоколы Кассара и Хека выполняются исключительно с использованием палладия и требуют жестких условий реакции (т. е. высоких температур реакции). Использование медного сокатализатора в дополнение к палладиевым комплексам в процедуре Соногаширы позволило проводить реакции в мягких условиях реакции с превосходными выходами. Затем последовало быстрое развитие систем Pd/Cu, что позволило найти множество синтетических применений, в то время как условия Кассара-Хека были оставлены, возможно, несправедливо, почти забытыми. [7] Замечательная полезность реакции может быть подтверждена количеством исследований, которые все еще проводятся для понимания и оптимизации ее синтетических возможностей, а также для использования процедур для приготовления различных соединений синтетического, медицинского или материального/промышленного значения. [7] Среди реакций кросс-сочетания она следует по количеству публикаций сразу после реакции Сузуки и Хека [8] , а поиск термина «Соногашира» в SciFinder дает более 1500 ссылок на журнальные публикации за период с 2007 по 2010 год. [7]
Реакция Соногаширы стала настолько известной, что часто все реакции, в которых для связывания алкиновых мотивов используются современные металлоорганические катализаторы, называют некоторыми вариантами «реакции Соногаширы», несмотря на то, что эти реакции не проводятся в истинных условиях реакции Соногаширы. [7]
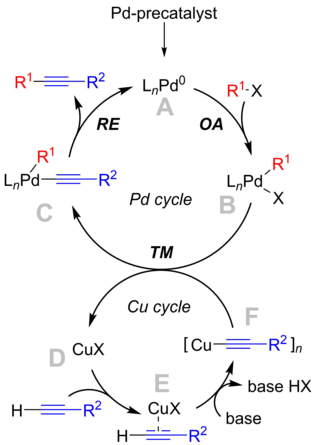
Механизм реакции до конца не изучен, но учебник описывает механизм, вращающийся вокруг палладиевого цикла, который согласуется с «классическим» механизмом перекрестного сочетания , и медного цикла, который менее известен. [9]
Хотя использование солей меди в «классической» реакции Соногаширы полезно для эффективности реакции, оно сопровождается рядом недостатков, таких как применение экологически небезопасных реагентов, образование нежелательного гомосочетания алкинов ( побочные продукты Глейзера ) и необходимость строгого исключения кислорода в реакционной смеси. Таким образом, с целью исключения меди из реакции было предпринято много усилий для разработки реакции Соногаширы без Cu. Наряду с разработкой новых условий реакции многие экспериментальные и вычислительные исследования были сосредоточены на выяснении механизма реакции. [12] До недавнего времени точный механизм, по которому происходит реакция без Cu, был предметом дискуссий, при этом критические механистические вопросы оставались без ответа. [7] В 2018 году Кошмрль и др. показали, что реакция протекает по двум взаимосвязанным каталитическим циклам Pd0 /PdII . [ 13] [14]
Было показано, что амины конкурируют с фосфинами и также могут участвовать в качестве лигандов L в описанных видах реакции. В зависимости от скорости конкуренции между амином и фосфинами, ожидается динамическое и сложное взаимодействие при использовании различных координационных оснований. [15] [16] [13] [14]
Реакция Соногаширы обычно протекает в мягких условиях. [17] Кросс-сочетание проводится при комнатной температуре с основанием, обычно амином, таким как диэтиламин , [6] , который также действует как растворитель. Реакционная среда должна быть основной, чтобы нейтрализовать галогеноводород, образующийся как побочный продукт этой реакции сочетания, поэтому в качестве растворителей иногда используют алкиламиновые соединения, такие как триэтиламин и диэтиламин , но в качестве растворителя также можно использовать ДМФА или эфир. Иногда используются и другие основания, такие как карбонат калия или карбонат цезия. Кроме того, для реакций сочетания Соногаширы формально необходимы деаэрированные условия, поскольку комплексы палладия (0) нестабильны на воздухе, а кислород способствует образованию гомосвязанных ацетиленов. В последнее время разработка устойчивых на воздухе органопалладиевых катализаторов позволяет проводить эту реакцию в окружающей атмосфере. Кроме того, Р. М. Аль-Зуби и его коллеги успешно разработали метод с высокой региоселективностью для производных 1,2,3-тригалогенарена с хорошими и высокими выходами в условиях окружающей среды. [18]
Обычно для этой реакции требуются два катализатора: комплекс палладия с нулевой валентностью и соль галогенида меди(I). Обычные примеры палладиевых катализаторов включают те, которые содержат фосфиновые лиганды , такие как [Pd(PPh 3 ) 4 ] . Другим часто используемым источником палладия является [ Pd(PPh 3 ) 2 Cl 2 ] , но также использовались комплексы, содержащие бидентатные фосфиновые лиганды , такие как [Pd( dppe )Cl 2 ] , [Pd( dppp )Cl 2 ] и [Pd(dppf)Cl 2 ] . [9] Недостатком таких катализаторов является необходимость высоких загрузок палладия (до 5 мол. %), а также большего количества медного сокатализатора. [9] Комплексы Pd II фактически являются предварительными катализаторами , поскольку они должны быть восстановлены до Pd 0, прежде чем может начаться катализ. Комплексы Pd II обычно демонстрируют большую стабильность, чем комплексы Pd 0 , и могут храниться в обычных лабораторных условиях в течение месяцев. [19] Катализаторы Pd II восстанавливаются до Pd 0 в реакционной смеси амином , фосфиновым лигандом или другим реагентом в смеси, позволяя реакции протекать. [20] Например, окисление трифенилфосфина до оксида трифенилфосфина может привести к образованию Pd 0 in situ при использовании [Pd(PPh 3 ) 2 Cl 2 ] .
Соли меди(I), такие как CuI , реагируют с терминальным алкином и производят ацетилид меди(I), который действует как активированный вид для реакций сочетания. Cu(I) является сокатализатором в реакции и используется для увеличения скорости реакции. [7]
Выбор арилгалогенидного или псевдогалогенидного субстрата (sp2 - углерод) является одним из факторов, которые в основном влияют на реакционную способность каталитической системы Соногаширы. Реакционная способность галогенидов выше по отношению к иоду, а винилгалогениды более реакционноспособны, чем аналогичные арилгалогениды. Связывание арилиодидов происходит при комнатной температуре, тогда как арилбромиды требуют нагревания.
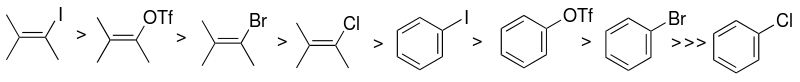
Это различие в реакционной способности можно использовать для селективного связывания арилиодида, но не арилбромида, проводя реакцию при комнатной температуре. [9] Примером является симметричное связывание Соногаширы двух эквивалентов 1-бром-4-иодбензола с триметилсилилацетиленом (с удалением триметилсилильной группы in situ ) с образованием бис(4-бромфенил)ацетилена. [21]
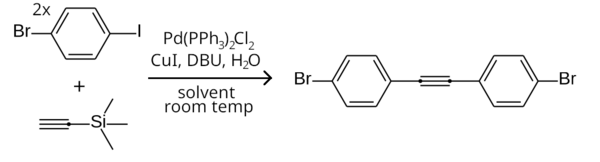
Вместо арилгалогенидов можно также использовать арилтрифлаты.
Соли арендиазония были описаны как альтернатива арилгалогенидам для реакции сочетания Соногаширы. Хлорид золота(I) использовался в качестве сокатализатора в сочетании с хлоридом палладия(II) в сочетании солей арендиазония с терминальными алкинами, процесс, осуществляемый в присутствии хлорида бис-2,6-диизопропилфенилдигидроимидазолия (IPr NHC) (5 мол.%) для in situ образования комплекса NHC-палладий и 2,6-ди-трет-бутил-4-метилпиридина (DBMP) в качестве основания в ацетонитриле в качестве растворителя при комнатной температуре. [22] Это сочетание может быть осуществлено, начиная с анилинов путем образования соли диазония с последующим сочетанием Соногаширы in situ , где анилины преобразуются в соль диазония и далее преобразуются в алкин путем сочетания с фенилацетиленом.
Различные ароматические алкины могут быть использованы для получения желаемых дизамещенных продуктов с удовлетворительными выходами. Алифатические алкины, как правило, менее реакционноспособны.
Из-за решающей роли основания, для протекания реакции необходимо добавлять определенные амины в избытке или в качестве растворителя. Было обнаружено, что вторичные амины, такие как пиперидин, морфолин или диизопропиламин, в частности, могут эффективно и обратимо реагировать с транс - комплексами RPdX(PPh 3 ) 2 путем замены одного лиганда PPh 3. Константа равновесия этой реакции зависит от R, X, фактора основности и стерических препятствий амина. [23] Результатом является конкуренция между амином и алкиновой группой за этот обмен лигандами, поэтому амин обычно добавляют в избытке, чтобы способствовать предпочтительному замещению.
Триметилсилилацетилен является широко используемым реагентом в реакциях Соногаширы. [24] Будучи жидкостью, он является более удобным реагентом, чем газообразный ацетилен , а триметилсилильная группа предотвращает присоединение к другому концу ацетиленовой группы. Затем триметилсилильная группа может быть удалена с помощью TBAF , что дает монозамещенный ацетилен. Ее также можно удалить с помощью DBU in situ, что позволяет монозамещенному ацетилену далее реагировать с другим арилгалогенидом с образованием дифенилацетилена и производных. [21]
В то время как медный сокатализатор добавляется в реакцию для повышения реакционной способности, присутствие меди может привести к образованию алкиновых димеров. Это приводит к тому, что известно как реакция сочетания Глейзера , которая является нежелательным образованием продуктов гомосочетания производных ацетилена при окислении . В результате при проведении реакции Соногаширы с медным сокатализатором необходимо проводить реакцию в инертной атмосфере, чтобы избежать нежелательной димеризации. Были разработаны варианты реакции Соногаширы без меди, чтобы избежать образования продуктов гомосочетания. [19] [25] Существуют и другие случаи, когда следует избегать использования меди, такие как реакции сочетания с участием субстратов, которые являются потенциальными медными лигандами, например, порфирины со свободным основанием . [9]
В обратной реакции Соногаширы реагентами являются арильное или винильное соединение и алкинилгалогенид. [26]
В некоторых случаях вместо CuI можно использовать стехиометрические количества оксида серебра для соединений Соногаширы без содержания меди. [9]
Недавно была разработана катализируемая никелем реакция Соногаширы, которая позволяет связывать неактивированные алкилгалогениды с ацетиленом без использования палладия, хотя медный сокатализатор все еще необходим. [27] Также сообщалось, что золото может использоваться в качестве гетерогенного катализатора, что было продемонстрировано при связывании фенилацетилена и иодбензола с катализатором Au/CeO 2 . [28] [29] В этом случае катализ происходит гетерогенно на наночастицах Au, [29] [30] с Au(0) в качестве активного центра. [31] Было также обнаружено, что селективность к желаемому продукту кросс-связывания повышается при использовании таких носителей, как CeO 2 и La 2 O 3 . [31] Кроме того, катализируемые железом реакции Соногаширы были исследованы как относительно дешевые и нетоксичные альтернативы палладию. Здесь предполагается , что FeCl 3 будет действовать как катализатор на основе переходного металла, а Cs 2 CO 3 – как основание, таким образом, теоретически реализуя механизм без палладия и меди. [32]
Хотя механизм без использования меди показал свою жизнеспособность, попытки включить различные переходные металлы, упомянутые выше, в качестве менее дорогих альтернатив палладиевым катализаторам не увенчались успехом из-за загрязнения реагентов следовыми количествами палладия, что позволяет предположить, что эти теоретические пути крайне маловероятны, если не невозможны, для реализации. [33]
Исследования показали, что органические и неорганические исходные материалы также могут содержать достаточное количество палладия ( на уровне ppb ) для связывания. [34]
Сообщалось о высокоэффективной комбинированной методологии золота и палладия для связывания по Соногашире широкого спектра электронно и структурно разнообразных арильных и гетероарильных галогенидов. [35] Ортогональная реакционная способность двух металлов показывает высокую селективность и экстремальную толерантность к функциональным группам в связывании по Соногашире. Краткое механистическое исследование показывает, что промежуточное соединение золото-ацетилид вступает в каталитический цикл палладия на этапе трансметаллирования.
Проблемы, связанные с восстановлением часто дорогостоящего катализатора после образования продукта, представляют собой серьезный недостаток для крупномасштабных применений гомогенного катализа. [9] Структуры, известные как металлодендримеры, сочетают в себе преимущества гомогенных и гетерогенных катализаторов, поскольку они растворимы и хорошо определены на молекулярном уровне, и все же их можно восстановить осаждением, ультрафильтрацией или ультрацентрифугированием. [36] Можно найти несколько недавних примеров использования дендритных комплексных катализаторов палладия для реакции Соногаширы без меди. Так, несколько поколений бидентатных фосфинпалладий(II)полиаминодендритных катализаторов использовались солюбилизированными в триэтиламине для связывания арилиодидов и бромидов при 25-120 °C, а также арилхлоридов, но с очень низким выходом. [37]

Дендримерные катализаторы обычно можно было восстановить простым осаждением и фильтрацией и повторно использовать до пяти раз, при этом наблюдалось снижение активности, вызванное разложением дендримера, а не выщелачиванием палладия. Эти дендримерные катализаторы показали отрицательный дендритный эффект; то есть эффективность катализатора снижалась по мере увеличения генерации дендримера. Вторичный полимерный фосфиновый лиганд получается из метатезисной полимеризации с раскрытием кольца производного норборнена и использовался в реакции Соногаширы, катализируемой медью, метил- п -иодбензоата и фенилацетилена с использованием Pd(dba) 2 ·CHCl3 в качестве источника палладия. [38] Несмотря на восстановление фильтрацией, каталитическая активность полимера снижалась примерно на 4-8% в каждом эксперименте по рециркуляции.
Пиридины и пиримидины показали хорошие комплексообразующие свойства для палладия и были использованы в формировании катализаторов, подходящих для реакций Соногаширы. Комплекс дипиримидил-палладия, показанный ниже, был использован в реакции без меди, сочетающей йод-, бром- и хлорбензол с фенилацетиленом с использованием N-бутиламина в качестве основания в растворителе ТГФ при 65 °C. Кроме того, все структурные особенности этого комплекса были охарактеризованы с помощью обширного рентгеноструктурного анализа, подтверждающего наблюдаемую реакционную способность. [39]
Совсем недавно был получен комплекс дипиридилпалладия, который использовался в реакции сочетания Соногаширы без меди арилиодидов и бромидов в N -метилпирролидиноне (NMP) с использованием ацетата тетра-н-бутиламмония (TBAA) в качестве основания при комнатной температуре. Этот комплекс также использовался для сочетания арилиодидов и бромидов в кипящей воде в качестве растворителя и в присутствии воздуха с использованием пирролидина в качестве основания и TBAB в качестве добавки [40], хотя его эффективность была выше в N -метилпирролидиноне (NMP) в качестве растворителя.

N -гетероциклические карбены (NHC) стали одними из самых важных лигандов в катализе переходных металлов. Успех нормальных NHC во многом объясняется их превосходными σ-донорными способностями по сравнению с фосфинами, которые еще больше у аномальных аналогов NHC. Используемые в качестве лигандов в комплексах палладия, NHC внесли большой вклад в стабилизацию и активацию прекатализаторов и поэтому нашли применение во многих областях металлоорганического гомогенного катализа, включая сопряжения Соногаширы. [9] [42] [43]
Интересные примеры аномальных NHC основаны на мезоионной структуре 1,2,3-триазол-5-илидена. Эффективный катионный палладиевый катализатор типа PEPPSI , т.е. i PEPPSI ( internal p yridine - enhanced pre catalyst preparation s stabilization and initiation ) был продемонстрирован для эффективного катализа реакции Соногаширы без меди в воде как единственном растворителе, в аэробных условиях, в отсутствие меди, аминов, фосфинов и других добавок. [42]
Недавние разработки в области гетерогенного катализа позволили использовать материалы на основе оксидов металлов, такие как нанокатализаторы на основе оксида меди, в технологиях поточной обработки, что может обеспечить экономичное производство активных фармацевтических ингредиентов и различных других тонких химикатов. [45]
Сочетания Соногаширы используются в широком спектре синтетических реакций, в первую очередь из-за их успешности в облегчении следующих сложных превращений:
Связывание терминального алкина и ароматического кольца является ключевой реакцией, когда речь идет о применении реакции Соногаширы, промотируемой медью или без нее. Список случаев, когда использовалась типичная реакция Соногаширы с использованием арилгалогенидов, велик, и выбор иллюстративных примеров затруднен. Недавнее использование этой методологии показано ниже для связывания иодированного фенилаланина с терминальным алкином, полученным из d -биотина, с использованием in situ генерируемых видов Pd0 в качестве катализатора, что позволило получить производное фенилаланина, связанное с алкином, для биоаналитических применений. [46] Существуют также примеры того, как оба партнера связывания были присоединены к аллиловым смолам, причем катализатор Pd0 осуществлял расщепление субстратов и последующее связывание Соногаширы в растворе. [47]

Многие метаболиты, встречающиеся в природе, содержат алкиновые или ениновые фрагменты, и поэтому реакция Соногаширы часто находила применение в их синтезе. [48] Несколько из самых последних и многообещающих применений этой методологии сочетания для полного синтеза природных продуктов использовали исключительно типичную реакцию, катализируемую медью.
Примером сочетания арилиодида с арилацетиленом может служить реакция иодированного спирта и трис(изопропил)силилацетилена, в результате которой образуется алкин, промежуточное соединение в общем синтезе алкалоида бензинденоазепина булгарамина. [49]

Существуют и другие недавние примеры использования арилиодидов для получения промежуточных продуктов в типичных условиях Соногаширы, которые после циклизации дают природные продукты, такие как бензилизохинолин [50] или индольные алкалоиды [51]. Примером является синтез бензилизохинолиновых алкалоидов (+)-( S ) -лауданозина и (–)-( S )-ксилопинина. Синтез этих природных продуктов включал использование кросс-сочетания Соногаширы для построения углеродного остова каждой молекулы. [50]

1,3-ениновый фрагмент является важной структурной единицей для биологически активных и природных соединений. [ необходима цитата ] Он может быть получен из виниловых систем и терминальных ацетиленов с использованием стереоспецифической процедуры сохранения конфигурации, такой как реакция Соногаширы. Винилиодиды являются наиболее реакционноспособными винилгалогенидами в реакции окислительного присоединения Pd 0 , и поэтому их использование наиболее часто для реакций кросс-сочетания Соногаширы из-за обычно более мягких условий. Вот некоторые примеры:

Универсальность реакции Соногаширы делает ее широко используемой реакцией в синтезе различных соединений. Одним из таких фармацевтических применений является синтез SIB-1508Y, который более известен как Алтиниклин . Алтиниклин является агонистом никотиновых ацетилхолиновых рецепторов , который показал потенциал в лечении болезни Паркинсона, болезни Альцгеймера, синдрома Туретта, шизофрении и синдрома дефицита внимания и гиперактивности (СДВГ). [3] [54] По состоянию на 2008 год Алтиниклин прошел клинические испытания II фазы. [55] [56]

Реакция кросс-сочетания Соногаширы может быть использована в синтезе производных имидазопиридина. [57]

{{cite journal}}: |first1=имеет общее название ( помощь )