


Карбокатион – это ион с положительно заряженным атомом углерода . Среди простейших примеров - метений CH. +
3, метан CH+
5и винил С
2ЧАС+
3катионы. Иногда встречаются также карбокатионы, несущие более одного положительно заряженного атома углерода (например, этилендикат С
2ЧАС2+
4). [1]
До начала 1970-х годов все карбокатионы назывались ионами карбония . [2] В современном определении, данном ИЮПАК, карбокатион — это любой катион с четными электронами и значительным частичным положительным зарядом на атоме углерода. Далее они подразделяются на две основные категории в зависимости от координационного числа заряженного углерода: три у ионов карбения и пять у ионов карбония . Эта номенклатура была предложена Г. А. Олахом . [3] Ионы карбония, как первоначально определил Ола, характеризуются трехцентровой двухэлектронной схемой делокализованной связи и по существу являются синонимами так называемых « неклассических карбокатионов », которые представляют собой карбокатионы, содержащие мостиковые C–C или σ-связи C–H. Однако другие более узко определили термин «ион карбония» как формально протонированные или алкилированные алканы ( CR+
5, где R представляет собой H или алкил), за исключением неклассических карбокатионов, таких как 2-норборнильный катион . [4]
Согласно ИЮПАК , карбокатион — это любой катион, содержащий четное число электронов, в котором значительная часть положительного заряда находится на атоме углерода. [5] До наблюдения Олахом и его коллегами пятикоординированных карбокатионов карбокатион и ион карбония использовались как взаимозаменяемые. Олах предложил переопределить ион карбония как карбокатион с любым типом трехцентровой двухэлектронной связи, в то время как ион карбения был недавно введен для обозначения карбокатиона, содержащего только двухцентровые двухэлектронные связи с трехкоординационным положительным углеродом. . Впоследствии другие использовали термин ион карбония более узко для обозначения видов, которые произошли (по крайней мере формально) в результате электрофильной атаки H + или R + на алкан, по аналогии с другими видами ониия основной группы , в то время как карбокатион, который содержит любой тип трехцентровой связи называется неклассическим карбокатионом . При таком использовании катион 2-норборнила не является ионом карбония, поскольку формально он образуется в результате протонирования алкена (норборнена), а не алкана, хотя из-за своей мостиковой структуры он является неклассическим карбокатионом. ИЮПАК признает три различных определения иона карбония и призывает с осторожностью использовать этот термин. В оставшейся части этой статьи термин ион карбония будет использоваться в этом последнем ограниченном смысле, в то время как неклассический карбокатион будет использоваться для обозначения любого карбокатиона с σ-связями C–C и/или C–H, делокализованными посредством мостиков.
С конца 1990-х годов в большинстве учебников перестали использоваться термин «ион карбония» для обозначения классического трехкоординационного карбокатиона. Тем не менее, в некоторых учебниках университетского уровня термин «карбокатион» продолжает использоваться, как если бы он был синонимом иона карбения [6] [7] или обсуждаются карбокатии лишь с мимолетной ссылкой на более старую терминологию ионов карбония [8] или карбений и карбоний. ионы. [9] В одном учебнике по сей день сохраняется старое название «ион карбония» для иона карбения, а для CH используется фраза « гипервалентный ион карбония».+
5. [10]
Карбокатион с двухкоординационным положительным углеродом, полученный в результате формального удаления гидрид-иона (H - ) из алкена, известен как виниловый катион . В отсутствие геометрических ограничений большинство замещенных винильных катионов несут формальный положительный заряд на sp-гидридизированном атоме углерода линейной геометрии. Двухкоординатный приблизительно sp 2 -гибридизированный катион, образующийся в результате формального удаления гидрид-иона из арена, называется арильным катионом . Эти карбокатионы относительно нестабильны (особенно арильные катионы) и встречаются нечасто. Следовательно, их часто исключают из учебников вводного и среднего уровня. Определение ИЮПАК предусматривает, что карбокатионы представляют собой разновидности с четными электронами; следовательно, катион-радикалы, такие как CH•+
4которые часто встречаются в масс-спектрометрии, не считаются карбокатионами.
История карбокатионов восходит к 1891 году, когда Г. Мерлинг [11] сообщил, что он добавил бром к тропилидену ( циклогептатриену ), а затем нагрел продукт до получения кристаллического водорастворимого вещества C.
7ЧАС
7Бр . Он не предложил для этого структуру; однако Деринг и Нокс [12] убедительно показали, что это бромид тропилия (циклогептатриенилия). Согласно правилу Хюкеля, этот ион будет ароматическим .
В 1902 году Норрис и Керман независимо друг от друга обнаружили, что бесцветный трифенилметанол дает темно-желтые растворы в концентрированной серной кислоте . Трифенилметилхлорид аналогичным образом образует оранжевые комплексы с хлоридами алюминия и олова. В 1902 году Адольф фон Байер признал солевой характер образующихся соединений. Тритилкарбокатион (показан ниже) представляет собой стабильную карбокатионную систему, которая использовалась в качестве гомогенного органокатализатора в органическом синтезе [13] , например , в форме тритилгексафторфосфата . [14]

Он назвал связь между цветом и образованием соли галохромией , ярким примером которой является малахитовый зеленый .
Карбокатионы являются реакционноспособными промежуточными соединениями во многих органических реакциях. Эта идея, впервые предложенная Юлиусом Штиглицем в 1899 году, [15] была далее развита Гансом Меервейном в его исследовании 1922 года [16] [17] перегруппировки Вагнера -Меервейна . Было также обнаружено участие карбокатионов в реакции SN 1 , реакции E1 и в реакциях перегруппировки , таких как сдвиг Уитмора 1,2 . Химический истеблишмент неохотно принимал идею карбокатионов, и долгое время Журнал Американского химического общества отказывался публиковать статьи, в которых они упоминались.
Первый ЯМР-спектр стабильного карбокатиона в растворе был опубликован Doering et al. [18] в 1958 году . Это был ион гептаметилбензола , полученный обработкой гексаметилбензола метилхлоридом и хлоридом алюминия . Стабильный 7-норборнадиенильный катион был получен Story et al. в 1960 г. [19] путем взаимодействия норборнадиенилхлорида с тетрафторборатом серебра в диоксиде серы при -80 °С. Спектр ЯМР установил, что он не имеет классических мостиков (первый наблюдаемый стабильный неклассический ион ).
В 1962 году Ола непосредственно наблюдал трет - бутилкарбокатион с помощью ядерного магнитного резонанса как стабильную разновидность при растворении трет -бутилфторида в волшебной кислоте . ЯМР норборнильного катиона впервые был описан Schleyer et al. [20] и Saunders et al. показали, что он подвергается скремблированию протонов через барьер. [21]
Ионы карбония можно рассматривать как протонированные алканы. Хотя алканы обычно считаются инертными, в сверхкислотных условиях (например, HF/ SbF 5 ) сигма-связь CH может выступать донором H + . В результате образуется разновидность, которая содержит связь 3c-2e между углеродом и двумя атомами водорода, тип связи, распространенный в химии бора, но относительно редкий для углерода. С альтернативной точки зрения связь 3c-2e ионов карбония можно рассматривать как молекулу H 2 , координированную с ионом карбения ( см. ниже ). Действительно, ионы карбония часто разлагаются за счет потери молекулярного водорода с образованием соответствующего иона карбения. Структурно ион метана CH + 5 рассчитан как имеющий минимальную энергетическую структуру симметрии C s . Однако различные возможные структуры иона близки по энергии и разделены неглубокими барьерами. Поэтому структуру иона часто называют флюксиальной . Хотя кажется, что в ионах карбония имеется пять связей с углеродом, они не являются гипервалентными , поскольку количество электронов вокруг центрального углерода составляет только восемь из-за связи 3c-2e.
Напротив, по крайней мере в формальном смысле, ионы карбения образуются в результате протонирования (присоединения H + ) или алкилирования (присоединения R + ) карбена или алкена . Таким образом, по крайней мере в одном из их резонансных изображений они обладают атомом углерода, несущим формальный положительный заряд, который окружен секстетом электронов (шестью валентными электронами ) вместо обычного октета, необходимого для заполнения валентной оболочки углерода ( правило октета). ). Следовательно, ионы карбения (и карбокатионы в целом) часто являются реактивными, стремясь заполнить октет валентных электронов, а также восстановить нейтральный заряд . В соответствии с VSEPR и правилом Бента , если геометрически не ограничено пирамидальной формой (например, 1-адамантильный катион), 3-координационные ионы карбения обычно являются тригонально-планарными, с пустой орбиталью чистого p-символа в качестве нижней незанятой молекулярной орбитали (LUMO) и Связи CH/CC образуются из орбиталей C(sp 2 ). Прототипическим примером является метиловый катион CH + 3 . По тем же причинам двухкоординационные карбокатионы (виниловые катионы) обычно имеют линейную геометрию, со связями CH/CC, образованными из орбиталей C (sp).

Алкилзамещенные карбокатионы по стабильности следуют порядку 3° > 2° > 1° > метила , о чем можно судить по значениям сродства к гидрид-иону (231, 246, 273 и 312 ккал/моль для (CH 3 ) 3 C + , (СН 3 ) 2 СН + , СН 3 СН + 2 и СН + 3 ). [22] Эффект алкилзамещения является сильным: третичные катионы стабильны, и многие из них непосредственно наблюдаются в суперкислотных средах, но вторичные катионы обычно временны, и в растворе наблюдаются только изопропильные, втор -бутильные и циклопентильные катионы. [23] Редко имеется какое-либо экспериментальное подтверждение существования первичных карбокатионов в фазе раствора, даже в качестве временных промежуточных продуктов (этиловый катион был предложен для реакций в 99,9% серной кислоте и в FSO 2 OH·SbF 5 ), [24] и метиловом катионе. катион однозначно идентифицирован только в газовой фазе. В большинстве, если не во всех случаях, основное состояние предполагаемых первичных карбокатионов состоит из мостиковых структур, в которых положительный заряд разделяется двумя или более атомами углерода, и их лучше описывать как алкены, протонированные по бокам, протонированные по краям циклопропаны или протонированные по углам. циклопропаны, а не истинные первичные катионы. [25] [26] Даже простой этильный катион C 2 H + 5 был продемонстрирован экспериментально и расчетно как мостиковый [27] и его можно рассматривать как симметрично протонированную молекулу этилена. То же самое верно и для высших гомологов, таких как 1-пропил и 1-бутил-катионы. [28] Считается, что производные неопентила ионизируются с сопутствующей миграцией метильной группы ( анхимерная помощь ); таким образом, считается, что в большинстве, если не во всех случаях, дискретный неопентильный катион не участвует. [29]
Стабилизация алкильными группами объясняется гиперконъюгацией . [30] Передача электронной плотности от связи β CH или CC на незанятую p-орбиталь карбокатиона (σ CH/CC → p-взаимодействие) позволяет делокализовать положительный заряд.
По сродству к гидрид-иону материнский винильный катион менее стабилен, чем даже первичный sp 2 -гибридизированный карбокатион, в то время как α-алкилзамещенный виниловый катион обладает стабильностью, сравнимой с последним. Следовательно, виниловые катионы являются относительно редкими промежуточными соединениями. Они могут быть получены путем ионизации винилового электрофила при условии, что уходящая группа достаточно хорошая (например, TfO - , IPh или N 2 ). Они участвуют в качестве промежуточных продуктов в некоторых реакциях винильного замещения (обозначенных как SN 1 (винил)) и в качестве промежуточных продуктов в реакциях электрофильного присоединения арилалкинов. За исключением исходного винилового катиона, который, как полагают, представляет собой мостиковую разновидность, и геометрически ограниченных циклических виниловых катионов, большинство виниловых катионов подвергаются sp-гибридизации и являются линейными.
Арильные катионы более нестабильны, чем виниловые катионы, из-за вызванного кольцом искажения нелинейной геометрии и примерно sp 2 -характера незанятой орбитали. Только N 2 в солях арилдиазония является достаточно хорошей уходящей группой для химического образования арильных катионов. [31]
Алкинильные катионы крайне нестабильны, гораздо менее стабильны, чем даже CH.+
3(сродство к гидрид-иону 386 ккал/моль против 312 ккал/моль для CH+
3) и не может быть получен чисто химическими средствами. Однако они могут быть получены радиохимическим путем посредством бета -распада трития : [32]

Что касается реакционной способности, карбокатионы подвержены атаке нуклеофилов , таких как вода, спирты, карбоксилаты, азид и галогенид-ионы, с образованием продукта присоединения. Сильноосновные нуклеофилы, особенно затрудненные, предпочитают отщепление, а не присоединение. Поскольку даже слабые нуклеофилы будут реагировать с карбокатионами, большинство из них можно непосредственно наблюдать или выделить только в ненуклеофильных средах, таких как суперкислоты . [33]

Карбокатионы обычно подвергаются реакциям перегруппировки из менее стабильных структур в столь же стабильные или более стабильные путем миграции алкильной группы или водорода к катионному центру с образованием нового карбокатионного центра. [34] Это часто происходит с константами скорости , превышающими 10 10 с -1 при температуре окружающей среды, и все еще происходит быстро (по сравнению с временной шкалой ЯМР) при таких низких температурах, как -120 ° C ( см . сдвиг Вагнера-Меервейна ). В особенно благоприятных случаях, таких как 2-норборнильный катион, водородные сдвиги все еще могут происходить с достаточно высокой скоростью, чтобы мешать рентгеновской кристаллографии при 86 К (-187 ° C). [35] Обычно карбокатионы перегруппировываются с образованием третичного изомера. Например, все изомеры C 6 H + 11 быстро перегруппировываются с образованием 1-метил-1-циклопентильного катиона. Этот факт часто усложняет синтетические пути. Например, при нагревании 3-пентанола с водной HCl первоначально образовавшийся 3-пентилкарбокатион перегруппировывается в статистическую смесь 3-пентила и 2-пентила. Эти катионы реагируют с ионами хлорида с образованием примерно одной трети 3-хлорпентана и двух третей 2-хлорпентана. Алкилирование Фриделя-Крафтса страдает этим ограничением; по этой причине чаще применяется ацилирование (с последующим восстановлением Вольфа-Кишнера или Клемменсена с получением алкилированного продукта).

Карбокатион может быть стабилизирован резонансом двойной связи углерод-углерод или неподеленной парой гетероатома, соседнего с ионизированным углеродом. Чтобы карбокатион был резонансно стабилизирован, молекулярная орбиталь донорной группы должна иметь правильную симметрию, ориентацию и энергетический уровень для взаимодействия с пустой 2p-орбиталью карбокатиона. Такие катионы, как аллильный катион CH 2 =CH-CH + 2 и бензильный катион C 6 H 5 -CH + 2, более стабильны, чем большинство других карбокатионов за счет передачи электронной плотности от π-систем катионному центру. [36] Кроме того, карбокатионы, присутствующие в ароматических молекулах, особенно стабилизированы, в основном за счет делокализованных π-электронов, характерных для ароматических колец. [37] Молекулы, которые могут образовывать аллил- или бензилкарбокатионы, особенно реакционноспособны. Эти карбокатионы, в которых C + соседствует с другим атомом углерода, имеющим двойную или тройную связь, обладают дополнительной стабильностью из-за перекрытия пустой p-орбитали карбокатиона с p-орбиталями π-связи. Такое перекрытие орбиталей позволяет рассеивать положительный заряд и распределять электронную плотность из π-системы с центром с дефицитом электронов, что приводит к стабилизации. Особенно стабильны дважды- и трибензильные карбокатионы, дифенилкарбениевый и трифенилкарбениевый (тритиловый) катионы. По тем же причинам частичный p-характер напряженных связей C–C в циклопропильных группах также позволяет жертвовать электронную плотность [38] и стабилизировать циклопропилметильный (циклопропилкарбинильный) катион.
Порядок стабильности карбокатионов, от наиболее стабильного до наименее стабильного, что отражается значениями сродства к гидрид-иону (HIA), следующий (значения HIA в ккал/моль в скобках):
Как отмечалось в разделе истории, катион тропилия ( C 7 H + 7 ) был одним из первых открытых карбокатионов благодаря своей ароматической стабильности. Этот карбокатион настолько стабилизирован, что его молекулу можно выделить и продать в виде соли. С другой стороны, антиароматический циклопентадиенильный катион ( C 5 H + 5 ) дестабилизирован примерно на 40 ккал/моль. Катион циклопропения ( C 3 H + 3 ), хотя и несколько дестабилизирован угловой деформацией, все же явно стабилизирован по ароматичности по сравнению со своим аналогом с открытой цепью, аллильным катионом. Эти различные стабильности катионов, в зависимости от количества π-электронов в кольцевой системе, могут, кроме того, быть решающими факторами в кинетике реакции. Образование ароматического карбокатиона происходит намного быстрее, чем образование антиароматического карбокатиона или карбокатиона с открытой цепью. Учитывая роль карбокатионов во многих реакционных схемах, таких как, например, S N 1 , выбор конъюгации исходных материалов может быть мощным методом придания кинетической благоприятности или неблагоприятности, поскольку константа скорости для любой данной стадии зависит от активации стадии. энергия по уравнению Аррениуса .

Эффект гиперконъюгации является сильным стабилизирующим для карбокатионов: гиперконъюгирование с алкильными заместителями часто является таким же или даже более стабилизирующим, чем конъюгирование с π-системой. Хотя конъюгация с ненасыщенными группами приводит к значительной стабилизации за счет мезомерного эффекта (резонанса), польза частично нивелируется наличием более электроотрицательного sp 2 или sp углерода рядом с карбокатионным центром. Таким образом, как показывает сродство к гидрид-иону, вторичный карбокатион более стабилен, чем аллильный катион, в то время как третичный карбокатион более стабилизирован, чем бензильный катион — результаты, которые на первый взгляд могут показаться нелогичными.
Ионы оксокарбения и иминия имеют важные вторичные канонические формы (резонансные структуры), в которых углерод несет положительный заряд. По существу, они являются карбокатионами согласно определению ИЮПАК, хотя некоторые химики не считают их «настоящими» карбокатионами, поскольку их наиболее важные вкладчики в резонанс несут формальный положительный заряд на атоме кислорода или азота соответственно.
Некоторые карбокатионы, такие как 2-норборнильный катион, демонстрируют более или менее симметричную трехцентровую двухэлектронную связь. Такие структуры, называемые неклассическими карбокатионами , включают делокализацию связей, входящих в σ-каркас молекулы, в результате чего образуются связи C–C и C–H дробного порядка связи. [39] [40] Эта делокализация приводит к дополнительной стабилизации катиона. Например, 2-норборнильный катион, изображенный как классический ион карбения, по-видимому, является вторичным карбокатионом. Однако он более стабилен, чем типичный «вторичный» карбокатион, и примерно так же стабилен, как третичный карбокатион, такой как трет -бутил-катион, в зависимости от сродства к гидрид-иону.
Существование неклассических карбокатионов когда-то было предметом больших споров. На противоположных сторонах стоял Герберт К. Браун , который считал, что то, что казалось неклассическим карбокатионом, представляет собой среднее значение двух быстро уравновешивающихся классических видов (или, возможно, двух структур, демонстрирующих некоторую степень мостиков или наклонов, но, тем не менее, не симметричных) и что истинная неклассическая структура — это переходное состояние между двумя минимумами потенциальной энергии, и Сол Уинштейн , который считал, что неклассическая структура, обладающая плоскостью симметрии, является единственным минимумом потенциальной энергии и что классические структуры — это всего лишь два способствующих резонанса. формы этого неклассического вида. Открытие Джорджем Олахом сверхкислотных сред, позволяющих непосредственно наблюдать карбокатионы, а также очень чувствительный метод ЯМР, разработанный Мартином Сондерсом для различения этих двух сценариев, сыграли важную роль в разрешении этого противоречия. [41] [42] По крайней мере, в отношении самого 2-норборнильного катиона спор был разрешен в подавляющем большинстве в пользу Уинштейна, без каких-либо признаков предполагаемых взаимопревращающихся классических частиц, даже при таких низких температурах, как 6 К, и кристаллической структуры 2013 года. демонстрируя явно неклассическую структуру. [43] [35] В настоящее время считается , что различные карбокатионы (например, этиловый катион, см. выше ) принимают неклассические структуры. Однако во многих случаях разница в энергии между двумя возможными «классическими» структурами и «неклассической» очень мала, и экспериментально отличить эти две возможности может быть трудно.
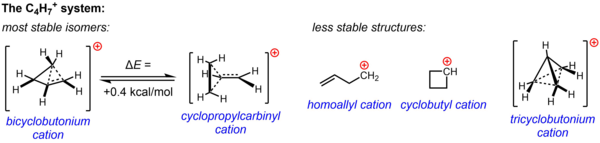
Неклассическая структура для C
4ЧАС+
7подтверждается существенными экспериментальными данными из экспериментов по сольволизу и исследований ЯМР, проведенных в ненуклеофильных средах. Одна или обе из двух структур, катион циклопропилкарбинила и катион бициклобутония, использовались для объяснения наблюдаемой реакционной способности в различных экспериментах, в то время как данные ЯМР указывают на сильно текучую систему, которая претерпевает быструю перегруппировку, давая усредненный спектр, состоящий только из двух Сигналы ЯМР 13 C даже при таких низких температурах, как -132 ° C. Расчетами было подтверждено, что энергетический ландшафт C
4ЧАС+
7Система очень плоская, и что два изомера, постулированные на основе экспериментальных данных, очень близки по энергии, при этом структура бициклобутония, по расчетам, всего на 0,4 ккал / моль более стабильна, чем структура циклопропилкарбинила. В фазе раствора (SbF 5 ·SO 2 ClF ·SO 2 F 2 , при этом SbF–
6в качестве противоиона) структура бициклобутония преобладает над структурой циклопропилкарбинила в соотношении 84:16 при -61 ° C.
Теперь известно, что три другие возможные структуры, две классические структуры (гомоаллильный катион и циклобутиловый катион) и более делокализованная неклассическая структура (ион трициклобутония), являются менее стабильными изомерами (или просто переходным состоянием, а не минимумом энергии). в случае циклобутильного катиона). [44]
Замещенные циклопропилкарбинильные катионы также были изучены методом ЯМР: [45] [46]
В спектре ЯМР диметилпроизводного обнаруживаются два неэквивалентных сигнала для двух метильных групп, что указывает на то, что молекулярная конформация этого катиона не перпендикулярна (как в А), имеющая зеркальную плоскость, а разделена пополам (как в Б). ) с пустой p-орбиталью, параллельной циклопропильной кольцевой системе:
С точки зрения теории изогнутых связей это предпочтение объясняется предположением о благоприятном перекрытии орбиталей между заполненными изогнутыми связями циклопропана и пустой p-орбиталью. [47]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )