
Вектор клонирования — это небольшой фрагмент ДНК , который может стабильно поддерживаться в организме и в который может быть вставлен чужеродный фрагмент ДНК для целей клонирования . [1] Вектор клонирования может быть ДНК, взятой из вируса , клетки высшего организма или это может быть плазмида бактерии. Вектор содержит особенности, которые позволяют удобно вставлять фрагмент ДНК в вектор или удалять его из вектора, например, за счет наличия сайтов рестрикции . Вектор и чужеродная ДНК могут быть обработаны рестриктазой , которая разрезает ДНК, и полученные таким образом фрагменты ДНК содержат либо тупые концы, либо выступы, известные как липкие концы, а векторная ДНК и чужеродная ДНК с совместимыми концами затем могут быть соединены путем молекулярного лигирования . После того, как фрагмент ДНК был клонирован в вектор клонирования, он может быть далее субклонирован в другой вектор, разработанный для более специфического использования.
Существует много типов векторов клонирования, но наиболее часто используемые из них — это генетически сконструированные плазмиды . Клонирование обычно сначала выполняется с использованием Escherichia coli , а векторы клонирования в E. coli включают плазмиды, бактериофаги (такие как фаг λ ), космиды и бактериальные искусственные хромосомы (BAC). Однако некоторые ДНК не могут стабильно поддерживаться в E. coli , например, очень большие фрагменты ДНК, и могут использоваться другие организмы, такие как дрожжи. Векторы клонирования в дрожжах включают дрожжевые искусственные хромосомы (YAC).
Все обычно используемые векторы клонирования в молекулярной биологии имеют ключевые особенности, необходимые для их функции, такие как подходящий сайт клонирования и селективный маркер. Другие могут иметь дополнительные особенности, специфичные для их использования. Из соображений простоты и удобства клонирование часто выполняется с использованием E. coli . Таким образом, используемые векторы клонирования часто имеют элементы, необходимые для их размножения и поддержания в E. coli , такие как функциональная точка начала репликации (ori). Точка начала репликации ColE1 обнаружена во многих плазмидах. Некоторые векторы также включают элементы, которые позволяют им поддерживаться в другом организме в дополнение к E. coli , и эти векторы называются челночными векторами .
Все клонирующие векторы обладают свойствами, которые позволяют удобно вставлять ген в вектор или удалять из него. Это может быть сайт множественного клонирования (MCS) или полилинкер, который содержит много уникальных сайтов рестрикции . Сайты рестрикции в MCS сначала расщепляются ферментами рестрикции, затем целевой ген, амплифицированный с помощью ПЦР, также переваренный теми же ферментами, лигируется в векторы с помощью ДНК-лигазы . Целевая последовательность ДНК может быть вставлена в вектор в определенном направлении, если это необходимо. Сайты рестрикции могут быть далее использованы для субклонирования в другой вектор, если это необходимо. [ необходима цитата ]
Другие векторы клонирования могут использовать топоизомеразу вместо лигазы, и клонирование может быть выполнено быстрее без необходимости рестрикционного переваривания вектора или вставки. В этом методе клонирования TOPO линеаризованный вектор активируется путем присоединения топоизомеразы I к его концам, и этот «активированный TOPO» вектор может затем принять продукт ПЦР путем лигирования обоих 5'-концов продукта ПЦР, высвобождая топоизомеразу и образуя в процессе кольцевой вектор. [2] Другим методом клонирования без использования переваривания ДНК и лигазы является рекомбинация ДНК , например, как это используется в системе клонирования Gateway . [3] [4] Ген, однажды клонированный в вектор клонирования (называемый входным клоном в этом методе), может быть удобно введен в различные векторы экспрессии путем рекомбинации. [5]
Вектор несет селективный маркер , позволяющий отбирать положительно трансформированные клетки. В качестве маркера часто используется устойчивость к антибиотикам , примером является ген бета-лактамазы , который придает устойчивость к пенициллиновой группе бета-лактамных антибиотиков, таких как ампициллин . Некоторые векторы содержат два селективных маркера, например, плазмида pACYC177 имеет ген устойчивости как к ампициллину, так и к канамицину . [6] Вектор Shuttle, который предназначен для поддержания в двух разных организмах, также может потребовать два селективных маркера, хотя некоторые селективные маркеры, такие как устойчивость к зеоцину и гигромицину B, эффективны в разных типах клеток. Также могут использоваться ауксотрофные селективные маркеры, которые позволяют ауксотрофному организму расти в минимальной питательной среде ; примерами этого являются LEU2 и URA3 , которые используются с соответствующими им ауксотрофными штаммами дрожжей. [7]
Другой тип селективного маркера позволяет проводить позитивный отбор плазмиды с клонированным геном. Это может включать использование гена, летального для клеток-хозяев, например, барназы , [8] Ccda , [9] и токсинов parD/parE . [10] [11] Обычно это работает путем разрушения или удаления летального гена в процессе клонирования, и неудачные клоны, в которых летальный ген все еще остается нетронутым, убивают клетки-хозяева, поэтому отбираются только успешные клоны.
Гены-репортеры используются в некоторых векторах клонирования для облегчения скрининга успешных клонов с использованием особенностей этих генов, которые позволяют легко идентифицировать успешный клон. Такие особенности, присутствующие в векторах клонирования, могут быть фрагментом lacZ α для α-комплементации в сине-белой селекции и/или геном-маркером или генами-репортерами в рамке с MCS и фланкирующими ее для облегчения производства белков слияния . Примерами партнеров слияния, которые могут использоваться для скрининга, являются зеленый флуоресцентный белок (GFP) и люцифераза .
Вектор клонирования не обязательно должен содержать подходящие элементы для экспрессии клонированного целевого гена, такие как промотор и сайт связывания рибосом (RBS), однако многие из них содержат их, и могут затем работать как вектор экспрессии . Целевая ДНК может быть вставлена в сайт, который находится под контролем определенного промотора, необходимого для экспрессии целевого гена в выбранном хозяине. Если присутствует промотор, экспрессия гена предпочтительно строго контролируется и индуцируется, так что белки производятся только при необходимости. Некоторые обычно используемые промоторы — это промоторы T7 и lac . Наличие промотора необходимо, когда используются методы скрининга, такие как сине-белая селекция .
Иногда используются векторы клонирования без промотора и RBS для клонированной последовательности ДНК, например, при клонировании генов, продукты которых токсичны для клеток E. coli . Промотор и RBS для клонированной последовательности ДНК также не нужны при первом создании геномной или кДНК-библиотеки клонов, поскольку клонированные гены обычно субклонируются в более подходящий вектор экспрессии, если требуется их экспрессия.
Некоторые векторы предназначены только для транскрипции без экспрессии гетерологичного белка, например, для производства мРНК in vitro . Эти векторы называются векторами транскрипции. В них могут отсутствовать последовательности, необходимые для полиаденилирования и терминации, поэтому их нельзя использовать для производства белка.
Доступно большое количество векторов клонирования, и выбор вектора может зависеть от ряда факторов, таких как размер вставки, количество копий и метод клонирования. Большая вставка может не поддерживаться стабильно в общем векторе клонирования, особенно для тех, у кого большое количество копий, поэтому клонирование больших фрагментов может потребовать более специализированного вектора клонирования. [6]
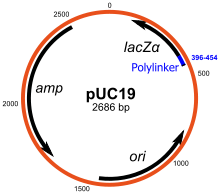
Плазмиды автономно реплицируют кольцевую внехромосомную ДНК. Они являются стандартными векторами клонирования и наиболее часто используемыми. Большинство общих плазмид можно использовать для клонирования вставок ДНК размером до 15 кб. Одним из самых ранних обычно используемых векторов клонирования является плазмида pBR322 . Другие векторы клонирования включают серию плазмид pUC , и доступно большое количество различных векторов клонирования плазмид. Многие плазмиды имеют большое количество копий, например, pUC19 имеет количество копий 500-700 копий на клетку, [6] и большое количество копий полезно, поскольку оно дает больший выход рекомбинантной плазмиды для последующей манипуляции. Однако плазмиды с малым количеством копий могут быть предпочтительно использованы в определенных обстоятельствах, например, когда белок из клонированного гена токсичен для клеток. [12]
Некоторые плазмиды содержат начало репликации бактериофага M13 и могут использоваться для генерации одноцепочечной ДНК. Они называются фагмидами , и примерами являются серии векторов клонирования pBluescript.
Бактериофаги, используемые для клонирования, — это фаг λ и фаг M13 . [13] Существует верхний предел количества ДНК, которое может быть упаковано в фаг (максимум 53 кб), поэтому, чтобы позволить вставить чужеродную ДНК в ДНК фага, клонирующим фаг векторам может потребоваться удалить некоторые несущественные гены, например, гены лизогении, поскольку использование фага λ в качестве вектора клонирования включает только литический цикл. [14] Существует два вида векторов фагов λ — вектор вставки и вектор замены. Векторы вставки содержат уникальный сайт расщепления, посредством которого может быть вставлена чужеродная ДНК размером 5–11 кб. В замещающих векторах сайты расщепления фланкируют область, содержащую гены, не являющиеся необходимыми для литического цикла, и эта область может быть удалена и заменена вставкой ДНК в процессе клонирования, и может быть вставлена ДНК большего размера в 8–24 кб. [6]
Также существует нижний предел размера ДНК, которая может быть упакована в фаг, и векторная ДНК, которая слишком мала, не может быть должным образом упакована в фаг. Это свойство можно использовать для отбора — вектор без вставки может быть слишком мал, поэтому для размножения могут быть выбраны только векторы со вставкой. [15]
Космиды — это плазмиды, которые включают сегмент ДНК бактериофага λ, имеющий сайт сцепленного конца ( cos ), который содержит элементы, необходимые для упаковки ДНК в частицы λ. При подходящем начале репликации (ori) он может реплицироваться как плазмида. Обычно он используется для клонирования больших фрагментов ДНК размером от 28 до 45 Кб. [6]
Вставка размером до 350 кб может быть клонирована в бактериальной искусственной хромосоме (BAC). BAC поддерживаются в E. coli с числом копий всего 1 на клетку. [6] BAC основаны на плазмиде F , другая искусственная хромосома, называемая PAC , основана на фаге P1 .
Искусственные хромосомы дрожжей используются в качестве векторов для клонирования фрагментов ДНК размером более 1 мегабазы (1 Мб = 1000 кб). Они полезны при клонировании более крупных фрагментов ДНК, как требуется при картировании геномов, например, в проекте «Геном человека» . Он содержит теломерную последовательность, автономно реплицирующуюся последовательность (характеристики, необходимые для репликации линейных хромосом в клетках дрожжей). Эти векторы также содержат подходящие сайты рестрикции для клонирования чужеродной ДНК, а также гены, которые можно использовать в качестве селективных маркеров.
Искусственная хромосома человека может быть потенциально полезна в качестве векторов переноса генов для доставки генов в клетки человека, а также в качестве инструмента для изучения экспрессии и определения функции хромосомы человека. Она может переносить очень большой фрагмент ДНК (нет верхнего предела по размеру для практических целей), поэтому у нее нет проблемы ограниченной клонирующей способности других векторов, а также она избегает возможного инсерционного мутагенеза, вызванного интеграцией в хромосомы хозяина вирусным вектором. [16] [17]
Вирусы, которые заражают растительные и животные клетки, также были изменены для внедрения чужеродных генов в растительные и животные клетки. Естественная способность вирусов адсорбироваться на клетках, внедрять свою ДНК и реплицироваться сделала их идеальными транспортными средствами для переноса чужеродной ДНК в эукариотические клетки в культуре. Вектор на основе вируса обезьян 40 (SV40) использовался в первом эксперименте по клонированию с участием клеток млекопитающих. Ряд векторов на основе других типов вирусов, таких как аденовирусы и вирус папилломы, использовались для клонирования генов у млекопитающих. В настоящее время ретровирусные векторы популярны для клонирования генов в клетках млекопитающих. В случае растений, таких как вирус мозаики цветной капусты , вирус мозаики табака и вирусы Gemini, использовались с ограниченным успехом.

Многие векторы общего назначения, такие как pUC19, обычно включают систему обнаружения наличия клонированного фрагмента ДНК, основанную на потере легко подсчитываемого фенотипа. Наиболее широко используется ген, кодирующий β-галактозидазу E. coli , активность которого можно легко обнаружить по способности кодируемого им фермента гидролизовать растворимый бесцветный субстрат X-gal (5-бром-4-хлор-3-индолил-бета-d-галактозид) в нерастворимый синий продукт (5,5'-дибром-4,4'-дихлор индиго). Клонирование фрагмента ДНК в векторной последовательности lacZα β-галактозидазы предотвращает выработку активного фермента. Если X-gal включен в селективные агаровые пластины, колонии трансформантов обычно синие в случае вектора без вставленной ДНК и белые в случае вектора, содержащего фрагмент клонированной ДНК.