Зелёные серные бактерии представляют собой тип Chlorobiota [4] облигатно анаэробных фотоавтотрофных бактерий , которые метаболизируют серу. [5]
Зелёные серные бактерии неподвижны (за исключением Chloroherpeton thalassium , который может скользить) и способны к аноксигенному фотосинтезу . [5] [6] Они живут в анаэробной водной среде. [7] В отличие от растений, зелёные серные бактерии в основном используют ионы сульфида в качестве доноров электронов. [8] Они являются автотрофами , которые используют обратный цикл трикарбоновых кислот для фиксации углерода . [9] Они также являются миксотрофами и восстанавливают азот. [10] [11]
Зелёные серные бактерии — это грамотрицательные палочковидные или сферические бактерии. Некоторые типы зелёных серных бактерий имеют газовые вакуоли, которые позволяют им двигаться. Они являются фотолитоавтотрофами и используют световую энергию и восстановленные соединения серы в качестве источника электронов. [12] Доноры электронов включают H2 , H2S , S. Основным фотосинтетическим пигментом этих бактерий являются бактериохлорофиллы c или d у зелёных видов и e у коричневых видов, и они расположены в хлоросомах и плазматических мембранах. [7] Хлоросомы — это уникальная особенность, которая позволяет им улавливать свет в условиях низкой освещенности. [13]
Большинство зеленых серных бактерий являются мезофильными , предпочитают умеренные температуры, и все они живут в водной среде. Им требуются анаэробные условия и пониженное содержание серы; они обычно находятся в верхних миллиметрах осадка. Они способны к фотосинтезу в условиях низкой освещенности. [7]
В Черном море , чрезвычайно бескислородной среде, на глубине около 100 м была обнаружена большая популяция зеленых серных бактерий. Из-за отсутствия света в этом районе моря большинство бактерий были фотосинтетически неактивны. Фотосинтетическая активность, обнаруженная в сульфидном хемоклине, предполагает, что бактериям требуется очень мало энергии для поддержания клеток. [14]
Вид зеленых серных бактерий был обнаружен живущим около черного курильщика у побережья Мексики на глубине 2500 м в Тихом океане . На этой глубине бактерия, обозначенная как GSB1, живет за счет тусклого свечения термального источника, поскольку солнечный свет не может проникнуть на эту глубину. [15]
Зеленые серные бактерии также были обнаружены живущими на колониях коралловых рифов в Тайване, они составляют большую часть «зеленого слоя» на этих колониях. Вероятно, они играют определенную роль в коралловой системе, и между бактериями и кораллом-хозяином могут существовать симбиотические отношения. [16] Коралл может обеспечить анаэробную среду и источник углерода для бактерий. Бактерии могут обеспечивать питательные вещества и детоксифицировать коралл, окисляя сульфид. [17]
Один из видов зеленых серных бактерий, Chlorobaculum tepidum , был обнаружен в серных источниках. Эти организмы являются термофильными , в отличие от большинства других зеленых серных бактерий. [7]
Зелёные серные бактерии относятся к семейству Chlorobiaceae. Существует четыре рода: Chloroherpeton , Prosthecochloris , Chlorobium и Chlorobaculum . Характеристики, используемые для различения этих родов, включают некоторые метаболические свойства, пигменты, морфологию клеток и спектры поглощения. Однако эти свойства трудно различить, и поэтому таксономическое разделение иногда неясно. [24]
Обычно Chlorobium имеют форму палочек или виброидов, а некоторые виды содержат газовые пузырьки. Они могут развиваться как отдельные или агрегированные клетки. Они могут быть зелеными или темно-коричневыми. Зеленые штаммы используют фотосинтетические пигменты Bchl c или d с хлоробактеновыми каротиноидами, а коричневые штаммы используют фотосинтетический пигмент Bchl e с изорениератеновыми каротиноидами. Для роста требуется небольшое количество соли. [24]
Prosthecochlori s состоят из виброидных, яйцевидных или палочковидных клеток. Они начинаются как отдельные клетки, которые образуют придатки, которые не ветвятся, называемые неветвящимися простеками. Они также могут образовывать газовые пузырьки. Присутствующие фотосинтетические пигменты включают Bchl c, d или e. Кроме того, для роста необходима соль. [24]
Chlorobaculum развиваются как отдельные клетки и обычно имеют виброидную или палочковидную форму. Некоторые из них могут образовывать газовые пузырьки. Фотосинтетические пигменты в этом роде — Bchl c, d или e . Некоторым видам для роста требуется NaCl (хлорид натрия). Члены этого рода раньше были частью рода Chlorobium, но образовали отдельную линию. [24]
Род Chloroherpeton уникален, поскольку его представители подвижны. Они представляют собой длинные гибкие стержни и могут передвигаться скольжением. Они зеленого цвета и содержат фотосинтетический пигмент Bchl c, а также γ-каротин . Для роста необходима соль. [24]
Зелёные серные бактерии используют реакционный центр типа I для фотосинтеза. Реакционные центры типа I являются бактериальным гомологом фотосистемы I (PSI) у растений и цианобактерий . Реакционные центры GSB содержат бактериохлорофилл a и известны как реакционные центры P840 из-за длины волны возбуждения 840 нм, которая обеспечивает поток электронов. У зелёных серных бактерий реакционный центр связан с большим комплексом антенны, называемым хлоросомой, которая захватывает и направляет световую энергию в реакционный центр. Хлоросомы имеют пик поглощения в дальней красной области спектра между 720 и 750 нм, поскольку они содержат бактериохлорофилл c, d и e. [25] Белковый комплекс, называемый комплексом Фенны-Мэтьюза-Олсона (FMO), физически расположен между хлоросомами и РЦ P840. Комплекс FMO помогает эффективно передавать энергию, поглощаемую антенной, в реакционный центр.
Реакционные центры PSI и типа I способны восстанавливать ферредоксин (Fd), сильный восстановитель, который может использоваться для фиксации CO
2и восстановить НАД + . Как только реакционный центр (РЦ) отдал электрон Fd, он становится окислителем (P840 + ) с восстановительным потенциалом около +300 мВ. Хотя этого недостаточно, чтобы отобрать электроны у воды и синтезировать O
2( Э
0= +820 мВ), он может принимать электроны из других источников, таких как H
2S , тиосульфат или Fe2+
ионы. [26] Этот транспорт электронов от доноров, таких как H
2S к акцептору Fd называется линейным потоком электронов или линейным переносом электронов. Окисление сульфид-ионов приводит к образованию серы как побочного продукта, который накапливается в виде глобул на внеклеточной стороне мембраны. Эти глобулы серы дали название зеленым серным бактериям. Когда сульфид истощается, глобулы серы потребляются и далее окисляются до сульфата. Однако путь окисления серы не очень хорошо изучен. [8]
Вместо передачи электронов на Fd, кластеры Fe-S в реакционном центре P840 могут передавать электроны на менахинон (MQ: MQH
2), который возвращает электроны в P840 + через цепь переноса электронов (ETC). На обратном пути в RC электроны из MQH2 проходят через комплекс цитохрома bc 1 (похожий на комплекс III митохондрий), который перекачивает H+
ионов через мембрану. Электрохимический потенциал протонов через мембрану используется для синтеза АТФ с помощью F o F 1 АТФ-синтазы . Этот циклический транспорт электронов отвечает за преобразование энергии света в клеточную энергию в форме АТФ. [25]
Зелёные серные бактерии окисляют неорганические соединения серы, чтобы использовать их в качестве доноров электронов для анаэробного фотосинтеза, в частности, при фиксации углекислого газа. Обычно они предпочитают использовать сульфид, а не другие соединения серы в качестве донора электронов, однако они могут использовать тиосульфат или H 2 . [27] Промежуточным продуктом обычно является сера, которая откладывается вне клетки, [28] а конечным продуктом является сульфат. Сера, которая откладывается вне клетки, находится в форме серных глобул, которые впоследствии могут быть полностью окислены. [27]
Механизмы окисления серы в зеленых серных бактериях недостаточно изучены. Некоторые ферменты, которые, как считается, участвуют в окислении сульфида, включают флавоцитохром c, сульфид:хинон оксидоредуктазу и SO
хсистема. Флавоцитохром может катализировать перенос электронов на цитохромы от сульфида, и эти цитохромы затем могут перемещать электроны в центр фотосинтетической реакции. Однако не все зеленые серные бактерии вырабатывают этот фермент, что свидетельствует о том, что он не нужен для окисления сульфида. Сульфид:хиноноксидоредуктаза (SQR) также помогает с переносом электронов, но, как было обнаружено, когда она одна, снижает скорость окисления сульфида в зеленых серных бактериях, что предполагает наличие другого, более эффективного механизма. [27] Однако большинство зеленых серных бактерий содержат гомолог гена SQR. [29] Окисление тиосульфата в сульфат может катализироваться ферментами в SO
хсистема. [27]
Считается, что ферменты и гены, связанные с метаболизмом серы, были получены посредством горизонтального переноса генов в ходе эволюции зеленых серных бактерий. [29]
Зеленые серные бактерии являются фотоавтотрофами : они не только получают энергию от света, они могут расти, используя углекислый газ в качестве единственного источника углерода. Они фиксируют углекислый газ, используя цикл обратного цикла трикарбоновых кислот (rTCA) [9] , где энергия потребляется для восстановления углекислого газа, а не для окисления, как это видно в прямом цикле TCA , [9] для синтеза пирувата и ацетата . Эти молекулы используются в качестве сырья для синтеза всех строительных блоков, необходимых клетке для генерации макромолекул . Цикл rTCA является высокоэнергетическим, что позволяет бактериям расти в условиях низкой освещенности. [30] Однако он имеет несколько чувствительных к кислороду ферментов, что ограничивает его эффективность в аэробных условиях. [30]
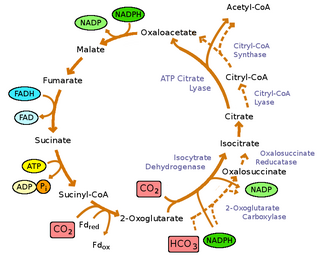
Реакции обращения окислительного цикла трикарбоновых кислот катализируются четырьмя ферментами: [9]
Однако окислительный цикл TCA (OTCA) все еще присутствует в зеленых серных бактериях. OTCA может ассимилировать ацетат, однако OTCA, по-видимому, неполный в зеленых серных бактериях из-за расположения и снижения регуляции гена во время фототрофного роста. [9]
Зелёные серные бактерии часто называют облигатными фотоавтотрофами, поскольку они не могут расти при отсутствии света, даже если им предоставлено органическое вещество. [9] [26] Однако они демонстрируют форму миксотрофии , при которой они могут потреблять простые органические соединения в присутствии света и CO2 . [ 9] В присутствии CO2 или HCO3− некоторые зелёные серные бактерии могут использовать ацетат или пируват. [9]
Миксотрофия зеленых серных бактерий лучше всего моделируется представительной зеленой серной бактерией Chlorobaculum tepidum . [31] Миксотрофия происходит во время биосинтеза аминокислот/использования углерода и энергетического метаболизма. [32] Бактерия использует электроны, полученные при окислении серы, и энергию, которую она захватывает от света, для запуска rTCA. C. tepidum также демонстрирует использование как пирувата, так и ацетата в качестве источника органического углерода. [32]
Примером миксотрофии в C. tepidum , которая сочетает в себе автотрофию и гетеротрофию, является синтез ацетил-КоА. C. tepidum может автотрофно генерировать ацетил-КоА через цикл rTCA или гетеротрофно генерировать его из поглощения ацетата. Подобная миксотрофная активность происходит, когда пируват используется для биосинтеза аминокислот, но миксотрофный рост с использованием ацетата дает более высокие темпы роста. [31] [32]
В энергетическом метаболизме C. tepidum полагается на световые реакции для производства энергии (НАДФН и НАДН), поскольку пути, обычно отвечающие за производство энергии (окислительный пентозофосфатный путь и нормальный цикл трикарбоновых кислот), функциональны лишь частично. [32] Фотоны, поглощаемые светом, используются для производства НАДФН и НАДН, кофакторов энергетического метаболизма. C. tepidum также генерирует энергию в форме АТФ, используя движущую силу протонов, полученную в результате окисления сульфида. [31] Производство энергии как в результате окисления сульфида, так и в результате поглощения фотонов через бактериохлорофиллы . [32]
Большинство зеленых серных бактерий являются диазотрофами : они могут восстанавливать азот до аммиака, который затем используется для синтеза аминокислот. [33] Фиксация азота среди зеленых серных бактерий, как правило, типична для аноксигенных фототрофов и требует присутствия света. Зеленые серные бактерии проявляют активность из системы секреции типа 1 и ферредоксин-НАДФ+ оксидоредуктазы для генерации восстановленного железа, признака, который эволюционировал для поддержки фиксации азота. [34] Как и пурпурные серные бактерии, они могут регулировать активность нитрогеназы посттрансляционно в ответ на концентрацию аммиака. Наличие у них генов nif , хотя и эволюционно различных, может предполагать, что их способности к фиксации азота возникли в результате двух разных событий или через общего очень далекого предка. [33]
Примерами зеленых серных бактерий, способных к фиксации азота, являются род Chlorobium и Pelodictyon , за исключением P. phaeoclathratiforme . Prosthecochloris aestuarii и Chloroherpeton thalassium также попадают в эту категорию. [33] Их фиксация N 2 широко распространена и играет важную роль в общей доступности азота для экосистем. Зеленые серные бактерии, живущие в коралловых рифах, такие как Prosthecochloris , играют решающую роль в создании доступного азота в среде, уже ограниченной питательными веществами. [16]