Плавиковая кислота представляет собой раствор фтористого водорода (HF) в воде . Растворы HF бесцветны, кислы и очень агрессивны . Он используется для производства большинства фторсодержащих соединений; примеры включают широко используемый фармацевтический антидепрессант флуоксетин (Прозак) и материал ПТФЭ (тефлон). Из него получают элементарный фтор . Его обычно используют для травления стеклянных и кремниевых пластин.
Основное применение плавиковой кислоты — во фторорганической химии . Многие фторорганические соединения получают с использованием HF в качестве источника фтора, включая тефлон , фторполимеры , фторуглероды и хладагенты , такие как фреон . Многие фармацевтические препараты содержат фтор. [4]
Большинство объемных неорганических фторидных соединений получают из плавиковой кислоты. В первую очередь это криолит Na 3 AlF 6 и трифторид алюминия AlF 3 . Расплавленная смесь этих твердых веществ служит высокотемпературным растворителем при производстве металлического алюминия . Другие неорганические фториды, полученные из плавиковой кислоты, включают фторид натрия и гексафторид урана . [4]
_0468.jpg/440px-Wet_etching_tanks_at_LAAS_(6_inches)_0468.jpg)
Он используется в полупроводниковой промышленности в качестве основного компонента травления Райта и буферного оксидного травления , которые используются для очистки кремниевых пластин . Аналогичным образом его также используют для травления стекла путем обработки диоксидом кремния с образованием газообразных или водорастворимых фторидов кремния. Его также можно использовать для полировки и матирования стекла. [5]
Гель плавиковой кислоты с концентрацией от 5% до 9% также обычно используется для протравливания всех керамических реставраций зубов с целью улучшения сцепления. [6] По тем же причинам разбавленная плавиковая кислота входит в состав бытовых пятновыводителей от ржавчины, при мойке автомобилей , в составах для чистки колес, в ингибиторах ржавчины для керамики и ткани, а также в пятновыводителях для воды. [5] [7] Из-за своей способности растворять оксиды железа, а также примеси на основе кремнезема, плавиковая кислота используется в пуско-наладочных котлах, которые производят пар под высоким давлением. Плавиковая кислота также полезна для растворения образцов горных пород (обычно порошкообразных) перед анализом. Аналогичным образом эта кислота используется при кислотной мацерации для извлечения органических окаменелостей из силикатных пород. Ископаемые породы можно погрузить непосредственно в кислоту или можно нанести пленку из нитрата целлюлозы (растворенную в амилацетате ), которая прилипает к органическому компоненту и позволяет камню растворяться вокруг него. [8]
В стандартном процессе нефтепереработки , известном как алкилирование , изобутан алкилируется низкомолекулярными алкенами (в первую очередь смесью пропилена и бутилена ) в присутствии кислотного катализатора , полученного из плавиковой кислоты. Катализатор протонирует алкены (пропилен, бутилен) с образованием реакционноспособных карбокатионов , которые алкилируют изобутан. Реакцию проводят при умеренных температурах (0 и 30 °C) в двухфазной реакции.
Плавиковая кислота была впервые получена в 1771 году Карлом Вильгельмом Шееле . [9] В настоящее время его в основном производят путем обработки минерала флюорита CaF 2 концентрированной серной кислотой при температуре примерно 265 °C.
Кислота также является побочным продуктом производства фосфорной кислоты из апатита и фторапатита . При разложении минерала серной кислотой при повышенных температурах выделяется смесь газов, в том числе фтористый водород, который можно восстановить. [4]
Из-за своей высокой реакционной способности по отношению к стеклу плавиковая кислота хранится в контейнерах из фторированного пластика (часто из ПТФЭ ). [4] [5]
В разбавленном водном растворе фтороводород ведет себя как слабая кислота. [10] С помощью инфракрасной спектроскопии показано, что в растворе диссоциация сопровождается образованием ионной пары H 3 O + ·F - . [11] [12]
Эта ионная пара была охарактеризована в кристаллическом состоянии при очень низкой температуре. [13] Дальнейшая ассоциация была охарактеризована как в растворе, так и в твердом состоянии. [ нужна цитата ]
Предполагается, что полимеризация происходит с увеличением концентрации. В пользу этого предположения свидетельствует выделение соли тетрамерного аниона H
3Ф−
4[14] и методом низкотемпературной рентгеновской кристаллографии. [13] Не все виды, присутствующие в концентрированных водных растворах фтористого водорода, охарактеризованы; помимо ВЧ−
2известно [11] образование других полимерных частиц, H
п -1Ф−
п, весьма вероятно.
Функция кислотности Гаммета , H 0 , для 100% HF сначала была указана как -10,2 [15] , тогда как более поздние расчеты показали -11, что сравнимо со значениями около -12 для чистой серной кислоты . [16] [17]
В отличие от других галоидоводородных кислот , таких как соляная кислота , фтороводород является слабой кислотой только в разбавленном водном растворе. [18] Частично это является результатом прочности связи водород-фтор, а также других факторов, таких как тенденция HF, H
2О и Ф−
анионы образуют кластеры. [19] При высоких концентрациях молекулы HF подвергаются гомоассоциации с образованием многоатомных ионов (таких как бифторид , HF−
2) и протоны , что значительно увеличивает кислотность. [20] Это приводит к протонированию очень сильных кислот, таких как соляная, серная или азотная, при использовании концентрированных растворов плавиковой кислоты. [21] Хотя плавиковая кислота считается слабой кислотой, она очень агрессивна и даже разъедает стекло в гидратированном состоянии. [20]
Кислотность растворов плавиковой кислоты меняется в зависимости от концентрации из-за гомоассоциации , которая относится к влиянию F - на HF. Разбавленные растворы являются слабокислыми с кислой константой ионизации K a =6,6 × 10-4 (или pKa = 3,18 ), [ 10] в отличие от соответствующих растворов других галогеноводородов, которые являются сильными кислотами ( pKa < 0 ) . Однако концентрированные растворы фтористого водорода имеют гораздо более сильную кислотность, чем предполагает это значение, как показывают измерения функции кислотности Гаммета H 0 (или «эффективного pH»). Во время самоионизации 100% жидкой HF H 0 сначала был измерен как -10,2 [15] , а затем составил -11, что сравнимо со значениями около -12 для серной кислоты . [16] [17]
С термодинамической точки зрения растворы HF весьма неидеальны : активность HF растет гораздо быстрее, чем его концентрация. Слабую кислотность в разбавленном растворе иногда объясняют высокой прочностью связи HF , которая в сочетании с высокой энтальпией растворения HF перевешивает более отрицательную энтальпию гидратации фторид-иона. [22] Поль Жигер и Сильвия Террелл [11] [12] показали с помощью инфракрасной спектроскопии , что преобладающими видами растворенных веществ в разбавленном растворе является ионная пара с водородными связями H 3 O + ·F - . [23]
С увеличением концентрации HF увеличивается и концентрация иона дифторида водорода . [11] Реакция
является примером гомоконъюгации .
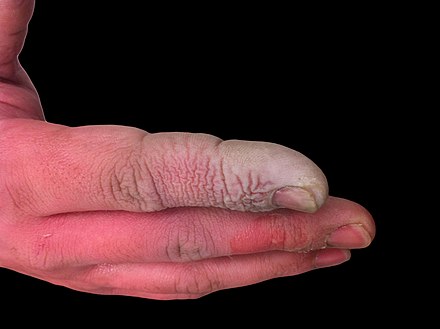
Плавиковая кислота не только является очень агрессивной жидкостью, но и является сильным контактным ядом . Из-за способности плавиковой кислоты проникать в ткани отравление может легко произойти при попадании на кожу или в глаза, а также при вдыхании или проглатывании. Симптомы воздействия плавиковой кислоты могут проявиться не сразу, и это может дать жертвам ложную уверенность, заставляя их откладывать медицинскую помощь. [24] Несмотря на раздражающий запах, HF может достигать опасных уровней без явного запаха. [5] HF нарушает функцию нервов, а это означает, что ожоги поначалу могут быть безболезненными. Случайное воздействие может остаться незамеченным, что приводит к задержке лечения и увеличению степени и серьезности травмы. [24] Симптомы воздействия ВЧ включают раздражение глаз, кожи, носа и горла, ожоги глаз и кожи, ринит , бронхит , отек легких (накопление жидкости в легких) и повреждение костей. [25]
Плавиковые ожоги лечат гелем глюконата кальция .
В эпизодах « Кошка в мешке... » и « Разрез коробок » криминального телесериала « Во все тяжкие» Уолтер Уайт и Джесси Пинкман используют плавиковую кислоту для химического расщепления тел гангстеров. [26] [27]
HF также используется в качестве одной из ловушек Джона «Пилы» Крамерса в «Пиле VI», поскольку в конце фильма кислотная ловушка летит с потолка и накачивает Бобби кислотой.