
Поликлональный ответ В-клеток является естественным режимом иммунного ответа, проявляемым адаптивной иммунной системой млекопитающих . Он обеспечивает распознавание и атаку одного антигена через его перекрывающиеся части, называемые эпитопами , несколькими клонами В -клеток . [1] [2]
В ходе нормального иммунного ответа части патогенов (например, бактерий ) распознаются иммунной системой как чужеродные (не свои) и устраняются или эффективно нейтрализуются для уменьшения их потенциального ущерба. Такое распознаваемое вещество называется антигеном . Иммунная система может реагировать на антиген несколькими способами; ключевой особенностью этого ответа является выработка антител В-клетками (или В-лимфоцитами) с участием ветви иммунной системы, известной как гуморальный иммунитет . Антитела растворимы и не требуют прямого контакта между клетками патогена и В-клеткой для функционирования.
Антигены могут быть большими и сложными субстанциями, и любое отдельное антитело может связываться только с небольшой, определенной областью на антигене. Следовательно, эффективный иммунный ответ часто включает в себя выработку множества различных антител многими различными В-клетками против одного и того же антигена. Отсюда термин «поликлональный», который происходит от слов poly , что означает много, и клоны от греческого klōn , что означает росток или веточка; [3] [4] [5] клон — это группа клеток, возникающих из общей «материнской» клетки. Антитела, полученные таким образом в поликлональном ответе, известны как поликлональные антитела . Гетерогенные поликлональные антитела отличаются от молекул моноклональных антител , которые идентичны и реагируют только на один эпитоп, т. е. являются более специфичными.
Хотя поликлональный ответ дает преимущества иммунной системе, в частности, большую вероятность реагирования на патогены, он также увеличивает вероятность развития некоторых аутоиммунных заболеваний в результате реакции иммунной системы на собственные молекулы, вырабатываемые внутри хозяина.
Заболевания, которые могут передаваться от одного организма к другому, известны как инфекционные заболевания , а биологический возбудитель, вызывающий их, известен как патоген . Процесс, посредством которого патоген вводится в организм, известен как инокуляция , [примечание 1] [6], а организм, на который он воздействует, известен как биологический хозяин . Когда патоген закрепляется на этапе, известном как колонизация , [7], он может привести к инфекции , [7] следовательно, нанося вред хозяину напрямую или через вредные вещества, называемые токсинами, которые он может производить. [7] Это приводит к различным симптомам и признакам, характерным для инфекционного заболевания, такого как пневмония или дифтерия .
Противодействие различным инфекционным заболеваниям очень важно для выживания восприимчивого организма в частности и вида в целом. Это достигается хозяином путем устранения патогена и его токсинов или вывода их из строя. Совокупность различных клеток , тканей и органов , которая специализируется на защите организма от инфекций, известна как иммунная система . Иммунная система достигает этого посредством прямого контакта определенных белых кровяных клеток с вторгающимся патогеном, включающего в себя часть иммунной системы, известную как клеточно-опосредованный иммунитет , или путем выработки веществ, которые перемещаются в места, удаленные от места их выработки, «ищут» болезнетворные клетки и токсины, специфически [примечание 2] связываясь с ними, и нейтрализуют их в процессе, известном как гуморальная часть иммунной системы. Такие вещества известны как растворимые антитела и выполняют важные функции в борьбе с инфекциями. [примечание 3] [8]
Антитела выполняют различные функции по защите хозяина от патогена. Их растворимые формы, которые выполняют эти функции, производятся плазматическими В-клетками , типом белых кровяных клеток. Это производство строго регулируется и требует активации В-клеток активированными Т-клетками (другой тип белых кровяных клеток), что является последовательной процедурой. Основные этапы включают: [9]

Патогены синтезируют белки , которые могут служить « распознаваемыми » антигенами; они могут экспрессировать молекулы на своей поверхности или высвобождать их в окружающую среду (биологические жидкости). То, что делает эти вещества узнаваемыми, заключается в том, что они связываются очень специфично и довольно сильно с определенными белками хозяина, называемыми антителами . Те же антитела могут быть закреплены на поверхности клеток иммунной системы, в этом случае они служат рецепторами , или они могут секретироваться в кровь, известные как растворимые антитела. В молекулярном масштабе белки относительно велики, поэтому они не могут быть распознаны целиком; вместо этого могут быть распознаны их сегменты, называемые эпитопами . [1] Эпитоп вступает в контакт с очень маленькой областью (из 15–22 аминокислот) молекулы антитела; эта область известна как паратоп . [1] В иммунной системе связанные с мембраной антитела являются рецептором В-клеток (BCR). Кроме того, хотя рецептор Т-клеток биохимически не классифицируется как антитело, он выполняет схожую функцию, специфически связываясь с эпитопами, комплексированными с молекулами главного комплекса гистосовместимости (MHC). [примечание 5] [10] Связывание между паратопом и соответствующим ему антигеном очень специфично из-за его структуры и управляется различными нековалентными связями , что мало чем отличается от спаривания других типов лигандов (любой атом, ион или молекула, которые связываются с любым рецептором по крайней мере с некоторой степенью специфичности и прочности ). Специфичность связывания не возникает из жесткого типа взаимодействия типа «замок и ключ» , а скорее требует, чтобы и паратоп, и эпитоп претерпели небольшие конформационные изменения в присутствии друг друга. [11]
На рисунке слева показано, что различные сегменты, образующие эпитоп, непрерывно коллинеарны, что означает, что они показаны как последовательные; однако для обсуждаемой здесь ситуации (т. е. распознавания антигена В-клеткой) это объяснение слишком упрощенное. Такие эпитопы известны как последовательные или линейные эпитопы , поскольку все аминокислоты на них находятся в одной и той же последовательности (линии). Этот режим распознавания возможен только тогда, когда пептид небольшой (длиной около шести-восьми аминокислот) [1] и используется Т-клетками (Т-лимфоцитами).
Однако клетки памяти B/наивные клетки распознают неповрежденные белки, присутствующие на поверхности патогена. [примечание 6] В этой ситуации белок в своей третичной структуре настолько сильно сложен, что некоторые петли аминокислот оказываются внутри белка, а сегменты, которые их фланкируют, могут лежать на поверхности. Паратоп на рецепторе B-клеток контактирует только с теми аминокислотами, которые лежат на поверхности белка . Поверхностные аминокислоты могут фактически быть прерывистыми в первичной структуре белка , но сопоставляются из-за сложных схем сворачивания белка (как на соседнем рисунке). Такие эпитопы известны как конформационные эпитопы и, как правило, длиннее (15–22 аминокислотных остатка), чем линейные эпитопы. [1] Аналогично, антитела, вырабатываемые плазматическими клетками, принадлежащими к одному и тому же клону, будут связываться с теми же конформационными эпитопами на белках патогена. [12] [13] [14] [15]
Связывание специфического антигена с соответствующими молекулами BCR приводит к увеличению продукции молекул MHC-II. Это приобретает значение, поскольку то же самое не происходит, когда тот же антиген был бы интернализован относительно неспецифическим процессом, называемым пиноцитозом , в котором антиген с окружающей жидкостью «выпивается» в виде небольшой везикулы В-клеткой. [16] Следовательно, такой антиген известен как неспецифический антиген и не приводит к активации В-клетки или последующей продукции антител против нее.
Макрофаги и родственные им клетки используют другой механизм для распознавания патогена. Их рецепторы распознают определенные мотивы, присутствующие на вторгающемся патогене, которые вряд ли присутствуют на клетке-хозяине. Такие повторяющиеся мотивы распознаются рецепторами распознавания образов (PRR), такими как толл-подобные рецепторы (TLR), экспрессируемыми макрофагами. [1] [17] Поскольку один и тот же рецептор может связываться с заданным мотивом, присутствующим на поверхностях сильно различающихся микроорганизмов , этот способ распознавания относительно неспецифичен и представляет собой врожденный иммунный ответ .

После распознавания антигена антигенпрезентирующая клетка, такая как макрофаг или В-лимфоцит, полностью поглощает его с помощью процесса, называемого фагоцитозом . Поглощенная частица вместе с некоторым материалом, окружающим ее, образует эндоцитарную везикулу ( фагосому ), которая сливается с лизосомами . Внутри лизосомы антиген расщепляется на более мелкие части, называемые пептидами , протеазами ( ферментами , которые расщепляют более крупные белки). Затем отдельные пептиды образуют комплекс с молекулами главного комплекса гистосовместимости II класса ( MHC класса II ), расположенными в лизосоме — этот метод «обработки» антигена известен как экзогенный или эндоцитарный путь обработки антигена в отличие от эндогенного или цитозольного пути , [17] [18] [19], который образует комплексы аномальных белков, вырабатываемых внутри клетки (например, под влиянием вирусной инфекции или в опухолевой клетке) , с молекулами MHC класса I.
Также был продемонстрирован альтернативный путь эндоцитарного процесса, при котором некоторые белки, такие как фибриноген и миоглобин, могут связываться как единое целое с молекулами MHC-II после того, как они денатурируются и их дисульфидные связи восстанавливаются ( разрывая связь путем добавления атомов водорода через нее ) . Затем протеазы разрушают открытые области комплекса белок-MHC II. [19]
После того, как обработанный антиген (пептид) комплексируется с молекулой MHC, они оба мигрируют вместе к клеточной мембране , где они экспонируются (разрабатываются) как комплекс, который может быть распознан CD 4+ (Т-хелперной клеткой) – типом лейкоцитов. [примечание 7] [20] Это известно как презентация антигена. Однако эпитопы (конформационные эпитопы), которые распознаются В-клеткой до их переваривания, могут быть не такими же, как те, которые представлены Т-хелперной клетке. Кроме того, В-клетка может представлять различные пептиды, комплексированные с различными молекулами MHC-II. [16]
Клетки CD 4+ через свой комплекс рецепторов Т-клеток -CD3 распознают связанные с эпитопом молекулы MHC II на поверхности антигенпрезентирующих клеток и «активируются» . После этой активации эти Т-клетки пролиферируют и дифференцируются в клетки T h 1 или T h 2. [16] [21] Это заставляет их вырабатывать растворимые химические сигналы, которые способствуют их собственному выживанию. Однако еще одна важная функция, которую они выполняют, — это стимуляция В-клеток путем установления прямого физического контакта с ними. [10]
Полная стимуляция Т-хелперных клеток требует, чтобы молекула B7 , присутствующая на антигенпрезентирующей клетке, связалась с молекулой CD28, присутствующей на поверхности Т-клетки (в непосредственной близости от рецептора Т-клетки). [10] Аналогично, также необходимо второе взаимодействие между лигандом CD40 или CD154 ( CD40L ), присутствующим на поверхности Т-клетки, и CD40 , присутствующим на поверхности В-клетки. [21] Те же взаимодействия, которые стимулируют Т-хелперную клетку, также стимулируют В-клетку, отсюда и термин «костимулирование» . Весь механизм гарантирует, что активированная Т-клетка стимулирует только В-клетку, которая распознает антиген, содержащий тот же эпитоп, который распознается рецептором Т-клетки «костимулирующей» Т-хелперной клетки. В-клетка стимулируется, помимо прямой костимулирования, определенными факторами роста, а именно интерлейкинами 2 , 4 , 5 и 6 паракринным образом . Эти факторы обычно вырабатываются недавно активированной Т-хелперной клеткой. [22] Однако эта активация происходит только после того, как рецептор В-клеток, присутствующий на В-клетке памяти или наивной В-клетке, связался бы с соответствующим эпитопом, без которого начальные этапы фагоцитоза и обработки антигена не произошли бы.
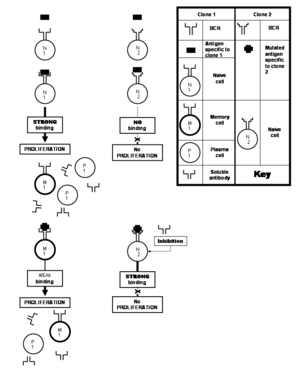
Наивная (или неопытная ) В-клетка — это та, которая принадлежит клону, который никогда не сталкивался с эпитопом, к которому она специфична. Напротив, В-клетка памяти — это та, которая происходит от активированной наивной или В-клетки памяти. Активация наивной или В-клетки памяти сопровождается множественной пролиферацией этой конкретной В-клетки, большая часть потомства которой в конечном итоге дифференцируется в плазменные В-клетки ; [примечание 8] остальные выживают как В-клетки памяти. Таким образом, когда наивные клетки, принадлежащие определенному клону, сталкиваются со своим специфическим антигеном, чтобы дать начало плазматическим клеткам, а также оставляют несколько клеток памяти, это известно как первичный иммунный ответ . В ходе пролиферации этого клона гены рецепторов В-клеток могут подвергаться частым (одна на каждые два клеточных деления) [8] мутациям в генах, кодирующих паратопы антител. Эти частые мутации называются соматической гипермутацией . Каждая такая мутация слегка изменяет способность паратопа связывать эпитоп, создавая в этом процессе новые клоны В-клеток. Некоторые из вновь созданных паратопов сильнее связываются с тем же эпитопом (что приводит к отбору клонов, обладающих ими), что известно как созревание сродства . [примечание 9] [8] [21] Другие паратопы лучше связываются с эпитопами, которые немного отличаются от исходного эпитопа, который стимулировал пролиферацию. Изменения в структуре эпитопа также обычно вызываются мутациями в генах патогена, кодирующих их антиген. Таким образом, соматическая гипермутация делает рецепторы В-клеток и растворимые антитела при последующих встречах с антигенами более инклюзивными в их потенциале распознавания антигенов измененных эпитопов, помимо предоставления большей специфичности к антигену, который изначально вызвал пролиферацию. Когда клетки памяти стимулируются антигеном для производства плазматических клеток (как и в первичном ответе клона) и оставляют еще больше клеток памяти в этом процессе, это известно как вторичный иммунный ответ , [21] который приводит к большему количеству плазматических клеток и более высокой скорости выработки антител, которая длится более длительные периоды. Клетки памяти B, вырабатываемые как часть вторичного ответа, распознают соответствующий антиген быстрее и связываются с ним сильнее (т. е. большее сродство связывания) благодаря созреванию сродства. Растворимые антитела, вырабатываемые клоном, показывают аналогичное усиление связывания антигена. [21]
Ответы являются поликлональными по своей природе, поскольку каждый клон в некоторой степени специализируется на выработке антител против данного эпитопа, и поскольку каждый антиген содержит несколько эпитопов, каждый из которых, в свою очередь, может быть распознан более чем одним клоном В-клеток. Чтобы иметь возможность реагировать на бесчисленное количество антигенов, а также на несколько составляющих эпитопов, иммунная система должна обладать способностью распознавать очень большое количество эпитопов в целом, т. е. должно быть большое разнообразие клонов В-клеток.
Клетки памяти и наивные В-клетки обычно существуют в относительно небольших количествах. Поскольку организм должен иметь возможность реагировать на большое количество потенциальных патогенов, он поддерживает пул В-клеток с широким спектром специфичностей. [17] Следовательно, хотя почти всегда есть по крайней мере одна В-клетка (наивная или память), способная реагировать на любой заданный эпитоп (из всех, на которые может реагировать иммунная система), точных дубликатов очень мало. Однако, когда одна В-клетка сталкивается с антигеном, с которым она может связаться, она может очень быстро размножаться. [21] Такая группа клеток с одинаковой специфичностью к эпитопу известна как клон и происходит от общей «материнской» клетки. Все «дочерние» В-клетки соответствуют исходной «материнской» клетке по своей специфичности эпитопа, и они секретируют антитела с идентичными паратопами. Эти антитела являются моноклональными антителами , поскольку они происходят от клонов одной и той же родительской клетки. Поликлональный ответ — это ответ, при котором клоны нескольких В-клеток реагируют на один и тот же антиген.

Один антиген можно рассматривать как последовательность множественных перекрывающихся эпитопов. Многие уникальные клоны В-клеток могут связываться с отдельными эпитопами. Это придает еще большую множественность общему ответу. [3] Все эти В-клетки могут активироваться и производить большие колонии клонов плазматических клеток, каждый из которых может секретировать до 1000 молекул антител против каждого эпитопа в секунду. [21]
В дополнение к различным В-клеткам, реагирующим на различные эпитопы одного и того же антигена, В-клетки, принадлежащие к разным клонам, также могут реагировать на один и тот же эпитоп. Эпитоп, который может быть атакован многими различными В-клетками, считается высокоиммуногенным . В этих случаях связывающее сродство для соответствующих пар эпитоп-паратоп различается, при этом некоторые клоны В-клеток продуцируют антитела, которые прочно связываются с эпитопом, а другие продуцируют антитела, которые связываются слабо. [1]
Клоны, которые связываются с определенным эпитопом с большей силой, с большей вероятностью будут отобраны для дальнейшей пролиферации в зародышевых центрах фолликулов в различных лимфоидных тканях, таких как лимфатические узлы . Это мало чем отличается от естественного отбора : клоны отбираются по их приспособленности атаковать эпитопы (сила связывания) на встреченном патогене. [23] Что делает аналогию еще сильнее, так это то, что В-лимфоциты должны конкурировать друг с другом за сигналы, которые способствуют их выживанию в зародышевых центрах.
Хотя существует множество разнообразных патогенов, многие из которых постоянно мутируют, удивительно, что большинство людей остаются свободными от инфекций. Таким образом, поддержание здоровья требует, чтобы организм распознавал все патогены (антигены, которые они представляют или производят), которые, вероятно, существуют. Это достигается путем поддержания пула чрезвычайно больших (около 10 9 ) клонов В-клеток, каждый из которых реагирует на определенный эпитоп, распознавая и вырабатывая антитела против него. Однако в любой момент времени очень немногие клоны фактически остаются восприимчивыми к своему определенному эпитопу. Таким образом, приблизительно 10 7 различных эпитопов могут быть распознаны всеми клонами В-клеток вместе взятыми. [21] Более того, в течение жизни человеку обычно требуется выработка антител против очень небольшого количества антигенов по сравнению с числом, которое организм может распознать и на которое может отреагировать. [21]
Если антиген может быть распознан более чем одним компонентом его структуры, то вероятность того, что он будет «пропущен» иммунной системой, меньше. [примечание 10] Мутация патогенных организмов может привести к модификации антигена — и, следовательно, эпитопа — структуры. Если иммунная система «помнит», как выглядят другие эпитопы, антиген и организм все равно будут распознаны и подвергнуты иммунному ответу организма. Таким образом, поликлональный ответ расширяет диапазон патогенов, которые могут быть распознаны. [24]
Многие вирусы часто подвергаются мутациям , которые приводят к изменениям в аминокислотном составе их важных белков. Эпитопы, расположенные на белке, также могут претерпевать изменения в процессе. Такой измененный эпитоп менее прочно связывается с антителами, специфичными для неизмененного эпитопа, которые могли бы стимулировать иммунную систему. Это прискорбно, поскольку соматическая гипермутация действительно приводит к появлению клонов, способных вырабатывать растворимые антитела, которые связывали бы измененный эпитоп достаточно жадно, чтобы нейтрализовать его. Но эти клоны будут состоять из наивных клеток, которым не позволяют размножаться слабо связывающиеся антитела, вырабатываемые ранее стимулированным клоном. Эта доктрина известна как первородный антигенный грех . [21] Это явление вступает в игру, в частности, в иммунных реакциях против вирусов гриппа , лихорадки денге и ВИЧ . [25] Это ограничение, однако, накладывается не явлением поликлонального ответа, а скорее против него иммунным ответом, который смещен в пользу опытных клеток памяти против «новичковых» наивных клеток.
При аутоиммунитете иммунная система ошибочно распознает определенные собственные молекулы в организме как чужеродные ( аутоантиген ) и запускает иммунный ответ против них. Поскольку эти собственные молекулы, как нормальные части организма, всегда будут естественным образом существовать в организме, атаки против них могут со временем усиливаться (подобно вторичному иммунному ответу). Более того, многие организмы демонстрируют молекулярную мимикрию , которая подразумевает демонстрацию на своей поверхности тех антигенов, которые антигенно похожи на белки хозяина. Это имеет два возможных последствия: во-первых, либо организм будет сохранен как собственный антиген; или, во-вторых, что антитела, вырабатываемые против него, также будут связываться с имитированными собственными белками. Антитела будут атаковать собственные антигены и ткани, в которых они находятся, активируя различные механизмы, такие как активация комплемента и антителозависимая клеточно-опосредованная цитотоксичность . Следовательно, чем шире диапазон специфичностей антител, тем больше вероятность того, что один или другой будет реагировать против собственных антигенов (нативные молекулы организма). [26] [27]
Моноклональные антитела — это структурно идентичные молекулы иммуноглобулина с одинаковой специфичностью к эпитопу (все они связываются с одним и тем же эпитопом с одинаковым сродством) по сравнению с их поликлональными аналогами, которые имеют различное сродство к одному и тому же эпитопу. Обычно они не вырабатываются в естественном иммунном ответе, а только в болезненных состояниях, таких как множественная миелома , или с помощью специализированных лабораторных методов. Из-за своей специфичности моноклональные антитела используются в определенных приложениях для количественной оценки или обнаружения присутствия веществ (которые действуют как антиген для моноклональных антител), а также для нацеливания на отдельные клетки (например, раковые клетки). Моноклональные антитела находят применение в различных диагностических модальностях (см.: вестерн-блот и иммунофлуоресценция ) и терапиях — особенно рака и заболеваний с аутоиммунным компонентом. Но, поскольку практически все реакции в природе являются поликлональными, это делает производство чрезвычайно полезных моноклональных антител менее простым . [8]
Первые доказательства наличия нейтрализующего вещества в крови, которое могло бы противостоять инфекциям, появились, когда Эмиль фон Беринг вместе с Китасато Сибасабуро в 1890 году разработали эффективную сыворотку против дифтерии. Они сделали это, перелив сыворотку, полученную от животных, иммунизированных против дифтерии, к животным, страдающим от нее. Передача сыворотки таким образом могла вылечить инфицированных животных. Беринг был удостоен Нобелевской премии за эту работу в 1901 году. [28]
В то время, однако, химическая природа того, что именно в крови обеспечивало эту защиту, была неизвестна. В течение нескольких последующих десятилетий было показано, что защитная сыворотка может нейтрализовать и осаждать токсины и склеивать бактерии. Все эти функции были приписаны различным веществам в сыворотке и названы соответственно как антитоксин , преципитин и агглютинин . [17] То, что все три вещества были одним целым ( гамма-глобулины ), было продемонстрировано Элвином А. Кабатом в 1939 году. В предыдущем году Кабат продемонстрировал гетерогенность антител с помощью исследований сыворотки лошадей с помощью ультрацентрифугирования . [29]
До этого времени клеточный иммунитет и гуморальный иммунитет считались конкурирующими теориями, объясняющими эффективный иммунный ответ, но первый отставал из-за отсутствия передовых методов. [17] Клеточный иммунитет получил толчок к признанию и изучению, когда в 1942 году Меррилл Чейз успешно передал иммунитет против туберкулеза между свиньями путем переноса лейкоцитов. [17] [30]
Позднее, в 1948 году, Астрид Фагреус в своей докторской диссертации показала, что В-клетки плазмы специально участвуют в выработке антител. [31] Роль лимфоцитов в опосредовании как клеточно-опосредованных, так и гуморальных реакций была продемонстрирована Джеймсом Говансом в 1959 году. [30]
Для того чтобы учесть широкий спектр антигенов, которые может распознавать иммунная система, Пауль Эрлих в 1900 году выдвинул гипотезу, что уже существующие «рецепторы боковой цепи» связывают данный патоген, и что это взаимодействие побуждает клетку, проявляющую рецептор, размножаться и производить больше копий того же рецептора. Эта теория, называемая селективной теорией , не была доказана в течение следующих пяти десятилетий и была оспорена несколькими инструктивными теориями , которые основывались на представлении о том, что антитело примет свою эффективную структуру, сворачиваясь вокруг антигена. [17] Однако в конце 1950-х годов работы трех ученых — Джерне , Талмейджа и Бернета (которые в значительной степени модифицировали теорию) — дали начало теории клонального отбора , которая доказала все элементы гипотезы Эрлиха, за исключением того, что специфические рецепторы, которые могли нейтрализовать агент, были растворимыми и не связанными с мембраной. [17] [30]
Теория клонального отбора была доказана правильностью, когда сэр Густав Носсал показал, что каждая В-клетка всегда производит только одно антитело. [32]
В 1974 году роль MHC в презентации антигена была продемонстрирована Рольфом Цинкернагелем и Питером К. Доэрти . [30]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ){{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )