Вода ( H 2 O ) — полярное неорганическое соединение, которое при комнатной температуре представляет собой жидкость без вкуса и запаха , которая почти бесцветна, за исключением присущего ей оттенка синего . Это, безусловно, наиболее изученное химическое соединение [20] и описывается как «универсальный растворитель » [21] и «растворитель жизни». [22] Это самое распространенное вещество на поверхности Земли [23] и единственное распространенное вещество, существующее в твердом , жидком и газообразном состоянии на поверхности Земли. [24] Это также третья по распространенности молекула во Вселенной (после молекулярного водорода и оксида углерода ). [23]
Молекулы воды образуют водородные связи друг с другом и являются сильно полярными. Эта полярность позволяет ей диссоциировать ионы в солях и связываться с другими полярными веществами, такими как спирты и кислоты, тем самым растворяя их. Ее водородные связи обуславливают ее многочисленные уникальные свойства, такие как наличие твердой формы, менее плотной, чем ее жидкая форма, относительно высокая температура кипения 100 °C для ее молярной массы и высокая теплоемкость .
Вода амфотерна , что означает, что она может проявлять свойства кислоты или основания в зависимости от pH раствора, в котором она находится; она легко образует как H+и ОН−ионы. [c] В связи с его амфотерным характером он подвергается самоионизации . Продукт активности , или приблизительно, концентрации H+
и ОН−
является константой, поэтому их соответствующие концентрации обратно пропорциональны друг другу. [25]
Вода — это химическое вещество с химической формулой H.
2O ; одна молекула воды имеет два атома водорода , ковалентно связанных с одним атомом кислорода . [26] Вода является безвкусной, не имеющей запаха жидкостью при температуре и давлении окружающей среды . Жидкая вода имеет слабые полосы поглощения на длинах волн около 750 нм, которые заставляют ее казаться синей. [4] Это можно легко наблюдать в наполненной водой ванне или раковине, внутренняя поверхность которых белая. Крупные ледяные кристаллы, как в ледниках , также кажутся синими.
При стандартных условиях вода в основном является жидкостью, в отличие от других аналогичных гидридов семейства кислорода , которые, как правило, являются газообразными. Это уникальное свойство воды обусловлено водородными связями . Молекулы воды постоянно движутся относительно друг друга, а водородные связи непрерывно разрываются и восстанавливаются в масштабах времени, превосходящих 200 фемтосекунд (2 × 10−13 секунд ). [27] Однако эти связи достаточно сильны, чтобы создавать многие из особых свойств воды, некоторые из которых делают ее неотъемлемой частью жизни.
В атмосфере и на поверхности Земли жидкая фаза является наиболее распространенной и является формой, которая обычно обозначается словом «вода». Твердая фаза воды известна как лед и обычно принимает структуру твердых, амальгамированных кристаллов , таких как кубики льда , или свободно скопившихся зернистых кристаллов, таких как снег . Помимо обычного гексагонального кристаллического льда , известны другие кристаллические и аморфные фазы льда . Газообразная фаза воды известна как водяной пар (или пар ). Видимый пар и облака образуются из мельчайших капелек воды, взвешенных в воздухе.
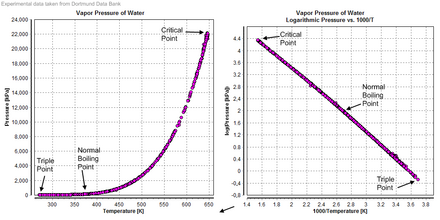
Вода также образует сверхкритическую жидкость . Критическая температура составляет 647 К , а критическое давление — 22,064 МПа . В природе это случается редко и в крайне агрессивных условиях. Вероятным примером естественной сверхкритической воды являются самые горячие части глубоководных гидротермальных источников , в которых вода нагревается до критической температуры вулканическими струями , а критическое давление вызвано весом океана на экстремальных глубинах, где расположены источники. Это давление достигается на глубине около 2200 метров: намного меньше средней глубины океана (3800 метров). [28]

Вода имеет очень высокую удельную теплоемкость 4184 Дж/(кг·К) при 20 °C (4182 Дж/(кг·К) при 25 °C) — вторую по величине среди всех гетероатомных видов (после аммиака ), а также высокую теплоту испарения (40,65 кДж/моль или 2257 кДж/кг при нормальной температуре кипения), оба из которых являются результатом обширных водородных связей между ее молекулами. Эти два необычных свойства позволяют воде смягчать климат Земли , смягчая большие колебания температуры. Большая часть дополнительной энергии, хранящейся в климатической системе с 1970 года, аккумулировалась в океанах . [29]
Удельная энтальпия плавления (более известная как скрытая теплота) воды составляет 333,55 кДж/кг при 0 °C: для расплавления льда требуется одинаковое количество энергии, чтобы нагреть лед от −160 °C до точки плавления или нагреть то же количество воды примерно на 80 °C. Из обычных веществ выше только аммиак. Это свойство придает устойчивость к таянию льда ледников и дрейфующих льдов . До и после появления механического охлаждения лед был и остается широко распространенным средством замедления порчи пищевых продуктов.
Удельная теплоемкость льда при температуре −10 °C составляет 2030 Дж/(кг·К) [30] , а теплоемкость пара при температуре 100 °C составляет 2080 Дж/(кг·К) [31] .

Плотность воды составляет около 1 грамма на кубический сантиметр (62 фунта/куб. фут): это соотношение изначально использовалось для определения грамма. [32] Плотность изменяется в зависимости от температуры, но не линейно: по мере повышения температуры плотность возрастает до пика при 3,98 °C (39,16 °F), а затем уменьшается; [33] первоначальное увеличение необычно, поскольку большинство жидкостей подвергаются тепловому расширению , так что плотность уменьшается только как функция температуры. Увеличение, наблюдаемое для воды от 0 °C (32 °F) до 3,98 °C (39,16 °F) и для нескольких других жидкостей [d] , описывается как отрицательное тепловое расширение . Обычный гексагональный лед также менее плотный, чем жидкая вода — при замерзании плотность воды уменьшается примерно на 9%. [36] [e]
Эти своеобразные эффекты обусловлены высоконаправленным связыванием молекул воды через водородные связи: лед и жидкая вода при низкой температуре имеют сравнительно низкоплотные, низкоэнергетические открытые решетчатые структуры. Разрыв водородных связей при плавлении с повышением температуры в диапазоне 0–4 °C позволяет создать более плотную молекулярную упаковку, в которой некоторые полости решетки заполняются молекулами воды. [33] [37] Однако выше 4 °C тепловое расширение становится доминирующим эффектом, [37] и вода вблизи точки кипения (100 °C) примерно на 4% менее плотная, чем вода при 4 °C (39 °F). [36] [f]
При повышении давления лед претерпевает ряд переходов в другие полиморфные состояния с более высокой плотностью, чем жидкая вода, такие как лед II , лед III , аморфный лед высокой плотности (HDA) и аморфный лед очень высокой плотности (VHDA). [38] [39]

Необычная кривая плотности и более низкая плотность льда, чем у воды, имеет важное значение для большей части жизни на Земле — если бы вода была наиболее плотной в точке замерзания, то зимой охлаждение на поверхности привело бы к конвективному перемешиванию. Как только достигается 0 °C, водоем замерзает снизу вверх, и вся жизнь в нем погибает. [36] Кроме того, учитывая, что вода является хорошим теплоизолятором (из-за своей теплоемкости), некоторые замерзшие озера могут не полностью оттаивать летом. [36] Как таковая, инверсия кривой плотности приводит к стабильному расслоению при температурах поверхности ниже 4 °C, и со слоем льда, который плавает наверху, изолируя воду внизу, [40] даже, например, озеро Байкал в Центральной Сибири замерзает только до толщины около 1 м зимой. В целом, для достаточно глубоких озер температура на дне остается постоянной и составляет около 4 °C (39 °F) в течение всего года (см. диаграмму). [36]

Плотность соленой воды зависит от содержания растворенной соли, а также от температуры. Лед все еще плавает в океанах, в противном случае они замерзали бы снизу вверх. Однако содержание соли в океанах понижает точку замерзания примерно на 1,9 °C [41] (из-за понижения точки замерзания растворителя, содержащего растворенное вещество ) и понижает температуру максимума плотности воды до прежней точки замерзания в 0 °C. Вот почему в океанской воде нисходящая конвекция более холодной воды не блокируется расширением воды, когда она становится холоднее вблизи точки замерзания. Холодная вода океанов вблизи точки замерзания продолжает тонуть. Поэтому существа, которые живут на дне холодных океанов, таких как Северный Ледовитый океан, обычно живут в воде на 4 °C холоднее, чем на дне замерзших пресноводных озер и рек.
Когда поверхность соленой воды начинает замерзать (при температуре −1,9 °C [41] для морской воды с нормальной соленостью , 3,5%), образующийся лед по существу не содержит соли и имеет примерно такую же плотность, как и пресноводный лед. Этот лед плавает на поверхности, а «вымороженная» соль увеличивает соленость и плотность морской воды прямо под ним в процессе, известном как отторжение рассола . Эта более плотная соленая вода опускается за счет конвекции, и заменяющая ее морская вода подвергается тому же процессу. Это приводит к образованию по существу пресноводного льда при температуре −1,9 °C [41] на поверхности. Повышенная плотность морской воды под формирующимся льдом заставляет ее опускаться ко дну. В больших масштабах процесс отторжения рассола и опускания холодной соленой воды приводит к образованию океанических течений для транспортировки такой воды от полюсов, что приводит к глобальной системе течений, называемой термохалинной циркуляцией .

Вода смешивается со многими жидкостями, включая этанол во всех пропорциях. Вода и большинство масел не смешиваются, обычно образуя слои в соответствии с увеличением плотности сверху. Это можно предсказать, сравнив полярность . Вода, будучи относительно полярным соединением, будет иметь тенденцию смешиваться с жидкостями с высокой полярностью, такими как этанол и ацетон, тогда как соединения с низкой полярностью будут иметь тенденцию не смешиваться и плохо растворяться , например, с углеводородами .
Как газ, водяной пар полностью смешивается с воздухом. С другой стороны, максимальное давление водяного пара , которое термодинамически стабильно с жидкостью (или твердым телом) при данной температуре, относительно низко по сравнению с общим атмосферным давлением. Например, если парциальное давление пара составляет 2% от атмосферного давления, а воздух охлаждается с 25 °C, начиная примерно с 22 °C, вода начнет конденсироваться, определяя точку росы и создавая туман или росу . Обратный процесс объясняет испарение тумана утром. Если влажность увеличивается при комнатной температуре, например, путем включения горячего душа или ванны, а температура остается примерно той же, пар вскоре достигает давления для фазового перехода, а затем конденсируется в виде мельчайших капель воды, обычно называемых паром.
Насыщенный газ или газ с относительной влажностью 100% — это газ, в котором давление паров воды в воздухе находится в равновесии с давлением паров из-за (жидкой) воды; вода (или лед, если он достаточно холодный) не будет терять массу за счет испарения при воздействии насыщенного воздуха. Поскольку количество водяного пара в воздухе невелико, относительная влажность, отношение парциального давления из-за водяного пара к насыщенному парциальному давлению пара, гораздо более полезна. Давление пара выше 100% относительной влажности называется перенасыщенным и может возникнуть, если воздух быстро охлаждается, например, резко поднимаясь в восходящем потоке. [г]
Сжимаемость воды является функцией давления и температуры. При 0 °C, на пределе нулевого давления, сжимаемость равна5,1 × 10−10 Па −1 . На пределе нулевого давления сжимаемость достигает минимума4,4 × 10 −10 Па −1 около 45 °C, прежде чем снова возрасти с ростом температуры. По мере увеличения давления сжимаемость уменьшается, составляя3,9 × 10−10 Па −1 при 0 °C и 100 мегапаскалей (1000 бар). [42]
Модуль объемной упругости воды составляет около 2,2 ГПа. [43] Низкая сжимаемость негазов, и воды в частности, приводит к тому, что их часто считают несжимаемыми. Низкая сжимаемость воды означает, что даже в глубоких океанах на глубине 4 км, где давление составляет 40 МПа, происходит только 1,8%-ное уменьшение объема. [43]
Модуль объемной упругости водяного льда колеблется от 11,3 ГПа при 0 К до 8,6 ГПа при 273 К. [44] Большое изменение сжимаемости льда в зависимости от температуры является результатом его относительно большого коэффициента теплового расширения по сравнению с другими распространенными твердыми телами.

Температура и давление, при которых обычная твердая, жидкая и газообразная вода сосуществуют в равновесии, — это тройная точка воды. С 1954 года эта точка использовалась для определения базовой единицы температуры, кельвина , [45] [46] но, начиная с 2019 года , кельвин теперь определяется с использованием постоянной Больцмана , а не тройной точки воды. [47]
Из-за существования множества полиморфов (форм) льда, вода имеет другие тройные точки, которые имеют либо три полиморфа льда, либо два полиморфа льда и жидкости в равновесии. [46] Густав Генрих Иоганн Аполлон Тамманн в Геттингене получил данные о нескольких других тройных точках в начале 20-го века. Камб и другие задокументировали дополнительные тройные точки в 1960-х годах. [48] [49] [50]
Температура плавления льда составляет 0 °C (32 °F; 273 K) при стандартном давлении; однако чистая жидкая вода может быть переохлаждена значительно ниже этой температуры без замерзания, если жидкость не подвергается механическому воздействию. Она может оставаться в жидком состоянии вплоть до своей однородной точки зародышеобразования около 231 K (−42 °C; −44 °F). [52] Температура плавления обычного гексагонального льда немного падает при умеренно высоких давлениях, на 0,0073 °C (0,0131 °F)/атм [ч] или примерно на 0,5 °C (0,90 °F)/70 атм [i] [53], поскольку энергия стабилизации водородных связей превышается межмолекулярным отталкиванием, но по мере того, как лед превращается в свои полиморфы (см. кристаллические состояния льда ) выше 209,9 МПа (2072 атм), температура плавления заметно увеличивается с давлением , т. е. достигая 355 К (82 °C) при 2,216 ГПа (21 870 атм) (тройная точка льда VII [54] ).
Чистая вода, не содержащая экзогенных ионов , является прекрасным электронным изолятором , но даже «деионизированная» вода не полностью свободна от ионов. Вода подвергается автоионизации в жидком состоянии, когда две молекулы воды образуют один гидроксид-анион ( ОН−
) и один катион гидроксония ( H
3О+
). Из-за автоионизации при температуре окружающей среды чистая жидкая вода имеет такую же собственную концентрацию носителей заряда, как и полупроводник германий, и собственную концентрацию носителей заряда на три порядка больше, чем полупроводник кремний, поэтому, исходя из концентрации носителей заряда, воду нельзя считать полностью диэлектрическим материалом или электрическим изолятором, а можно считать ограниченным проводником ионного заряда. [55]
Поскольку вода является таким хорошим растворителем, в ней почти всегда есть некоторое количество растворенного вещества , часто соли . Если в воде есть даже крошечное количество такой примеси, то ионы могут переносить заряды туда и обратно, позволяя воде проводить электричество гораздо легче.
Известно, что теоретически максимальное электрическое сопротивление воды составляет приблизительно 18,2 МОм·см (182 кОм ·м) при 25 °C. [56] Эта цифра хорошо согласуется с тем, что обычно наблюдается в системах обратного осмоса , ультрафильтрованной и деионизированной сверхчистой воды, используемых, например, на заводах по производству полупроводников. Уровень загрязнения солью или кислотой, превышающий даже 100 частей на триллион (ppt) в в остальном сверхчистой воде, начинает заметно снижать ее сопротивление до нескольких кОм·м. [ необходима цитата ]
В чистой воде чувствительное оборудование может обнаружить очень слабую электропроводность 0,05501 ± 0,0001 мкСм / см при 25,00 °C. [56] Вода также может быть электролизована в кислород и водород, но в отсутствие растворенных ионов это очень медленный процесс, так как проводится очень мало тока. Во льду основными носителями заряда являются протоны (см. протонный проводник ). [57] Ранее считалось, что лед имеет небольшую, но измеримую проводимость 1 × 10−10 См/см, но сейчас считается, что эта проводимость почти полностью обусловлена дефектами поверхности, а без них лед является изолятором с неизмеримо малой проводимостью. [33]

Важной особенностью воды является ее полярная природа. Структура имеет изогнутую молекулярную геометрию для двух водородов из вершины кислорода. Атом кислорода также имеет две неподеленные пары электронов. Один эффект, обычно приписываемый неподеленным парам, заключается в том, что угол изгиба газовой фазы H–O–H составляет 104,48°, [58] что меньше типичного тетраэдрического угла 109,47°. Неподеленные пары находятся ближе к атому кислорода, чем электроны сигма, связанные с водородами, поэтому им требуется больше места. Увеличенное отталкивание неподеленных пар заставляет связи O–H сближаться друг с другом. [59]
Другим следствием ее структуры является то, что вода является полярной молекулой . Из-за разницы в электроотрицательности дипольный момент связи указывает от каждого H к O, делая кислород частично отрицательным, а каждый водород частично положительным. Большой молекулярный диполь указывает из области между двумя атомами водорода на атом кислорода. Различия зарядов заставляют молекулы воды объединяться (относительно положительные области притягиваются к относительно отрицательным областям). Это притяжение, водородная связь , объясняет многие свойства воды, такие как ее свойства растворителя. [60]
Хотя водородные связи являются относительно слабым притяжением по сравнению с ковалентными связями внутри самой молекулы воды, они отвечают за несколько физических свойств воды. К этим свойствам относятся ее относительно высокие температуры плавления и кипения: для разрыва водородных связей между молекулами воды требуется больше энергии. Напротив, сероводород ( H
2S ), имеет гораздо более слабую водородную связь из-за более низкой электроотрицательности серы. H
2S является газом при комнатной температуре , несмотря на то, что сероводород имеет почти в два раза большую молярную массу, чем вода. Дополнительная связь между молекулами воды также придает жидкой воде большую удельную теплоемкость . Эта высокая теплоемкость делает воду хорошим носителем тепла (охладителем) и тепловым экраном.

Молекулы воды остаются близко друг к другу ( когезия ) благодаря коллективному действию водородных связей между молекулами воды. Эти водородные связи постоянно разрываются, и новые связи образуются с другими молекулами воды; но в любой момент времени в образце жидкой воды большая часть молекул удерживается вместе такими связями. [61]
Вода также обладает высокими адгезионными свойствами из-за своей полярной природы. На чистом, гладком стекле вода может образовывать тонкую пленку, потому что молекулярные силы между стеклом и молекулами воды (адгезионные силы) сильнее, чем силы сцепления. [ требуется цитата ] В биологических клетках и органеллах вода контактирует с мембранными и белковыми поверхностями, которые являются гидрофильными ; то есть поверхностями, которые имеют сильное притяжение к воде. Ирвинг Ленгмюр наблюдал сильную отталкивающую силу между гидрофильными поверхностями. Чтобы обезвожить гидрофильные поверхности — удалить прочно удерживаемые слои воды гидратации — требуется совершить значительную работу против этих сил, называемых силами гидратации. Эти силы очень велики, но быстро уменьшаются в течение нанометра или меньше. [62] Они важны в биологии, особенно когда клетки обезвоживаются под воздействием сухой атмосферы или внеклеточного замораживания. [63]



Вода имеет необычно высокое поверхностное натяжение 71,99 мН/м при 25 °C [64] , что обусловлено прочностью водородных связей между молекулами воды. [65] Это позволяет насекомым ходить по воде. [65]
Поскольку вода обладает сильными связями и адгезионными силами, она проявляет капиллярное действие. [66] Сильное сцепление, обусловленное водородными связями и адгезией, позволяет деревьям транспортировать воду на высоту более 100 м. [65]

Вода является прекрасным растворителем благодаря своей высокой диэлектрической проницаемости. [67] Вещества, которые хорошо смешиваются и растворяются в воде, известны как гидрофильные («любящие воду») вещества, в то время как те, которые плохо смешиваются с водой, известны как гидрофобные («боящиеся воды») вещества. [68] Способность вещества растворяться в воде определяется тем, может ли вещество соответствовать или превосходить сильные силы притяжения , которые молекулы воды создают между другими молекулами воды. Если вещество обладает свойствами, которые не позволяют ему преодолевать эти сильные межмолекулярные силы, молекулы осаждаются из воды. Вопреки распространенному заблуждению, вода и гидрофобные вещества не «отталкиваются», и гидратация гидрофобной поверхности энергетически, но не энтропийно, выгодна.
Когда ионное или полярное соединение попадает в воду, оно окружается молекулами воды ( гидратация ). Относительно небольшой размер молекул воды (~ 3 ангстрема) позволяет многим молекулам воды окружать одну молекулу растворенного вещества . Частично отрицательные дипольные концы воды притягиваются к положительно заряженным компонентам растворенного вещества, и наоборот для положительных дипольных концов.
В общем, ионные и полярные вещества, такие как кислоты , спирты и соли, относительно растворимы в воде, а неполярные вещества, такие как жиры и масла, — нет. Неполярные молекулы остаются вместе в воде, поскольку энергетически более выгодно для молекул воды образовывать водородные связи друг с другом, чем вступать в ван-дер-ваальсовы взаимодействия с неполярными молекулами.
Примером ионного растворенного вещества является поваренная соль ; хлорид натрия NaCl разделяется на Na+
катионы и Cl−
анионы , каждый из которых окружен молекулами воды. Затем ионы легко переносятся из своей кристаллической решетки в раствор. Примером неионного растворенного вещества является столовый сахар . Диполи воды образуют водородные связи с полярными областями молекулы сахара (группами ОН) и позволяют ей переноситься в раствор.
Динамика квантового туннелирования в воде была описана еще в 1992 году. В то время было известно, что существуют движения, которые разрушают и восстанавливают слабую водородную связь за счет внутренних вращений замещающих водных мономеров . [69] 18 марта 2016 года было сообщено, что водородная связь может быть разорвана квантовым туннелированием в гексамере воды . В отличие от ранее описанных туннельных движений в воде, это включало согласованный разрыв двух водородных связей. [70] Позже в том же году было сообщено об открытии квантового туннелирования молекул воды. [71]
Вода относительно прозрачна для видимого света , ближнего ультрафиолетового света и дальнего красного света, но она поглощает большую часть ультрафиолетового света , инфракрасного света и микроволн . Большинство фоторецепторов и фотосинтетических пигментов используют часть светового спектра, которая хорошо передается через воду. Микроволновые печи используют непрозрачность воды для микроволнового излучения для нагрева воды внутри продуктов. Голубой цвет воды вызван слабым поглощением в красной части видимого спектра . [4] [72]

Одна молекула воды может участвовать максимум в четырех водородных связях , поскольку она может принимать две связи, используя неподеленные пары на кислороде, и отдавать два атома водорода. Другие молекулы, такие как фтористый водород , аммиак и метанол, также могут образовывать водородные связи. Однако они не демонстрируют аномальных термодинамических , кинетических или структурных свойств, подобных тем, которые наблюдаются в воде, поскольку ни одна из них не может образовывать четыре водородные связи: либо они не могут отдавать или принимать атомы водорода, либо в объемных остатках присутствуют стерические эффекты. В воде межмолекулярные тетраэдрические структуры образуются из-за четырех водородных связей, тем самым образуя открытую структуру и трехмерную сеть связей, что приводит к аномальному снижению плотности при охлаждении ниже 4 °C. Эта повторяющаяся, постоянно реорганизующаяся единица определяет трехмерную сеть, простирающуюся по всей жидкости. Эта точка зрения основана на исследованиях нейтронного рассеяния и компьютерном моделировании, и она имеет смысл в свете однозначно тетраэдрического расположения молекул воды в ледяных структурах.
Однако существует альтернативная теория структуры воды. В 2004 году в противоречивой статье Стокгольмского университета было высказано предположение, что молекулы воды в жидком состоянии обычно связываются не с четырьмя, а только с двумя другими, образуя таким образом цепи и кольца. Был введен термин «струнная теория воды» (которую не следует путать с теорией струн в физике). Эти наблюдения были основаны на рентгеновской абсорбционной спектроскопии, которая исследовала локальное окружение отдельных атомов кислорода. [73]
Отталкивающие эффекты двух неподеленных пар на атоме кислорода приводят к тому, что вода имеет изогнутую , а не линейную молекулярную структуру, [74] что позволяет ей быть полярной. Угол водород-кислород-водород составляет 104,45°, что меньше 109,47° для идеальной sp 3 гибридизации . Объяснение теории валентных связей заключается в том, что неподеленные пары атома кислорода физически больше и, следовательно, занимают больше места, чем связи атома кислорода с атомами водорода. [75] Объяснение теории молекулярных орбиталей ( правило Бента ) заключается в том, что понижение энергии несвязывающих гибридных орбиталей атома кислорода (путем присвоения им большего s-характера и меньшего p-характера) и соответствующее повышение энергии гибридных орбиталей атома кислорода, связанных с атомами водорода (путем присвоения им большего p-характера и меньшего s-характера), имеет чистый эффект понижения энергии занятых молекулярных орбиталей, поскольку энергия несвязывающих гибридных орбиталей атома кислорода полностью вносит вклад в энергию неподеленных пар атома кислорода, тогда как энергия двух других гибридных орбиталей атома кислорода вносит лишь частичный вклад в энергию связывающих орбиталей (остальная часть вклада приходится на 1s-орбитали атомов водорода).
В жидкой воде происходит некоторая самоионизация с образованием ионов гидроксония и гидроксид- ионов.
Константа равновесия этой реакции, известная как ионное произведение воды, имеет значение около 10−14 при 25 °C. При нейтральном pH концентрация гидроксид- иона ( OH−
) равно (сольватированному) иону водорода ( H+
), со значением, близким к 10−7 моль л −1 при 25 °C. [76] См. страницу данных для значений при других температурах.
Константа термодинамического равновесия представляет собой частное от деления термодинамической активности всех продуктов и реагентов, включая воду:
Однако для разбавленных растворов активность растворенного вещества, такого как H 3 O + или OH −, аппроксимируется его концентрацией, а активность растворителя H 2 O аппроксимируется 1, так что мы получаем простое ионное произведение
Воздействие воды на горные породы в течение длительного периода времени обычно приводит к выветриванию и водной эрозии , физическим процессам, которые преобразуют твердые горные породы и минералы в почву и осадок, но при некоторых условиях происходят также химические реакции с водой, что приводит к метасоматизму или гидратации минералов , типу химического изменения горной породы, в результате которого образуются глинистые минералы . Это также происходит при затвердевании портландцемента .
Водяной лед может образовывать клатратные соединения , известные как клатратные гидраты , с различными небольшими молекулами, которые могут быть встроены в его просторную кристаллическую решетку. Наиболее заметным из них является клатрат метана , 4 CH
4·23ч
2O , в больших количествах естественным образом встречающийся на дне океана.
Дождь, как правило, умеренно кислый, с pH от 5,2 до 5,8, если в нем нет кислот сильнее углекислого газа. [77] Если в воздухе присутствует большое количество оксидов азота и серы , они также растворяются в облаках и каплях дождя, вызывая кислотные дожди .
Существует несколько изотопов водорода и кислорода, что приводит к нескольким известным изотопологам воды. Венский стандарт средней океанической воды является текущим международным стандартом для изотопов воды. Природная вода почти полностью состоит из безнейтронного изотопа водорода протия . Только 155 частей на миллион включают дейтерий (2
H или D), изотоп водорода с одним нейтроном, и менее 20 частей на квинтиллион включают тритий (3
H или T), который имеет два нейтрона. Кислород также имеет три стабильных изотопа, с16
O присутствует в 99,76%,17
О в 0,04% и18
O в 0,2% молекул воды. [78]
Оксид дейтерия, D
2O , также известен как тяжелая вода из-за своей более высокой плотности. Он используется в ядерных реакторах в качестве замедлителя нейтронов . Тритий радиоактивен , распадается с периодом полураспада 4500 дней; THO существует в природе только в незначительных количествах, в основном образуясь в результате ядерных реакций, вызванных космическими лучами в атмосфере. Вода с одним атомом протия и одним атомом дейтерия HDO встречается в природе в низких концентрациях (~0,03%) и D
2O в гораздо меньших количествах (0,000003%), и любые такие молекулы являются временными, поскольку атомы рекомбинируют.
Наиболее заметные физические различия между H
2О и Д
2O , помимо простого различия в удельной массе, включает свойства, на которые влияет водородная связь, такие как замерзание и кипение, и другие кинетические эффекты. Это происходит потому, что ядро дейтерия в два раза тяжелее протия, и это вызывает заметные различия в энергиях связи. Разница в температурах кипения позволяет разделять изотопологи. Коэффициент самодиффузии H
2O при 25 °C на 23% выше значения D
2O . [79] Поскольку молекулы воды обмениваются атомами водорода друг с другом, оксид дейтерия водорода (DOH) гораздо более распространен в тяжелой воде низкой чистоты, чем чистый оксид дидейтерия D
2О .
Потребление чистого изолированного D
2O может влиять на биохимические процессы — прием больших количеств нарушает функцию почек и центральной нервной системы. Небольшие количества могут потребляться без каких-либо побочных эффектов; люди, как правило, не замечают разницы во вкусе, [80] но иногда сообщают о жжении [81] или сладком привкусе. [82] Для проявления токсичности необходимо употребить очень большое количество тяжелой воды. Однако крысы способны избегать тяжелой воды по запаху, и она токсична для многих животных. [83]
Под легкой водой понимается вода с пониженным содержанием дейтерия (DDW), в которой содержание дейтерия снижено ниже стандартного уровня в 155 ppm .
Вода является самым распространенным веществом на поверхности Земли, а также третьей по распространенности молекулой во Вселенной после H
2и CO . [23] 0,23 ppm массы Земли составляет вода и 97,39% мирового объема воды, составляющего 1,38 × 109 км 3 находится в океанах. [84]
Вода гораздо более распространена во внешней Солнечной системе, за пределами точки, называемой линией замерзания , где излучение Солнца слишком слабое, чтобы испарять твердую и жидкую воду (а также другие элементы и химические соединения с относительно низкими температурами плавления, такие как метан и аммиак ). Во внутренней Солнечной системе планеты, астероиды и луны почти полностью состоят из металлов и силикатов. С тех пор вода была доставлена во внутреннюю Солнечную систему с помощью пока еще неизвестного механизма, теоретически предположительно являющегося ударами астероидов или комет, несущих воду из внешней Солнечной системы, где тела содержат гораздо больше водяного льда. [85] Разница между планетарными телами, расположенными внутри и за пределами линии замерзания, может быть разительной. Масса Земли составляет 0,000023% воды, в то время как Тефия , луна Сатурна, почти полностью состоит из воды. [86]
Вода амфотерна : она способна действовать как кислота или основание в химических реакциях. [87] Согласно определению Бренстеда-Лоури , кислота — это протон ( H+) донор, а основание является акцептором протона. [88] При реакции с более сильной кислотой вода действует как основание; при реакции с более сильным основанием она действует как кислота. [88] Например, вода получает H+
ион из HCl при образовании соляной кислоты :
В реакции с аммиаком NH
3, вода отдает H+
ион, и таким образом действует как кислота:
Поскольку атом кислорода в воде имеет две неподеленные пары , вода часто действует как основание Льюиса или донор электронной пары в реакциях с кислотами Льюиса , хотя она также может реагировать с основаниями Льюиса, образуя водородные связи между донорами электронной пары и атомами водорода воды. Теория HSAB описывает воду как слабую жесткую кислоту и слабое жесткое основание, что означает, что она реагирует преимущественно с другими жесткими видами:
Когда соль слабой кислоты или слабого основания растворяется в воде, вода может частично гидролизовать соль, образуя соответствующее основание или кислоту, что придает водным растворам мыла и пищевой соды их основной pH:
Характерные для воды свойства основания Льюиса делают ее распространенным лигандом в комплексах переходных металлов , примерами которых являются такие аквакомплексы металлов, как Fe(H
2О)2+
6к перрениевой кислоте , которая содержит две молекулы воды, координированные с рениевым центром. В твердых гидратах вода может быть либо лигандом, либо просто заложенной в каркасе, либо и тем, и другим. Таким образом, FeSO
4·7H
2O состоит из центров [Fe 2 (H 2 O) 6 ] 2+ и одной «решеточной воды». Вода обычно является монодентатным лигандом, т.е. образует только одну связь с центральным атомом. [89]

Как твердое основание, вода легко реагирует с органическими карбокатионами ; например, в реакции гидратации гидроксильная группа ( ОН−
) и кислотный протон добавляются к двум атомам углерода, связанным вместе в углерод-углеродной двойной связи, в результате чего образуется спирт. Когда добавление воды к органической молекуле расщепляет молекулу на две части, говорят, что происходит гидролиз . Известными примерами гидролиза являются омыление жиров и переваривание белков и полисахаридов . Вода также может быть уходящей группой в реакциях замещения S N 2 и элиминирования E2 ; последняя тогда известна как реакция дегидратации .
Вода содержит водород в степени окисления +1 и кислород в степени окисления −2. [90] Она окисляет химические вещества, такие как гидриды , щелочные металлы и некоторые щелочноземельные металлы. [91] [92] Один из примеров реакции щелочного металла с водой: [93]
Некоторые другие химически активные металлы, такие как алюминий и бериллий , также окисляются водой, но их оксиды прилипают к металлу и образуют пассивный защитный слой. [94] Обратите внимание, что ржавление железа представляет собой реакцию между железом и кислородом [95] , который растворяется в воде, а не между железом и водой.
Вода может окисляться с выделением газообразного кислорода, но очень немногие окислители реагируют с водой, даже если их восстановительный потенциал больше, чем потенциал O
2/ЧАС
2O. Почти все такие реакции требуют катализатора . [96] Пример окисления воды:
Воду можно разделить на ее составные элементы, водород и кислород, пропуская через нее электрический ток. [97] Этот процесс называется электролизом. Катодная полуреакция:
Анодная полуреакция:
Образующиеся газы пузырятся на поверхности, где их можно собрать или поджечь пламенем над водой, если это было задумано. Требуемый потенциал для электролиза чистой воды составляет 1,23 В при 25 °C. [97] Рабочий потенциал на самом деле составляет 1,48 В или выше при практическом электролизе.
Генри Кавендиш показал, что вода состоит из кислорода и водорода в 1781 году. [98] Первое разложение воды на водород и кислород с помощью электролиза было осуществлено в 1800 году английскими химиками Уильямом Николсоном и Энтони Карлайлом . [98] [99] В 1805 году Жозеф Луи Гей-Люссак и Александр фон Гумбольдт показали, что вода состоит из двух частей водорода и одной части кислорода. [100]
Гилберт Ньютон Льюис выделил первый образец чистой тяжелой воды в 1933 году. [101]
Свойства воды исторически использовались для определения различных температурных шкал . В частности, шкалы Кельвина , Цельсия , Ранкина и Фаренгейта были или в настоящее время определяются точками замерзания и кипения воды. Менее распространенные шкалы Делиля , Ньютона , Реомюра и Рёмера были определены аналогичным образом. Тройная точка воды является сегодня более часто используемой стандартной точкой.
Принятое название воды по ИЮПАК – оксидан или просто вода [102] или его эквивалент на разных языках, хотя существуют и другие систематические названия, которые можно использовать для описания молекулы. Оксидан предназначен только для использования в качестве названия одноядерного родительского гидрида, используемого для наименования производных воды по номенклатуре заместителей [103] . Эти производные обычно имеют другие рекомендуемые названия. Например, название гидроксил рекомендуется вместо оксиданила для группы –ОН. Название оксан явно упоминается ИЮПАК как неподходящее для этой цели, поскольку оно уже является названием циклического эфира, также известного как тетрагидропиран [3] [104] .
Простейшее систематическое название воды — оксид водорода . Это аналогично родственным соединениям, таким как перекись водорода , сероводород и оксид дейтерия (тяжелая вода). Используя химическую номенклатуру для ионных бинарных соединений типа I , вода получила бы название оксид водорода , [105] но это не входит в число названий, опубликованных Международным союзом теоретической и прикладной химии (ИЮПАК). [102] Другое название — дигидроген монооксид , которое является редко используемым названием воды и в основном используется в пародии на дигидроген монооксид .
Другие систематические названия воды включают гидроксокислоту , гидроксильную кислоту и гидроокись водорода , используя названия кислот и оснований. [j] Ни одно из этих экзотических названий не используется широко. Поляризованная форма молекулы воды, H+
ОЙ−
, также называется гидрогидроксидом гидрона по номенклатуре ИЮПАК. [106]
Водная субстанция — редкий термин, используемый для обозначения H2O , когда не требуется указывать фазу вещества (жидкая вода , водяной пар , некоторая форма льда или компонент смеси), хотя термин «вода» также используется в этом общем значении.
Дигидрид кислорода — это еще один способ обозначения воды, но современное использование часто ограничивает термин « гидрид » ионными соединениями (которыми вода не является).
эти соединения имеют общие или общепринятые названия (например, H2O — это «вода»), а также систематические названия (например, H2O, монооксид дигидрогена).
Потепление океана доминирует в глобальном инвентаре изменения энергии. Потепление океана составляет около 93% увеличения энергетического запаса Земли между 1971 и 2010 годами (высокая достоверность), при этом потепление верхнего (0-700 м) океана составляет около 64% от общего количества. Таяние льда (включая арктический морской лед, ледяные щиты и ледники) и потепление континентов и атмосферы объясняют оставшуюся часть изменения энергии.
Gramme
, le poids absolu d'un Volume d'eau pure egal au Cube de la Centième Party du Metre, et à la température de la Glace Fondante.
{{cite web}}: CS1 maint: unfit URL (link)Вода, H 2 O, похожа. У нее есть две электронные пары, к которым ничего не прикреплено. Их тоже нужно учитывать. Молекулы, подобные NH 3 и H 2 O, называются изогнутыми .
Обратите внимание, что углы связи уменьшаются по мере увеличения числа несвязывающих электронных пар. Связывающая пара электронов притягивается обоими ядрами связанных атомов, но несвязывающая пара притягивается в основном только одним ядром. Поскольку несвязывающая пара испытывает меньшее ядерное притяжение, ее электронный домен больше распространен в пространстве, чем электронный домен для связывающей пары (рисунок 9.7). Поэтому несвязывающие электронные пары занимают больше места, чем связывающие пары; по сути, они действуют как большие и более толстые воздушные шары в нашей аналогии с рисунком 9.5. В результате электронные домены для несвязывающих электронных пар оказывают большие силы отталкивания на соседние электронные домены и имеют тенденцию сжимать углы связи