В химии орбитальная гибридизация (или гибридизация ) — это концепция смешивания атомных орбиталей для образования новых гибридных орбиталей (с другими энергиями, формами и т. д., чем у компонентных атомных орбиталей), подходящих для спаривания электронов для образования химических связей в теории валентных связей . Например, в атоме углерода, который образует четыре одинарные связи, валентная s-орбиталь объединяется с тремя валентными p-орбиталями для образования четырех эквивалентных sp3 - смесей в тетраэдрическом расположении вокруг углерода для связи с четырьмя различными атомами. Гибридные орбитали полезны для объяснения молекулярной геометрии и свойств атомных связей и симметрично расположены в пространстве. Обычно гибридные орбитали образуются путем смешивания атомных орбиталей сопоставимых энергий. [1]
Химик Лайнус Полинг впервые разработал теорию гибридизации в 1931 году для объяснения структуры простых молекул, таких как метан (CH 4 ), с использованием атомных орбиталей . [2] Полинг указал, что атом углерода образует четыре связи, используя одну s- и три p-орбитали, так что «можно сделать вывод», что атом углерода образует три связи под прямым углом (используя p-орбитали) и четвертую более слабую связь, используя s-орбиталь в некотором произвольном направлении. В действительности метан имеет четыре связи C–H эквивалентной прочности. Угол между любыми двумя связями является тетраэдрическим углом связи 109°28' [3] (около 109,5°). Полинг предположил, что в присутствии четырех атомов водорода s- и p-орбитали образуют четыре эквивалентные комбинации, которые он назвал гибридными орбиталями. Каждый гибрид обозначается sp 3 для указания его состава и направлен вдоль одной из четырех связей C–H. [4] Эта концепция была разработана для таких простых химических систем, но подход позже стал применяться более широко, и сегодня он считается эффективной эвристикой для рационализации структур органических соединений . Он дает простую орбитальную картину, эквивалентную структурам Льюиса .
Теория гибридизации является неотъемлемой частью органической химии , одним из наиболее убедительных примеров являются правила Болдуина . Для рисования механизмов реакции иногда требуется классическая картина связи с двумя атомами, разделяющими два электрона. [5] Теория гибридизации объясняет связь в алкенах [6] и метане. [7] Количество p-характера или s-характера, которое определяется в основном орбитальной гибридизацией, может быть использовано для надежного предсказания молекулярных свойств, таких как кислотность или основность. [8]
Орбитали — это модельное представление поведения электронов внутри молекул. В случае простой гибридизации это приближение основано на атомных орбиталях , подобных тем, что получены для атома водорода, единственного нейтрального атома, для которого уравнение Шредингера может быть решено точно. В более тяжелых атомах, таких как углерод, азот и кислород, в качестве атомных орбиталей используются 2s- и 2p-орбитали, аналогичные орбиталям возбужденного состояния для водорода.
Гибридные орбитали считаются смесями атомных орбиталей, наложенных друг на друга в различных пропорциях. Например, в метане гибридная орбиталь C, которая образует каждую связь углерод – водород, состоит из 25% s-характера и 75% p-характера и, таким образом, описывается как sp 3 (читается как sp-три ) гибридизированная. Квантовая механика описывает этот гибрид как волновую функцию sp 3 вида , где N - константа нормировки (здесь 1/2), а pσ - это ap-орбиталь, направленная вдоль оси CH для образования сигма-связи . Отношение коэффициентов (в общем случае обозначаемое λ) в этом примере равно. Поскольку электронная плотность, связанная с орбиталью, пропорциональна квадрату волновой функции, отношение p-характера к s-характеру равно λ 2 = 3. P-характер или вес p-компоненты равен N 2 λ 2 = 3/4.

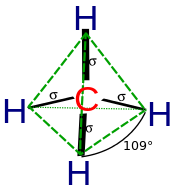
Гибридизация описывает связь атомов с точки зрения атома. Для тетраэдрически координированного углерода (например, метан CH 4 ) углерод должен иметь 4 орбитали, направленные к 4 атомам водорода.
Конфигурация основного состояния углерода имеет вид 1s 2 2s 2 2p 2 или более, что легко читается:
Эта диаграмма предполагает, что атом углерода может использовать свои две однократно занятые орбитали p-типа для образования двух ковалентных связей с двумя атомами водорода в молекуле метилена (CH2 ) с гипотетическим углом связи 90°, соответствующим углу между двумя p-орбиталями на одном и том же атоме. Однако истинный угол H–C–H в синглетном метилене составляет около 102° [9] , что подразумевает наличие некоторой гибридизации орбиталей.
Атом углерода также может связываться с четырьмя атомами водорода в метане путем возбуждения (или продвижения) электрона с дважды занятой 2s-орбитали на пустую 2p-орбиталь, в результате чего образуются четыре однократно занятые орбитали.
Энергия, высвобождаемая при образовании двух дополнительных связей, более чем компенсирует необходимую энергию возбуждения, энергетически благоприятствуя образованию четырех связей CH.
Согласно квантовой механике, самая низкая энергия получается, если четыре связи эквивалентны, что требует, чтобы они были образованы из эквивалентных орбиталей на углероде. Можно получить набор из четырех эквивалентных орбиталей, которые являются линейными комбинациями волновых функций s и p валентной оболочки (остовные орбитали почти никогда не участвуют в связывании), [10] , которые являются четырьмя гибридами sp 3 .
В CH4 четыре гибридные sp3 - орбитали перекрываются водородными 1s-орбиталями, что приводит к образованию четырех σ-связей (то есть четырех одинарных ковалентных связей) одинаковой длины и прочности.
Следующее :

переводится как:


Другие углеродные соединения и другие молекулы можно объяснить аналогичным образом. Например, этен (C 2 H 4 ) имеет двойную связь между атомами углерода.
Для этой молекулы углерод sp 2 гибридизуется, поскольку для двойной связи между углеродами требуется одна π (пи) связь , а на атом углерода образуются только три σ связи. При sp 2 гибридизации 2s-орбиталь смешивается только с двумя из трех доступных 2p-орбиталей, обычно обозначаемых как 2p x и 2p y . Третья 2p-орбиталь (2p z ) остается негибридизованной.
образуя в общей сложности три sp 2 -орбитали с одной оставшейся p-орбиталью. В этене два атома углерода образуют σ-связь путем перекрытия одной sp 2 -орбитали от каждого атома углерода. π-связь между атомами углерода, перпендикулярная молекулярной плоскости, образована перекрытием 2p–2p. Каждый атом углерода образует ковалентные связи C–H с двумя атомами водорода путем перекрытия s–sp 2 , все с углами связи 120°. Связи водород–углерод все имеют одинаковую прочность и длину, что согласуется с экспериментальными данными.

Химическая связь в соединениях, таких как алкины с тройными связями, объясняется sp-гибридизацией. В этой модели 2s-орбиталь смешивается только с одной из трех p-орбиталей,
в результате чего образуются две sp-орбитали и две оставшиеся p-орбитали. Химическая связь в ацетилене (этине) (C 2 H 2 ) состоит из sp–sp-перекрытия между двумя атомами углерода, образующими σ-связь, и двух дополнительных π-связей, образованных p–p-перекрытием. Каждый углерод также связывается с водородом в σ-s–sp-перекрытии под углами 180°.

Гибридизация помогает объяснить форму молекулы , поскольку углы между связями приблизительно равны углам между гибридными орбиталями. Это контрастирует с теорией отталкивания электронных пар валентной оболочки (VSEPR) , которая может быть использована для предсказания молекулярной геометрии на основе эмпирических правил, а не на теориях валентных связей или орбиталей. [11]
Поскольку валентные орбитали элементов основной группы представляют собой одну s- и три p-орбитали с соответствующим правилом октета , для моделирования формы этих молекул используется spx - гибридизация.
Поскольку валентные орбитали переходных металлов представляют собой пять d, одну s и три p-орбитали с соответствующим правилом 18 электронов , для моделирования формы этих молекул используется гибридизация sp x dy . Эти молекулы, как правило, имеют несколько форм, соответствующих одной и той же гибридизации из-за различных вовлеченных d-орбиталей. Квадратный плоский комплекс имеет одну незанятую p-орбиталь и, следовательно , имеет 16 валентных электронов. [13]
В некоторых комплексах переходных металлов с низким числом d-электронов p-орбитали не заняты, и для моделирования формы этих молекул используется sd x- гибридизация. [12] [14] [13]
В некоторых учебниках по общей химии гибридизация представлена для главной группы с координационным числом 5 и выше с использованием схемы «расширенного октета» с d-орбиталями, впервые предложенной Полингом. Однако такая схема в настоящее время считается неверной в свете расчетов вычислительной химии.
В 1990 году Эрик Альфред Магнуссон из Университета Нового Южного Уэльса опубликовал статью, в которой окончательно исключил роль гибридизации d-орбиталей в образовании связей в гипервалентных соединениях элементов второго ряда ( период 3 ), положив конец спору и путанице. Часть путаницы возникает из-за того, что d-функции играют существенную роль в базисных наборах, используемых для описания этих соединений (иначе возникают неоправданно высокие энергии и искаженные геометрии). Кроме того, вклад d-функции в молекулярную волновую функцию велик. Эти факты были неверно интерпретированы как означающие, что d-орбитали должны участвовать в образовании связей. [15] [16]
В свете вычислительной химии лучшим подходом было бы вызвать резонанс сигма-связи в дополнение к гибридизации, что подразумевает, что каждая резонансная структура имеет свою собственную схему гибридизации. Все резонансные структуры должны подчиняться правилу октета . [17]
В то время как простая модель орбитальной гибридизации обычно используется для объяснения молекулярной формы, гибридизация используется по-другому при вычислении в современных программах валентных связей. В частности, гибридизация не определяется априори , а вместо этого вариационно оптимизируется для нахождения решения с наименьшей энергией, а затем сообщается. Это означает, что все искусственные ограничения, в частности два ограничения, на орбитальную гибридизацию снимаются:
Это означает, что на практике гибридные орбитали не соответствуют простым идеям, которым обычно учат, и поэтому в научных расчетных работах их просто называют гибридами sp x , sp x dy или sd x , чтобы выразить их природу вместо более конкретных целочисленных значений.
Хотя идеальные гибридные орбитали могут быть полезны, в действительности для большинства связей требуются орбитали промежуточного характера. Это требует расширения для включения гибких весов атомных орбиталей каждого типа (s, p, d) и позволяет количественно описывать образование связи, когда молекулярная геометрия отклоняется от идеальных углов связи. Количество p-характера не ограничивается целыми значениями; т. е. гибридизации, такие как sp 2.5, также легко описываются.
Гибридизация орбиталей связей определяется правилом Бента : «Атомный характер концентрируется на орбиталях, направленных к электроположительным заместителям».
Для молекул с неподеленными парами связывающие орбитали являются изовалентными sp x гибридами. Например, две образующие связь гибридные орбитали кислорода в воде можно описать как sp 4,0, что даст межорбитальный угол 104,5°. [18] Это означает, что они имеют 20% s-характера и 80% p-характера, и не подразумевает, что гибридная орбиталь образована из одной s- и четырех p-орбиталей на кислороде, поскольку 2p-подоболочка кислорода содержит только три p-орбитали.
Гибридизация s- и p-орбиталей для образования эффективных sp x- гибридов требует, чтобы они имели сопоставимую радиальную протяженность. В то время как 2p-орбитали в среднем менее чем на 10% больше, чем 2s, отчасти из-за отсутствия радиального узла в 2p-орбиталях, 3p-орбитали, которые имеют один радиальный узел, превосходят 3s-орбитали на 20–33%. [19] Разница в протяженности s- и p-орбиталей увеличивается далее вниз по группе. Гибридизацию атомов в химических связях можно проанализировать, рассматривая локализованные молекулярные орбитали, например, используя естественные локализованные молекулярные орбитали в схеме естественных орбиталей связи (NBO). В метане , CH4 , расчетное отношение p/s приблизительно равно 3, что соответствует «идеальной» sp 3 -гибридизации, тогда как для силана , SiH4 , отношение p/s ближе к 2. Подобная тенденция наблюдается и для других 2p-элементов. Замена водорода на фтор еще больше снижает отношение p/s. [20] Элементы 2p демонстрируют почти идеальную гибридизацию с ортогональными гибридными орбиталями. Для более тяжелых элементов p-блока это предположение об ортогональности не может быть оправдано. Эти отклонения от идеальной гибридизации были названы дефектами гибридизации Кутцелниггом . [ 21]
Однако вычислительные группы VB, такие как Джерратт, Купер и Раймонди (SCVB), а также Шайк и Хиберти (VBSCF), идут еще дальше, утверждая, что даже для модельных молекул, таких как метан, этилен и ацетилен, гибридные орбитали уже дефектны и неортогональны, с гибридизациями, такими как sp 1,76 вместо sp 3 для метана. [22]
Одно из заблуждений относительно орбитальной гибридизации заключается в том, что она неправильно предсказывает ультрафиолетовые фотоэлектронные спектры многих молекул. Хотя это верно, если теорема Купманса применяется к локализованным гибридам, квантовая механика требует, чтобы (в данном случае ионизированная) волновая функция подчинялась симметрии молекулы, что подразумевает резонанс в теории валентных связей. Например, в метане ионизированные состояния (CH 4 + ) могут быть построены из четырех резонансных структур, приписывающих выброшенный электрон каждой из четырех sp 3 орбиталей. Линейная комбинация этих четырех структур, сохраняющая число структур, приводит к трижды вырожденному состоянию T 2 и состоянию A 1 . [23] [24] Разница в энергии между каждым ионизированным состоянием и основным состоянием будет равна энергии ионизации , что дает два значения в соответствии с экспериментальными результатами.
Связывающие орбитали, образованные из гибридных атомных орбиталей, можно рассматривать как локализованные молекулярные орбитали, которые могут быть образованы из делокализованных орбиталей теории молекулярных орбиталей с помощью соответствующего математического преобразования. Для молекул в основном состоянии это преобразование орбиталей оставляет общую многоэлектронную волновую функцию неизменной. Гибридное орбитальное описание основного состояния, таким образом, эквивалентно делокализованному орбитальному описанию для полной энергии и электронной плотности основного состояния, а также молекулярной геометрии, которая соответствует минимальному значению полной энергии.

Молекулы с множественными связями или множественными неподеленными парами могут иметь орбитали, представленные в терминах сигма- и пи-симметрии или эквивалентных орбиталей. Различные методы валентных связей используют любое из двух представлений, которые имеют математически эквивалентные полные многоэлектронные волновые функции и связаны унитарным преобразованием набора занятых молекулярных орбиталей.
Для кратных связей сигма-пи-представление является преобладающим по сравнению с эквивалентным орбитальным ( изогнутым ) представлением. Напротив, для множественных неподеленных пар большинство учебников используют эквивалентное орбитальное представление. Однако сигма-пи-представление также используется, например, Вайнхолдом и Ландисом в контексте естественных орбиталей связи , локализованной орбитальной теории, содержащей модернизированные аналоги классических (валентная связь/структура Льюиса) пар связывания и неподеленных пар. [25] Например, для молекулы фторида водорода две неподеленные пары F по существу являются негибридизованными p-орбиталями, в то время как другая является гибридной sp x -орбиталью. Аналогичное рассмотрение применимо к воде (одна неподеленная пара O находится в чистой p-орбитали, другая - в гибридной sp x -орбитали).