
В науке о поверхности двойной слой ( DL , также называемый двойным электрическим слоем , EDL ) — это структура, которая появляется на поверхности объекта, когда он подвергается воздействию жидкости . Объект может быть твердой частицей, газовым пузырьком , каплей жидкости или пористым телом . DL относится к двум параллельным слоям заряда , окружающим объект. Первый слой, поверхностный заряд (положительный или отрицательный), состоит из ионов , которые адсорбируются на объекте из-за химических взаимодействий . Второй слой состоит из ионов, притягиваемых к поверхностному заряду посредством силы Кулона , электрически экранируя первый слой. Этот второй слой слабо связан с объектом. Он состоит из свободных ионов, которые перемещаются в жидкости под действием электрического притяжения и теплового движения , а не жестко закреплены. Поэтому его называют «диффузным слоем».
Интерфейсные DL наиболее очевидны в системах с большим отношением площади поверхности к объему , таких как коллоидные или пористые тела с частицами или порами (соответственно) в масштабе от микрометров до нанометров . Однако DL важны для других явлений, таких как электрохимическое поведение электродов .
DL играют фундаментальную роль во многих повседневных веществах. Например, гомогенизированное молоко существует только потому, что капли жира покрыты DL, которая предотвращает их коагуляцию в масло . DL существуют практически во всех гетерогенных жидкостных системах, таких как кровь, краска, чернила, керамический и цементный раствор .
ДЛ тесно связана с электрокинетическими явлениями и электроакустическими явлениями .

Когда электронный проводник приводится в контакт с твердым или жидким ионным проводником (электролитом), между двумя фазами появляется общая граница ( интерфейс ). Герман фон Гельмгольц [1] был первым, кто понял, что заряженные электроды, погруженные в растворы электролитов, отталкивают коионы заряда, притягивая противоионы к своим поверхностям. На границе между электродом и электролитом образуются два слоя противоположной полярности . В 1853 году он показал, что двойной электрический слой (ДС) по сути является молекулярным диэлектриком и хранит заряд электростатически. [2] Ниже напряжения разложения электролита сохраненный заряд линейно зависит от приложенного напряжения.
Эта ранняя модель предсказывала постоянную дифференциальную емкость, независимую от плотности заряда, зависящую от диэлектрической проницаемости электролитного растворителя и толщины двойного слоя. [3] [4] [5]
Эта модель, хотя и является хорошей основой для описания интерфейса, не учитывает важные факторы, включая диффузию/смешивание ионов в растворе, возможность адсорбции на поверхности и взаимодействие между дипольными моментами растворителя и электрода.
Луи Жорж Гуи в 1910 году и Дэвид Леонард Чепмен в 1913 году оба наблюдали, что емкость не является константой и зависит от приложенного потенциала и ионной концентрации. «Модель Гуи–Чепмена» внесла значительные улучшения, введя диффузную модель DL. В этой модели распределение заряда ионов как функция расстояния от поверхности металла позволяет применять статистику Максвелла–Больцмана . Таким образом, электрический потенциал экспоненциально уменьшается от поверхности объема жидкости. [3] [6]
Слои Гуи-Чепмена могут иметь особое значение в биоэлектрохимии. Наблюдение за межбелковым переносом электронов на большие расстояния через водный раствор [7] было приписано диффузной области между окислительно-восстановительными белками-партнерами ( цитохромами c и c 1 ), которая обеднена катионами по сравнению с основной массой раствора, что приводит к уменьшению экранирования , электрическим полям, простирающимся на несколько нанометров, и токам, уменьшающимся квазиэкспоненциально с расстоянием со скоростью ~1 нм −1 . Эта область называется «каналом Гуи-Чепмена» [7] и строго регулируется фосфорилированием , которое добавляет один отрицательный заряд к поверхности белка, что нарушает катионное истощение и предотвращает перенос заряда на большие расстояния. [8] Аналогичные эффекты наблюдаются в окислительно-восстановительном активном центре фотосинтетических комплексов . [9]
Модель Гуи-Чепмена не работает для сильно заряженных DL. В 1924 году Отто Штерн предложил объединить модель Гельмгольца с моделью Гуи-Чепмена: в модели Штерна некоторые ионы прилипают к электроду, как предполагал Гельмгольц, создавая внутренний слой Штерна, в то время как некоторые образуют диффузный слой Гуи-Чепмена. [10]
Слой Штерна учитывает конечный размер ионов, и, следовательно, ближайший подход иона к электроду составляет порядка ионного радиуса. Модель Штерна имеет свои собственные ограничения, а именно, что она эффективно рассматривает ионы как точечные заряды, предполагает, что все значимые взаимодействия в диффузном слое являются кулоновскими , предполагает, что диэлектрическая проницаемость постоянна по всему двойному слою, и что вязкость жидкости постоянна в плоскости. [11]

В 1947 году DC Grahame модифицировал модель Stern. [12] Он предположил, что некоторые ионные или незаряженные виды могут проникать в слой Stern, хотя ближайший подход к электроду обычно занят молекулами растворителя. Это может произойти, если ионы теряют свою сольватную оболочку по мере приближения к электроду. Он назвал ионы, находящиеся в непосредственном контакте с электродом, «специфически адсорбированными ионами». Эта модель предполагала существование трех областей. Внутренняя плоскость Гельмгольца (IHP) проходит через центры специфически адсорбированных ионов. Внешняя плоскость Гельмгольца (OHP) проходит через центры сольватированных ионов на расстоянии их наибольшего приближения к электроду. [13] Наконец, диффузный слой — это область за OHP.
В 1963 году Дж. О'М. Бокрис , М.А.В. Деванатан и Клаус Мюллер [14] предложили модель двойного слоя BDM, которая включала действие растворителя в интерфейсе. Они предположили, что прикрепленные молекулы растворителя, такие как вода, будут иметь фиксированное выравнивание по отношению к поверхности электрода. Этот первый слой молекул растворителя демонстрирует сильную ориентацию к электрическому полю в зависимости от заряда. Эта ориентация оказывает большое влияние на диэлектрическую проницаемость растворителя, которая изменяется с напряженностью поля. IHP проходит через центры этих молекул. В этом слое появляются специфически адсорбированные, частично сольватированные ионы. Сольватированные ионы электролита находятся вне IHP. Через центры этих ионов проходит OHP. Диффузный слой — это область за OHP.
Дальнейшие исследования с двойными слоями на пленках диоксида рутения в 1971 году Серджио Трасатти и Джованни Буццанка продемонстрировали, что электрохимическое поведение этих электродов при низких напряжениях с определенными адсорбированными ионами было похоже на поведение конденсаторов. Специфическая адсорбция ионов в этой области потенциала также могла включать частичный перенос заряда между ионом и электродом. Это был первый шаг к пониманию псевдоемкости. [4]
В период с 1975 по 1980 год Брайан Эванс Конвей провел обширную фундаментальную и опытно-конструкторскую работу по электрохимическим конденсаторам на основе оксида рутения . В 1991 году он описал разницу между поведением «суперконденсатора» и «батареи» в электрохимическом хранении энергии. В 1999 году он ввел термин «суперконденсатор», чтобы объяснить повышенную емкость за счет поверхностных окислительно-восстановительных реакций с фарадеевским переносом заряда между электродами и ионами. [15] [16]
Его «суперконденсатор» хранил электрический заряд частично в двойном слое Гельмгольца, а частично в результате фарадеевских реакций с «псевдоемкостным» переносом заряда электронов и протонов между электродом и электролитом. Рабочие механизмы псевдоконденсаторов — окислительно-восстановительные реакции, интеркаляция и электросорбция.
Физические и математические основы переноса заряда электрона в отсутствие химических связей, приводящие к псевдоемкости, были разработаны Рудольфом А. Маркусом . Теория Маркуса объясняет скорости реакций переноса электронов — скорость, с которой электрон может перемещаться из одного химического вида в другой. Первоначально она была сформулирована для рассмотрения реакций переноса электронов во внешней сфере , в которых два химических вида изменяют только свой заряд, с перескоком электрона. Для окислительно-восстановительных реакций без создания или разрыва связей теория Маркуса заменяет теорию переходного состояния Генри Эйринга , которая была выведена для реакций со структурными изменениями. Маркус получил Нобелевскую премию по химии в 1992 году за эту теорию. [17]
Подробные описания интерфейсного DL имеются во многих книгах по коллоидной и интерфейсной науке [18] [19] [20] и микромасштабному переносу жидкости. [21] [22] Также имеется недавний технический отчет ИЮПАК [23] по теме интерфейсного двойного слоя и связанных с ним электрокинетических явлений .
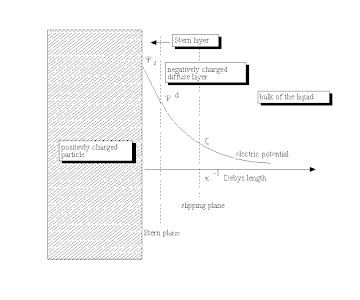
Как утверждает Лайклема, «...причиной образования «расслабленного» («равновесного») двойного слоя является неэлектрическое сродство ионов, определяющих заряд, к поверхности...» [24] Этот процесс приводит к накоплению электрического поверхностного заряда , выражаемого обычно в Кл/м 2 . Этот поверхностный заряд создает электростатическое поле, которое затем воздействует на ионы в объеме жидкости. Это электростатическое поле в сочетании с тепловым движением ионов создает встречный заряд и, таким образом, экранирует электрический поверхностный заряд. Чистый электрический заряд в этом экранирующем диффузном слое равен по величине чистому поверхностному заряду, но имеет противоположную полярность. В результате вся структура электрически нейтральна.
Диффузный слой или, по крайней мере, его часть может перемещаться под действием касательного напряжения . Существует условно введенная плоскость скольжения, которая отделяет подвижную жидкость от жидкости, которая остается прикрепленной к поверхности. Электрический потенциал на этой плоскости называется электрокинетическим потенциалом или дзета-потенциалом (также обозначается как ζ-потенциал). [25] [26]
Электрический потенциал на внешней границе слоя Штерна по отношению к объему электролита называется потенциалом Штерна . Разность электрических потенциалов между объемом жидкости и поверхностью называется электрическим поверхностным потенциалом.
Обычно для оценки степени заряда DL используют дзета-потенциал . Характерное значение этого электрического потенциала в DL составляет 25 мВ с максимальным значением около 100 мВ (до нескольких вольт на электродах [22] [27] ). Химический состав образца, при котором ζ-потенциал равен 0, называется точкой нулевого заряда или изоэлектрической точкой . Обычно он определяется значением pH раствора, поскольку для большинства поверхностей зарядоопределяющими ионами являются протоны и гидроксильные ионы. [22] [24]
Дзета-потенциал можно измерить с помощью электрофореза , электроакустических явлений , потенциала течения и электроосмотического потока .
Характерная толщина DL — это длина Дебая , κ −1 . Она обратно пропорциональна квадратному корню из концентрации ионов C. В водных растворах она обычно составляет несколько нанометров, а толщина уменьшается с увеличением концентрации электролита.
Напряженность электрического поля внутри DL может быть от нуля до более 10 9 В/м. Эти крутые градиенты электрического потенциала являются причиной важности DL.
Теорию для плоской поверхности и симметричного электролита [24] обычно называют теорией Гуи-Чепмена. Она дает простую связь между электрическим зарядом в диффузном слое σ d и потенциалом Штерна Ψ d : [28]
Не существует общего аналитического решения для смешанных электролитов, искривленных поверхностей или даже сферических частиц. Существует асимптотическое решение для сферических частиц с низкозаряженными DL. В случае, когда электрический потенциал над DL меньше 25 мВ, справедливо так называемое приближение Дебая-Хюккеля. Оно дает следующее выражение для электрического потенциала Ψ в сферическом DL как функции расстояния r от центра частицы:
Существует несколько асимптотических моделей, которые играют важную роль в теоретических разработках, связанных с интерфейсным ДЛ.
Первая — «тонкая DL». Эта модель предполагает, что DL намного тоньше радиуса коллоидной частицы или капилляра. Это ограничивает значение длины Дебая и радиуса частицы следующим образом:
Эта модель предлагает огромные упрощения для многих последующих приложений. Теория электрофореза — всего лишь один пример. [29] Теория электроакустических явлений — еще один пример. [30]
Тонкая модель DL действительна для большинства водных систем, поскольку длина Дебая в таких случаях составляет всего несколько нанометров. Она нарушается только для наноколлоидов в растворе с ионной силой, близкой к воде.
Противоположная модель «толстого ДЛ» предполагает, что длина Дебая больше радиуса частицы:
Эта модель может быть полезна для некоторых наноколлоидов и неполярных жидкостей, где длина Дебая значительно больше.
Последняя модель вводит «перекрывающиеся ДЛ». [30] Это важно в концентрированных дисперсиях и эмульсиях, когда расстояния между частицами становятся сравнимыми с длиной Дебая.
Двойной электрический слой ( ДЭС ) является результатом изменения электрического потенциала вблизи поверхности и оказывает существенное влияние на поведение коллоидов и других поверхностей, контактирующих с растворами или твердотельными проводниками быстрых ионов .
Основное различие между двойным слоем на электроде и двойным слоем на интерфейсе заключается в механизме формирования поверхностного заряда . С помощью электрода можно регулировать поверхностный заряд, прикладывая внешний электрический потенциал. Однако такое применение невозможно в коллоидных и пористых двойных слоях, поскольку для коллоидных частиц нет доступа к внутренней части частицы для приложения разности потенциалов.
ДЭС аналогичны двойному слою в плазме .
У EDL есть дополнительный параметр, определяющий их характеристику: дифференциальная емкость . Дифференциальная емкость, обозначаемая как C , описывается уравнением ниже:
где σ — поверхностный заряд , а ψ — электрический поверхностный потенциал .
Традиционно предполагалось, что формирование двойного электрического слоя (EDL) полностью контролируется адсорбцией и перераспределением ионов. Учитывая тот факт, что контактная электризация между твердым телом контролируется переносом электронов, Ван предполагает, что EDL формируется в результате двухэтапного процесса. [31] На первом этапе, когда молекулы в растворе сначала приближаются к чистой поверхности, которая не имеет предварительно существующих поверхностных зарядов, может быть возможным, что атомы/молекулы в растворе напрямую взаимодействуют с атомами на твердой поверхности, образуя сильное перекрытие электронных облаков. Сначала происходит перенос электронов, чтобы заставить «нейтральные» атомы на твердой поверхности стать заряженными, т. е. образование ионов. На втором этапе, если в жидкости присутствуют ионы, такие как H + и OH – , слабо распределенные отрицательные ионы в растворе будут притягиваться для миграции к связанным с поверхностью ионам из-за электростатических взаимодействий, образуя EDL. Как перенос электронов, так и перенос ионов сосуществуют на границе раздела жидкость-твердое тело. [32]
