Исследования травм спинного мозга ищут новые способы лечения или лечения травм спинного мозга , чтобы уменьшить изнурительные последствия травмы в краткосрочной или долгосрочной перспективе. Лекарства от SCI не существует, и современные методы лечения в основном сосредоточены на реабилитации после травмы спинного мозга и управлении вторичными эффектами этого состояния. [1] Две основные области исследований включают нейропротекцию , способы предотвращения повреждения клеток, вызванного биологическими процессами, которые происходят в организме после травмы, и нейрорегенерацию , восстановление или замену поврежденных нейронных цепей.
Вторичное повреждение происходит через несколько минут или недель после первичного повреждения и включает в себя ряд каскадных процессов, которые еще больше повреждают ткани, уже поврежденные первичной травмой. [2] Это приводит к образованию глиального рубца, который препятствует росту аксонов. [2] Вторичные повреждения могут возникать из-за различных форм стресса, добавленного к спинному мозгу, в таких формах, как дополнительные ушибы, сдавливания, перегибы или растяжения спинного мозга. [3]
Осложнения вторичной SCI являются результатом гомеостатического дисбаланса, потенциально приводящего к метаболическим и гемостатическим изменениям из-за воспалительной реакции. Потенциальные немедленные эффекты вторичной SCI включают нейронное повреждение, нейровоспаление, разрушение гематоспинального барьера (BSCB), ишемическую дисфункцию, окислительный стресс и осложнения повседневной функции. [ необходима цитата ]
Животные, используемые в качестве модельных организмов SCI в исследованиях, включают мышей, крыс, кошек, собак, свиней и нечеловекообразных приматов; последние близки к людям, но вызывают этические опасения по поводу экспериментов на приматах . [1] Существуют специальные устройства для нанесения ударов определенной, контролируемой силы по спинному мозгу экспериментального животного. [1] Существуют различные классификации механических воздействий этих травм, которые можно воспроизвести в модели животного. К ним относятся ушиб, сжатие, коллагеназа и ишемическая реперфузия, дистракция, вывих и транссекция.
Ограничения этих модельных экспериментов являются общими. Например, ишемия-реперфузия SCI подразумевает прерывание кровотока в спинном мозге. Было отмечено, что осложнения возникают в моделях животных из-за необходимости пережимать аорту.
Эпидуральные охлаждающие седла, хирургически помещенные на остро травмированную ткань спинного мозга, использовались для оценки потенциально полезных эффектов локализованной гипотермии с сопутствующими глюкокортикоидами и без них . [4] [5]
В настоящее время хирургия используется для обеспечения стабильности поврежденного позвоночника или для снятия давления со спинного мозга. [1] [6] Вопрос о том, как скоро после травмы следует проводить декомпрессионную операцию, является спорным, и было трудно доказать, что более ранняя операция обеспечивает лучшие результаты в испытаниях на людях. [1] Некоторые утверждают, что ранняя операция может еще больше лишить уже поврежденный спинной мозг кислорода, но большинство исследований не показывают разницы в результатах между ранней (в течение трех дней) и поздней операцией (через пять дней), а некоторые показывают пользу более ранней операции. [7]
В 2014 году Дарек Фидыка перенес новаторскую операцию на позвоночнике, в ходе которой были использованы нервные трансплантаты из его лодыжки, чтобы «заполнить пробел» в его разорванном спинном мозге и обонятельные обкладочные клетки (OECs) для стимуляции клеток спинного мозга. Операция была проведена в Польше в сотрудничестве с профессором Джеффом Райсманом, заведующим кафедрой регенерации нейронов в Институте неврологии Лондонского университетского колледжа, и его исследовательской группой. OECs были взяты из обонятельных луковиц пациента в его мозге, а затем выращены в лаборатории, затем эти клетки были введены выше и ниже поврежденной спинномозговой ткани. [8]
Нейропротекция направлена на предотвращение вреда, который возникает из-за вторичной травмы. [2] Одним из примеров является воздействие на белок кальпаин , который, по-видимому, участвует в апоптозе ; ингибирование белка дало улучшенные результаты в испытаниях на животных. [2] Железо из крови повреждает спинной мозг через окислительный стресс , поэтому одним из вариантов является использование хелатирующего агента для связывания железа; животные, прошедшие лечение таким образом, показали улучшенные результаты. [2] Повреждение свободными радикалами , вызванное активными формами кислорода (ROS), является еще одной терапевтической целью, которая показала улучшение при воздействии на животных. [2] Один антибиотик, миноциклин , изучается в испытаниях на людях на предмет его способности уменьшать повреждение свободными радикалами, эксайтотоксичность , нарушение функции митохондрий и апоптоз. [2] Рилузол, противосудорожное средство, также изучается в клинических испытаниях на предмет его способности блокировать натриевые каналы в нейронах, что может предотвратить повреждение от эксайтотоксичности. [2] Другие потенциально нейропротекторные агенты, изучаемые в клинических испытаниях, включают цетрин, эритропоэтин и далфампридин . [2]
Один экспериментальный метод лечения, терапевтическая гипотермия , используется в лечении, но нет никаких доказательств того, что он улучшает результаты. [9] [10] Некоторые экспериментальные методы лечения, включая системную гипотермию, были выполнены в отдельных случаях, чтобы привлечь внимание к необходимости дальнейших доклинических и клинических исследований, которые помогут прояснить роль гипотермии при остром повреждении спинного мозга. [11] Несмотря на ограниченное финансирование, ряд экспериментальных методов лечения, таких как локальное охлаждение позвоночника и стимуляция осциллирующим полем, достигли контролируемых испытаний на людях. [12] [13]
Воспаление и глиальный рубец считаются важными тормозящими факторами нейрорегенерации после SCI. Однако, за исключением метилпреднизолона , ни одно из этих разработок не достигло даже ограниченного использования в клиническом лечении травм спинного мозга у людей в США. [14] Метилпреднизолон можно назначать вскоре после травмы, но доказательства вредных побочных эффектов перевешивают доказательства пользы. [6] Проводятся исследования более эффективных механизмов доставки метилпреднизолона, которые могли бы снизить его вредные эффекты. [1]
Нейрорегенерация направлена на повторное соединение разорванных цепей в спинном мозге, чтобы позволить функции вернуться. [2] Один из способов - это повторное выращивание аксонов, которое происходит спонтанно в периферической нервной системе . Однако миелин в центральной нервной системе содержит молекулы, которые препятствуют росту аксонов; таким образом, эти факторы являются целью для терапии, чтобы создать среду, благоприятную для роста. [2] Одной из таких молекул является Nogo-A , белок, связанный с миелином. Когда этот белок нацелен с помощью ингибирующих антител в моделях животных, аксоны растут лучше и функциональное восстановление улучшается. [2]
Стволовые клетки — это клетки, которые могут дифференцироваться , чтобы стать различными типами клеток. [15] Есть надежда, что стволовые клетки, трансплантированные в поврежденную область спинного мозга, позволят осуществить нейрорегенерацию . [6] Типы клеток, исследуемые для использования при SCI, включают эмбриональные стволовые клетки , нейральные стволовые клетки , мезенхимальные стволовые клетки , обонятельные обволакивающие клетки , клетки Шванна , активированные макрофаги и индуцированные плюрипотентные стволовые клетки . [1] Когда стволовые клетки вводятся в область повреждения спинного мозга, они секретируют нейротрофические факторы , и эти факторы помогают нейронам и кровеносным сосудам расти, тем самым помогая восстанавливать повреждения. [16] [17] [18] Также необходимо воссоздать среду, в которой будут расти стволовые клетки. [19]
Продолжающееся исследование фазы 2 в 2016 году представило данные [20], показывающие, что после 90 дней лечения клетками-предшественниками олигодендроцитов, полученными из эмбриональных стволовых клеток, у 4 из 4 пациентов с полными шейными травмами улучшились двигательные уровни, причем у 2 из 4 улучшились два двигательных уровня (по крайней мере, с одной стороны, а у одного пациента улучшились два двигательных уровня с обеих сторон). Первоначальной конечной точкой исследования было улучшение двух уровней с одной стороны у 2/5 пациентов в течение 6–12 месяцев. Все 8 шейных пациентов в этом исследовании фазы 1–2 продемонстрировали улучшение двигательных баллов верхних конечностей (UEMS) по сравнению с исходным уровнем без серьезных неблагоприятных побочных эффектов, а исследование фазы 1 2010 года у 5 пациентов грудного отдела не обнаружило никаких проблем с безопасностью после 5–6 лет наблюдения.
Ожидается, что данные об эффективности за шесть месяцев поступят в январе 2017 года; тем временем изучается возможность применения более высокой дозы, и в настоящее время в исследование также включаются пациенты с неполными травмами. [21]
В 2022 году группа исследователей сообщила о первых [22] сконструированных функциональных человеческих (моторных) нейронных сетях, полученных из индуцированных плюрипотентных стволовых клеток (iPSC) пациента для имплантации с целью регенерации поврежденного спинного мозга , что показало успех в испытаниях на мышах. [23] [24]
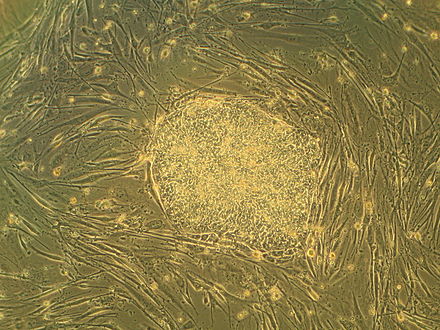
Эмбриональные стволовые клетки (ЭСК) плюрипотентны ; они могут развиваться в любой тип клеток в организме, например, в олигодендроциты . [6] Олигодендроциты и двигательные нейроны, как было предсказано, являются благоприятной мишенью для ЭСК в отношении лечения неврологических расстройств и травм. [25] После того, как происходит SCI, есть доказательства деградации олигодендроцитов, в конечном итоге приводящей к гибели клетки. Это приводит к отсутствию миелинизации , что усиливает сигналы, посылаемые между нейронами, вызывая дисфункцию в сигнализации. Потенциальным решением может быть трансплантация олигодендроцитов, полученных из ЭСК; однако успех этого процесса зависит от способности клетки дифференцироваться в направлении нервных типов клеток in vitro. Именно здесь проводятся дополнительные испытания и исследования с использованием животных моделей.
Нейральные стволовые клетки (НСК) являются мультипотентными ; они могут дифференцироваться в различные виды нервных клеток, как нейроны , так и глиальные клетки , а именно олигодендроциты и астроциты . [15] Есть надежда, что эти клетки при инъекции в поврежденный спинной мозг заменят убитые нейроны и олигодендроциты и будут секретировать факторы, поддерживающие рост. [1] Однако они могут не дифференцироваться в нейроны при трансплантации, оставаясь либо недифференцированными, либо превращаясь в глиальные клетки. [15] Клинические испытания фазы I/II по имплантации НСК людям с повреждением спинного мозга начались в 2011 году [1] и закончились в июне 2015 года. [26]
Мезенхимальные стволовые клетки не обязательно должны быть получены от плода, поэтому избегайте трудностей, связанных с этикой; они берутся из тканей, включая костный мозг, жировую ткань , пуповину . [1] В отличие от других типов стволовых клеток, мезенхимальные клетки не представляют угрозы образования опухолей или запуска реакции иммунной системы . [1] Исследования на животных с инъекцией стволовых клеток костного мозга показали улучшение двигательной функции; однако, это не так в испытании на людях через год после травмы. [1] В настоящее время проводятся дополнительные испытания. [1] Стволовые клетки жировой и пуповинной ткани нуждаются в дальнейшем изучении, прежде чем можно будет проводить испытания на людях, но были начаты два корейских исследования по изучению жировых клеток у пациентов с травмой спинного мозга. [1]
Было показано, что трансплантация тканей, таких как обонятельные клетки обонятельной выстилки из обонятельных луковиц, оказывает благотворное воздействие на крыс с травмой спинного мозга. [27] Испытания также начали демонстрировать успех, когда обонятельные клетки обонятельной выстилки трансплантировались людям с перерезанным спинным мозгом. [28] У людей после операций восстановилась чувствительность, использование ранее парализованных мышц, а также функции мочевого пузыря и кишечника, [29] например , Дарек Фидыка .
Японские исследователи в 2006 году обнаружили, что добавление определенных факторов транскрипции к клеткам делает их плюрипотентными и способными дифференцироваться в несколько типов клеток. [6] Таким образом, теоретически можно использовать собственные ткани пациента из-за снижения вероятности отторжения трансплантата . [6]
В недавних подходах использовались различные инженерные методы для улучшения восстановления травм спинного мозга. Использование биоматериалов — это инженерный подход к лечению SCI, который можно сочетать с трансплантацией стволовых клеток. [6] Они могут помочь доставить клетки в поврежденную область и создать среду, способствующую их росту. [6] Общая гипотеза, лежащая в основе инженерных биоматериалов, заключается в том, что перекрытие места поражения с помощью допускающего рост каркаса может помочь аксонам расти и тем самым улучшить функцию. Используемые биоматериалы должны быть достаточно прочными, чтобы обеспечить адекватную поддержку, но достаточно мягкими, чтобы не сдавливать спинной мозг. [2] Они должны со временем разрушаться, чтобы освободить место для восстановления ткани организмом. [2] Инженерные методы лечения не вызывают иммунный ответ, как биологические методы лечения, и их легко настраивать и воспроизводить. Было показано, что введение гидрогелей или самоорганизующихся нановолокон in vivo способствует прорастанию аксонов и частичному восстановлению функций. [30] [31] Кроме того, введение углеродных нанотрубок показало увеличение расширения двигательных аксонов и уменьшение объема поражения, не вызывая невропатической боли . [32] Кроме того, введение микроволокон полимолочной кислоты показало, что топографические сигналы наведения сами по себе могут способствовать регенерации аксонов в месте повреждения. [33] Однако все эти подходы вызвали скромное поведенческое или функциональное восстановление, что говорит о необходимости дальнейших исследований.
Гидрогели — это структуры, изготовленные из полимеров , которые разработаны так, чтобы быть похожими на естественный внеклеточный матрикс вокруг клеток. [2] Их можно использовать для более эффективной доставки лекарств в спинной мозг и для поддержки клеток, а также их можно вводить в поврежденную область для заполнения поражения. [2] Их можно имплантировать в место поражения с лекарствами или факторами роста в них, чтобы обеспечить химическим веществам наилучший доступ к поврежденной области и обеспечить их длительное высвобождение. [2]
В ноябре 2021 года было сообщено о новой терапии для спинномозговой травмы — инъекционный гель из нановолокон, которые имитируют матрицу вокруг клеток и содержат молекулы, которые были спроектированы для покачивания. Эти движущиеся молекулы соединяются с рецепторами клеток, вызывая сигналы восстановления внутри — в частности, приводя к относительно более высокому росту сосудов, регенерации аксонов, миелинизации, выживанию двигательных нейронов, уменьшению глиоза и функциональному восстановлению — позволяя парализованным мышам снова ходить. [34] [35] [36]
Технология создания экзоскелетов с приводом , носимых механизмов для помощи при ходьбе, в настоящее время делает значительные успехи. Существуют такие продукты, как Ekso, которые позволяют людям с полной травмой позвоночника до C7 (или любой степени неполной) стоять прямо и делать шаги с технологической помощью. [37] Первоначальная цель этой технологии — функциональная реабилитация, но по мере развития технологии будут развиваться и ее применение. [37]
Функциональная электростимуляция (ФЭС) использует скоординированные электрические разряды в мышцах, чтобы заставить их сокращаться в ритме ходьбы. [38] Хотя это может укрепить мышцы, существенным недостатком для пользователей ФЭС является то, что их мышцы устают через короткое время и расстояние. [38] Одно из направлений исследований объединяет ФЭС с экзоскелетами, чтобы минимизировать недостатки обеих технологий, поддерживая суставы человека и используя мышцы для уменьшения мощности, необходимой от машины, и, следовательно, ее веса. [38] Исследовательская группа в Школе инженерии Маккелви при Вашингтонском университете в Сент-Луисе , во главе с доцентом кафедры биомедицинской инженерии Исмаэлем Сеньесом, начинает клиническое испытание электрической стимуляции спинного мозга для восстановления движений у пациентов с двигательными нарушениями или парализованных пациентов. [39]
Недавние исследования показывают, что сочетание интерфейса мозг-компьютер и функциональной электростимуляции может восстановить произвольный контроль парализованных мышц. Исследование с обезьянами показало, что можно напрямую использовать команды из мозга, минуя спинной мозг, и включить ограниченный контроль и функцию рук. [40]
Исследование 2016 года, разработанное проектом Walk Again Project с восемью параплегиками, продемонстрировало неврологическое восстановление с использованием терапии на основе ИМТ, виртуальной реальности и использования роботов. Один пациент смог ходить с поддержкой после десятилетия парализации, а другой смог выносить беременность. [41] [42] [43] [44] [45]
Имплантаты спинного мозга, такие как имплантаты e-dura, предназначенные для имплантации на поверхность спинного мозга, изучаются на предмет паралича после травмы спинного мозга. [46]
Имплантаты E-dura разработаны с использованием методов мягкой нейротехнологии , в которых электроды и микрожидкостная система доставки распределены вдоль спинного имплантата. [47] Химическая стимуляция спинного мозга осуществляется через микрожидкостный канал e-dura. Имплантаты e-dura, в отличие от предыдущих поверхностных имплантатов, точно имитируют физические свойства живой ткани и могут одновременно доставлять электрические импульсы и фармакологические вещества. Искусственная твердая мозговая оболочка была создана с использованием PDMS и желатинового гидрогеля. [47] Гидрогель имитирует спинномозговую ткань, а силиконовая мембрана имитирует твердую мозговую оболочку. Эти свойства позволяют имплантатам e-dura выдерживать длительное применение в спинном и головном мозге, не приводя к воспалению, образованию рубцовой ткани и отторжению, обычно вызываемому трением поверхностных имплантатов о нервную ткань.
В 2018 году двум разным исследовательским группам из клиники Майо в Миннесоте и Университета Луисвилля в Кентукки удалось восстановить некоторую подвижность у пациентов, страдающих параплегией, с помощью электронного стимулятора спинного мозга. Теория, лежащая в основе нового стимулятора спинного мозга, заключается в том, что в некоторых случаях повреждения спинного мозга спинномозговые нервы между мозгом и ногами все еще живы, но просто находятся в состоянии покоя. [48] 1 ноября 2018 года третья отдельная исследовательская группа из Университета Лозанны опубликовала аналогичные результаты с аналогичной техникой стимуляции в журнале Nature . [49] [50] В 2022 году исследователи продемонстрировали стимулятор спинного мозга, который позволил пациентам с повреждением спинного мозга снова ходить с помощью эпидуральной электростимуляции (ЭЭС) со значительным прогрессом нейрореабилитации в течение первого дня. [51] [52] В исследовании, опубликованном в мае 2023 года в журнале Nature , исследователи из Швейцарии описали имплантаты, которые позволили 40-летнему мужчине, парализованному ниже бедер в течение 12 лет, стоять, ходить и подниматься по крутому пандусу только с помощью ходунков. Более чем через год после установки имплантата он сохранил эти способности и ходил с костылями, даже когда имплантат был выключен. [53]
Стимуляторы спинного мозга и интенсивная физиотерапия помогают параплегикам заново научиться ходить. Стимуляторы спинного мозга потенциально могут помочь "разбудить" спящие нервы.
Новая терапия, усиливающая нервные импульсы, также может помочь организму исцелиться