.pdf/page1-440px-How_viral_vector_COVID-19_Vaccines_Work_(English).pdf.jpg)
Вирусные векторы — это модифицированные вирусы, предназначенные для доставки генетического материала в клетки . Этот процесс может осуществляться внутри организма или в клеточной культуре . Вирусные векторы широко применяются в фундаментальных исследованиях, сельском хозяйстве и медицине.
Вирусы выработали специализированные молекулярные механизмы для транспортировки своих геномов в инфицированных хозяев, процесс, называемый трансдукцией . Эта способность была использована для использования в качестве вирусных векторов, которые могут интегрировать свой генетический груз — трансген — в геном хозяина, хотя неинтегративные векторы также широко используются. Помимо сельского хозяйства и лабораторных исследований, вирусные векторы широко применяются в генной терапии : по состоянию на 2022 год все одобренные генные терапии были основаны на вирусных векторах. Кроме того, по сравнению с традиционными вакцинами , внутриклеточная экспрессия антигена , обеспечиваемая вакцинами на основе вирусных векторов, обеспечивает более надежную иммунную активацию.
Многие типы вирусов были разработаны в вирусные векторные платформы, от ретровирусов до цитомегаловирусов . Различные классы вирусных векторов сильно различаются по своим сильным сторонам и ограничениям, подходящие некоторым для определенных приложений. Например, относительно неиммуногенные и интегративные векторы, такие как лентивирусные векторы , обычно используются для генной терапии. Химерные вирусные векторы, такие как гибридные векторы с качествами как бактериофагов , так и эукариотических вирусов, также были разработаны.
Вирусные векторы были впервые созданы в 1972 году Полом Бергом . Дальнейшее развитие было временно остановлено мораторием на исследования рекомбинантной ДНК после конференции в Асиломаре и строгими правилами Национальных институтов здравоохранения . После отмены моратория в 1980-х годах появились как первая рекомбинантная вирусная векторная генная терапия, так и первая вирусная векторная вакцина. Хотя в 1990-х годах были достигнуты значительные успехи в области вирусных векторов, клинические испытания имели ряд неудач, кульминацией которых стала смерть Джесси Гелсингера . Однако в 21 веке вирусные векторы пережили возрождение и были одобрены во всем мире для лечения различных заболеваний. Их вводили миллиардам пациентов, особенно во время пандемии COVID-19 .

Вирусы , инфекционные агенты, состоящие из белковой оболочки, которая заключает в себе геном , являются наиболее многочисленными биологическими объектами на Земле. [1] [2] Поскольку они не могут реплицироваться независимо, они должны заражать клетки и захватывать репликационный аппарат хозяина, чтобы производить копии себя . [2] Вирусы делают это, вставляя свой геном — который может быть ДНК или РНК , как одноцепочечным, так и двухцепочечным — в хозяина. [3] Некоторые вирусы могут интегрировать свой геном непосредственно в геном хозяина в форме провируса . [4]
Эта способность переносить чужеродный генетический материал была использована генными инженерами для создания вирусных векторов, которые могут трансдуцировать желаемый трансген в целевую клетку. [2] Вирусные векторы состоят из трех компонентов: [5] [6]

Вирусные векторы обычно используются в базовых исследовательских условиях и могут вводить гены, кодирующие, например, комплементарную ДНК , короткую шпилечную РНК или системы CRISPR/Cas9 для редактирования генов. [8] Вирусные векторы используются для клеточного перепрограммирования, например, для индукции плюрипотентных стволовых клеток или дифференциации взрослых соматических клеток в различные типы клеток. [9] Исследователи также используют вирусные векторы для создания трансгенных мышей и крыс для экспериментов. [10] Вирусные векторы могут использоваться для визуализации in vivo посредством введения репортерного гена . Кроме того, трансдукция стволовых клеток может позволить отслеживать клеточную линию во время развития . [9]

Генная терапия стремится модулировать или иным образом влиять на экспрессию генов посредством введения терапевтического трансгена. Генная терапия вирусными векторами может осуществляться путем доставки in vivo путем прямого введения вектора пациенту или ex vivo путем извлечения клеток у пациента, их трансдукции и последующего повторного введения измененных клеток пациенту. [11] Генная терапия вирусными векторами может также использоваться для растений, предварительно повышая урожайность или способствуя устойчивому производству. [12]
Существует четыре основных категории генной терапии: замена гена, подавление гена , добавление гена или редактирование гена. [11] [13] По сравнению с другими неинтегративными подходами генной терапии трансгены, введенные вирусными векторами, обеспечивают многолетнюю экспрессию. [14]
_(51611494786).jpg/440px-201021_Llegada_de_la_vacuna_conytra_COVID_-19_S-putnik_V_(12)_(51611494786).jpg)
Для использования в качестве вакцинных платформ вирусные векторы могут быть сконструированы так, чтобы нести определенный антиген , связанный с инфекционным заболеванием или опухолевым антигеном . [15] [16] Обычные вакцины не подходят для защиты от некоторых патогенов из-за уникальных стратегий уклонения от иммунного ответа и различий в патогенезе. [17] Например, вакцины на основе вирусных векторов могут в конечном итоге обеспечить иммунитет против ВИЧ-1 и малярии . [18]
В то время как традиционные субъединичные вакцины вызывают гуморальный ответ, [19] вирусные векторы допускают внутриклеточную экспрессию антигена, которая активирует пути MHC как через прямые, так и через перекрестные пути. Это вызывает сильный адаптивный иммунный ответ. [20] [21] Вакцины на основе вирусных векторов также обладают внутренними адъювантными свойствами через активацию врожденной иммунной системы и экспрессию молекулярных паттернов, ассоциированных с патогеном , что исключает необходимость в каком-либо дополнительном адъюванте. [22] [15] В дополнение к более сильному иммунному ответу по сравнению с другими типами вакцин, вирусные векторы предлагают эффективную трансдукцию генов и могут быть нацелены на определенные типы клеток. [19] Однако уже существующий иммунитет к вирусу, используемому в качестве вектора, может быть значительной проблемой. [18]
До 2020 года вакцины на основе вирусных векторов широко применялись, но ограничивались ветеринарной медициной. [22] В глобальном ответе на пандемию COVID-19 вакцины на основе вирусных векторов сыграли основополагающую роль и были введены миллиардам людей, особенно в странах с низким и средним уровнем дохода. [23]
Ретровирусы — оболочечные РНК-вирусы — являются популярными вирусными векторными платформами из-за их способности интегрировать генетический материал в геном хозяина. [2] Ретровирусные векторы включают два основных класса: гамма-ретровирусные и лентивирусные векторы. Фундаментальное различие между ними заключается в том, что гамма-ретровирусные векторы могут инфицировать только делящиеся клетки, тогда как лентивирусные векторы могут инфицировать как делящиеся, так и покоящиеся клетки. [24] Примечательно, что ретровирусные геномы состоят из одноцепочечной РНК и должны быть преобразованы в провирусную двухцепочечную ДНК, процесс, известный как обратная транскрипция , — прежде чем они будут интегрированы в геном хозяина с помощью вирусных белков, таких как интеграза . [25]
Наиболее часто используемый гаммаретровирусный вектор — это модифицированный вирус мышиного лейкоза Молони (MMLV), способный трансдуцировать различные типы клеток млекопитающих. Векторы MMLV были связаны с некоторыми случаями канцерогенеза. [26] Гаммаретровирусные векторы были успешно применены к гемопоэтическим стволовым клеткам ex vivo для лечения множества генетических заболеваний. [27]
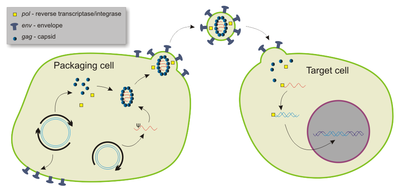
Большинство лентивирусных векторов получены из вируса иммунодефицита человека типа 1 (ВИЧ-1), хотя также использовались модифицированный вирус иммунодефицита обезьян (SIV), вирус иммунодефицита кошек (FIV) и вирус инфекционной анемии лошадей (EIAV). [24] Поскольку все функциональные гены удалены или иным образом мутированы, векторы не являются цитопатическими и могут быть сконструированы так, чтобы быть неинтегративными. [28]
Лентивирусные векторы способны переносить до 10 кб чужеродного генетического материала, хотя по состоянию на 2023 год оптимальным считалось 3-4 кб. [24] [28] По сравнению с другими вирусными векторами лентивирусные векторы обладают наибольшей способностью к трансдукции из-за образования трехцепочечной «ДНК-лоскута» во время ретротранскрипции одноцепочечной лентивирусной РНК в ДНК внутри хозяина. [28]
Хотя в основном они не являются воспалительными, [29] лентивирусные векторы могут вызывать надежные адаптивные иммунные ответы цитотоксических Т-клеток памяти и Т-хелперных клеток . [30] Это во многом обусловлено высокой тропностью лентивирусных векторов к дендритным клеткам , которые активируют Т-клетки. [30] Однако они могут инфицировать все типы антигенпрезентирующих клеток. [31] Более того, поскольку они являются единственными ретровирусными векторами, способными эффективно трансдуцировать как делящиеся, так и неделящиеся клетки, это делает их наиболее перспективными вакцинными платформами. [31] Они также были испытаны в качестве вакцин против рака. [32]
Лентивирусные векторы использовались в качестве терапии in vivo , например, для прямого лечения генетических заболеваний, таких как гемофилия B , и для лечения ex vivo , например, модификации иммунных клеток в терапии CAR T-клеток . [24] В 2017 году Управление по контролю за продуктами и лекарствами США (FDA) одобрило тисагенлеклейцел , лентивирусный вектор, для лечения острого лимфобластного лейкоза . [33]

Аденовирусы — это двухцепочечные ДНК-вирусы, принадлежащие к семейству Adenoviridae . [34] [35] Их относительно большие геномы, приблизительно 30-45 кб, делают их идеальными кандидатами для генетической доставки; [34] более новые аденовирусные векторы могут переносить до 37 кб чужеродного генетического материала. [36] Аденовирусные векторы демонстрируют высокую эффективность трансдукции и экспрессии трансгена и могут инфицировать как делящиеся, так и неделящиеся клетки. [37]
Капсид аденовируса, икосаэдр , имеет волокнистый «набалдашник» на каждой из своих 12 вершин. Эти волокнистые белки опосредуют проникновение в клетку, значительно влияя на эффективность и способствуя его широкому тропизму, в частности, через рецепторы Коксаки-аденовируса (CAR). [34] [37] Аденовирусные векторы могут вызывать надежные врожденные и адаптивные иммунные ответы. [38] Его сильная иммуногенность в частности обусловлена трансдукцией дендритных клеток (DC), повышающей регуляцию экспрессии молекул MHC I и II и активацией DC. [39] Они обладают сильным адъювантным эффектом, поскольку демонстрируют несколько молекулярных паттернов, ассоциированных с патогенами . [38] Одним из недостатков является то, что распространен уже существующий иммунитет к серотипам аденовируса, что снижает эффективность. [37] [40] Использование аденовирусов шимпанзе может обойти эту проблему. [41]
Хотя активация как врожденных, так и адаптивных иммунных реакций является препятствием для многих терапевтических применений, она делает аденовирусные векторы идеальной платформой для вакцин. [35] Глобальный ответ на пандемию COVID-19 привел к разработке и использованию множества аденовирусных векторных вакцин, включая Sputnik V , вакцину Oxford–AstraZeneca и вакцину Janssen . [42]

Аденоассоциированные вирусы (AAV) представляют собой относительно небольшие одноцепочечные ДНК-вирусы, принадлежащие к Parvoviridae, и, подобно лентивирусным векторам, AAV могут инфицировать как делящиеся, так и неделящиеся клетки. [43] Однако AAV требуют присутствия «вируса-помощника», такого как аденовирус или вирус простого герпеса, для репликации внутри хозяина, хотя он может делать это независимо, если вызван клеточный стресс или гены вируса-помощника переносятся вектором. [44]
AAV встраиваются в определенный участок генома хозяина, в частности, AAVS1 на хромосоме 19 у людей. Однако были разработаны рекомбинантные AAV, которые не интегрируются. Вместо этого они хранятся в виде эписом, которые в неделящихся клетках могут существовать годами. [45] Одним из недостатков является то, что они не способны переносить большие объемы чужеродного генетического материала. Кроме того, необходимость экспрессии комплементарной цепи для его одноцепочечного генома может задержать экспрессию трансгена. [45]
По состоянию на 2020 год было идентифицировано 11 различных серотипов AAV, различающихся структурой капсида и, следовательно, тропизмом. [43] Тропизм аденоассоциированных вирусных векторов можно адаптировать, создавая рекомбинантные версии из нескольких серотипов, что называется псевдотипированием. [43] Благодаря своей способности инфицировать и вызывать длительные эффекты в неделящихся клетках, AAV обычно используются в фундаментальных исследованиях в области нейронауки. [46] После одобрения AAV Alipogene tiparvovec в Европе в 2012 году [47] в 2017 году FDA одобрило первую генную терапию in vivo на основе AAV — voretigene neparvovec , которая лечила врожденный амавроз Лебера, связанный с RPE65 . [33] По состоянию на 2020 год 230 клинических испытаний с использованием методов лечения на основе AAV либо находились в стадии проведения, либо были завершены. [47]

Вирус коровьей оспы , поксвирус , является еще одним перспективным кандидатом для разработки вирусного вектора. [48] Его использование в качестве вакцины против оспы — впервые сообщенное Эдвардом Дженнером в 1798 году — привело к искоренению оспы и продемонстрировало, что коровья оспа безопасна и эффективна для людей. [49] [48] Более того, производственные процедуры, разработанные для массового производства запасов вакцины против оспы, могут ускорить производство векторов вируса коровьей оспы. [50]
Вакцина обладает большим геномом ДНК и, следовательно, может нести до 40 кб чужеродной ДНК. [49] [51] [52] [51] Кроме того, вакцина вряд ли интегрируется в геном хозяина, что снижает вероятность канцерогенеза. [51] Были разработаны ослабленные штаммы — реплицирующиеся и нереплицирующиеся. [49] Несмотря на то, что она широко охарактеризована из-за ее использования против оспы, по состоянию на 2019 год функция 50 процентов генома вакцины была неизвестна. Это может привести к непредсказуемым эффектам. [52]
В качестве вакцинной платформы векторы вакцинии демонстрируют высокоэффективную экспрессию трансгена и создают мощный иммунный ответ. [50] Вирус быстро действует: его жизненный цикл производит зрелое потомство вакцинии в течение 6 часов и имеет три механизма вирусного распространения. [52] вакциния также имеет адъювантный эффект , активируя сильный врожденный ответ через толл-подобные рецепторы . [50] Однако существенным недостатком, который может снизить его эффективность, является уже существующий иммунитет против вакцинии у тех, кто получил вакцину от оспы. [50]

Из девяти герпесвирусов , которые поражают людей, вирус простого герпеса 1 (HSV-1) является наиболее хорошо охарактеризованным и наиболее часто используемым в качестве вирусного вектора. [53] HSV-1 имеет несколько преимуществ: он имеет широкий тропизм и может доставлять терапевтические средства через специализированные системы экспрессии. [54] Более того, HSV-1 может пересекать гематоэнцефалический барьер, если его нарушить медицинским путем, что позволяет ему воздействовать на неврологические заболевания. Кроме того, HSV-1 не интегрируется в геном хозяина и может переносить большие количества чужеродной ДНК. Первая особенность предотвращает вредный мутагенез, который может происходить с ретровирусными и аденоассоциированными векторами. Были разработаны штаммы с дефицитом репликации. [55]
В 2015 году талимоген лахерпарепвек — вектор HSV-1, который запускает противоопухолевый иммунный ответ — был одобрен FDA для лечения меланомы . [56] По состоянию на 2020 год векторы HSV-1 экспериментально применялись против сарком и рака мозга, толстой кишки, простаты и кожи. [57]
Цитомегаловирус (ЦМВ), вирус герпеса, также был разработан для использования в качестве вирусного вектора. [58] ЦМВ может инфицировать большинство типов клеток и, таким образом, может распространяться по всему организму. Хотя вакцина на основе ЦМВ обеспечивала значительный иммунитет против ВИО — тесно связанного с ВИЧ — у макак, по состоянию на 2020 год развитие ЦМВ как надежного вектора все еще находилось на ранних стадиях. [59] [60]
Вирусы растений также являются сконструированными вирусными векторами для использования в сельском хозяйстве, садоводстве и биологическом производстве. [61] Эти векторы использовались для различных целей: от повышения эстетического качества декоративных растений до биологического контроля вредителей , быстрой экспрессии рекомбинантных белков и пептидов и ускорения селекции сельскохозяйственных культур. [62] Использование сконструированных вирусов растений было предложено для повышения урожайности сельскохозяйственных культур и содействия устойчивому производству. [12]
Обычно используются векторы на основе реплицирующихся вирусов. [63] РНК-вирусы, используемые для однодольных, включают вирус полосатой мозаики пшеницы и вирус полосатой мозаики ячменя , а для двудольных — вирус погремушки табака . Также использовались одноцепочечные ДНК-вирусы, такие как геминивирусы . [63] Вирусные векторы можно вводить растениям несколькими способами, называемыми «агроинокуляция», включая втирание, биобаллистическую систему доставки , агроспрей, агроинъекцию и даже через векторы насекомых . [64] [62] Однако наиболее распространенным подходом является доставка вирусных векторов, опосредованная Agrobacterium , при которой бактерии трансформируются плазмидной ДНК , кодирующей конструкцию вирусного вектора. [65]
Были разработаны химерные векторы, объединяющие как бактериофаги, так и эукариотические вирусы, способные инфицировать эукариотические клетки. [66] [67] В отличие от векторов на основе эукариотических вирусов, такие векторы на основе бактериофагов не имеют врожденного тропизма к эукариотическим клеткам, что позволяет создавать их с высокой специфичностью к раковым клеткам. [68]
Векторы бактериофагов также широко используются в молекулярной биологии. [69] Например, векторы бактериофагов используются в непрерывной эволюции с помощью фагов , способствуя быстрому мутагенезу бактерий. [70] Хотя бактериофаги ограничены микобактериофагами и некоторыми фагами грамотрицательных бактерий , их можно использовать для прямого клонирования. [71]
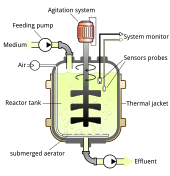
Методы производства вирусных векторов часто различаются в зависимости от вектора, хотя большинство из них используют адгезивную или суспензионную систему с клетками млекопитающих. [72] Для производства вирусных векторов в небольших лабораторных условиях обычно используются статические системы культивирования клеток, такие как чашки Петри. [73]
Эти методы, используемые в лаборатории, трудно масштабировать, требуя иных подходов в промышленных масштабах. [72] Производители обычно используют большие одноразовые системы культивирования и биореакторы . [72] Сосуды, такие как с газопроницаемыми поверхностями, используются для максимизации плотности клеточной культуры и единиц преобразования раствора. [72] В зависимости от сосуда вирусы могут быть напрямую изолированы из супернатанта или изолированы посредством химического лизиса культивируемых клеток или микрофлюидизации. [74] В 2017 году The New York Times сообщила о задержке производства инактивированных вирусов, что задержало некоторые испытания генной терапии на годы. [75]
В 1972 году биохимик Стэнфордского университета Пол Берг разработал первый вирусный вектор, включив ДНК из фага лямбда в полиомавирус SV40 для заражения клеток почек, поддерживаемых в культуре. [76] [77] [78] Последствия этого достижения обеспокоили таких ученых, как Роберт Поллак , который убедил Берга не трансдуцировать ДНК из SV40 в E. coli через вектор бактериофага. Они опасались, что введение предположительно вызывающих рак генов SV40 приведет к появлению канцерогенных штаммов бактерий. [79] [80] Эти и другие опасения в новой области рекомбинантной ДНК привели к проведению конференции в Асиломаре в 1975 году, на которой участники согласились на добровольный мораторий на клонирование ДНК . [81]
В 1977 году Национальные институты здравоохранения (NIH) выпустили официальные руководящие принципы, ограничивающие клонирование вирусной ДНК жесткими условиями BSL-4 , что фактически предотвратило такие исследования. Однако в 1979 году NIH ослабил эти правила, разрешив Бернарду Моссу разработать вирусный вектор, использующий вакцинию . [81] В 1982 году Мосс сообщил о первом использовании вирусного вектора для временной экспрессии генов. [18] В следующем году Мосс использовал вектор вакцинии для экспрессии антигена гепатита B , создав первую вирусную векторную вакцину. [22]
В каждой области медицины есть свой определяющий момент, часто с человеческим лицом. У полиомиелита был Джонас Солк . У экстракорпорального оплодотворения была Луиза Браун , первый в мире ребенок из пробирки. У трансплантационной хирургии был Барни Кларк , стоматолог из Сиэтла с искусственным сердцем. У СПИДа был Мэджик Джонсон . Теперь у генной терапии есть Джесси Гелсингер .
Хотя неудачная попытка генной терапии с использованием вируса папилломы Шоупа дикого типа была предпринята еще в 1972 году, Мартин Клайн предпринял первую попытку генной терапии с использованием рекомбинантной ДНК в 1980 году. Она оказалась безуспешной. [83] [11] В 1990-х годах, по мере дальнейшего изучения генетических заболеваний и совершенствования технологии вирусных векторов, существовал чрезмерный оптимизм относительно возможностей этой технологии. Многие клинические испытания оказались неудачными. [84] Были некоторые успехи, такие как первая эффективная генная терапия тяжелого комбинированного иммунодефицита (ТКИД); она использовала ретровирусный вектор. [11]
Однако во время клинического испытания 1999 года в Университете Пенсильвании Джесси Гелсингер умер от фатальной реакции на генную терапию на основе аденовирусного вектора. [82] [84] Это была первая смерть, связанная с любой формой генной терапии. [85] В результате FDA приостановило все испытания генной терапии в Университете Пенсильвании и расследовало 60 других по всей территории США. [85] Анонимная редакционная статья в Nature Medicine отметила, что это представляет собой «потерю невинности» для вирусных векторов. [84] Вскоре после этого репутация области была еще больше подорвана, когда у 5 детей, получавших генную терапию SCID, развилась лейкемия из-за проблемы с ретровирусным вектором. [84] [примечание 1]
Вирусные векторы пережили возрождение, когда их успешно использовали для доставки гемопоэтических генов ex vivo в клинических условиях. [86] В 2003 году Китай одобрил первую генную терапию для клинического использования: гендицин , аденовирусный вектор, кодирующий p53 . [87] [88] В 2012 году Европейский союз выдал свое первое одобрение генной терапии, аденоассоциированного вирусного вектора. [89] Во время пандемии COVID-19 вирусные векторные вакцины использовались в беспрецедентных масштабах: их вводили миллиардам людей. [90] [22] По состоянию на 2022 год все одобренные генные терапии были основаны на вирусных векторах, и в настоящее время проводится более 1000 клинических испытаний вирусных векторов, нацеленных на рак. [86]

В фильмах вирусные векторы часто изображаются как непреднамеренно вызывающие пандемию и цивилизационную катастрофу. [91] В фильме 2007 года «Я — легенда» вирусный вектор, нацеленный на рак, изображается как вызывающий зомби-апокалипсис . [92] [93] Аналогичным образом, вирусная векторная терапия болезни Альцгеймера в фильме «Восстание планеты обезьян» (2011) становится смертельным патогеном и вызывает восстание обезьян . Другие фильмы, в которых присутствуют вирусные векторы, включают «Эволюцию Борна» (2012) и «Обитель зла: Последняя глава» (2016). [94]