Болезнь Шагаса , также известная как американский трипаносомоз , является тропическим паразитарным заболеванием, вызываемым Trypanosoma cruzi . Распространяется в основном насекомыми подсемейства Triatominae , известными как «поцелуйные клопы». Симптомы меняются в течение инфекции. На ранней стадии симптомы обычно отсутствуют или слабо выражены и могут включать лихорадку, опухание лимфатических узлов , головные боли или отек в месте укуса . [ 1] Через четыре-восемь недель у нелеченных людей болезнь переходит в хроническую фазу , которая в большинстве случаев не приводит к появлению дальнейших симптомов. [2] [4] У 45% людей с хроническими инфекциями через 10–30 лет после первоначального заболевания развиваются заболевания сердца , которые могут привести к сердечной недостаточности . Осложнения пищеварения, включая увеличенный пищевод или увеличенную толстую кишку , также могут возникать у 21% людей, и до 10% людей могут испытывать повреждение нервов. [2]
T. cruzi обычно передается людям и другим млекопитающим через укусы клопов и инфицированные фекалии клопов. [5] Болезнь также может передаваться через переливание крови , трансплантацию органов , употребление пищи или питья, зараженных паразитами, и вертикальную передачу (от матери к ребенку). [1] Диагностика ранней стадии заболевания заключается в обнаружении паразита в крови с помощью микроскопа или обнаружении его ДНК с помощью полимеразной цепной реакции . [4] Хроническое заболевание диагностируется путем обнаружения антител к T. cruzi в крови. [6]
Профилактика направлена на устранение клопов-поцелуев и предотвращение их укусов. [1] Это может включать использование инсектицидов или противомоскитных сеток . [7] Другие профилактические меры включают скрининг крови, используемой для переливания. Ранние инфекции поддаются лечению с помощью лекарств бензнидазола или нифуртимокса , которые обычно излечивают болезнь, если их принимать вскоре после заражения человека, но они становятся менее эффективными, чем дольше человек страдает болезнью Шагаса. При использовании при хроническом заболевании лекарства могут отсрочить или предотвратить развитие симптомов конечной стадии. Бензнидазол и нифуртимокс часто вызывают побочные эффекты , включая кожные заболевания, раздражение пищеварительной системы и неврологические симптомы, что может привести к прекращению лечения. [2] [8] Новые препараты для лечения болезни Шагаса находятся в стадии разработки, [9] и хотя экспериментальные вакцины изучались на животных моделях, [10] [11] вакцина для человека не была разработана.
По оценкам, по состоянию на 2019 год болезнью Шагаса страдают 6,5 миллионов человек, в основном в Мексике , Центральной Америке и Южной Америке , [1] [3], что приводит к приблизительно 9490 ежегодным смертям. [3] Большинство людей с этой болезнью бедны , [12] и большинство не знают, что они инфицированы. [13] Масштабные миграции населения перенесли болезнь Шагаса в новые регионы, в том числе в США и многие европейские страны. [1] Болезнь поражает более 150 видов животных. [14]
Заболевание было впервые описано в 1909 году бразильским врачом Карлосом Шагасом , в честь которого оно и названо. [1] Болезнь Шагаса классифицируется как забытое тропическое заболевание . [15]

Болезнь Шагаса протекает в две стадии: острая стадия, которая развивается через одну-две недели после укуса насекомого, и хроническая стадия, которая развивается в течение многих лет. [2] [4] [16] Острая стадия часто протекает бессимптомно. [2] Если симптомы присутствуют, они, как правило, незначительны и не характерны для какого-либо конкретного заболевания. [4] Признаки и симптомы включают лихорадку, недомогание , головную боль и увеличение печени , селезенки и лимфатических узлов . [1] [2] [4] Иногда у людей появляется опухший узел в месте заражения, который называется « признак Романьи », если он находится на веке, или «шагома», если он находится в другом месте на коже. [4] [17] В редких случаях (менее 1–5%) у инфицированных людей развивается тяжелое острое заболевание, которое может включать воспаление сердечной мышцы , накопление жидкости вокруг сердца и воспаление мозга и окружающих тканей , и может быть опасным для жизни. Острая фаза обычно длится от четырех до восьми недель и проходит без лечения. [2]
Если не лечиться противопаразитарными препаратами , люди остаются инфицированными T. cruzi после выздоровления от острой фазы. Большинство хронических инфекций протекают бессимптомно, что называется неопределенной хронической болезнью Шагаса. Однако в течение десятилетий с болезнью примерно у 30–40% людей развивается дисфункция органов ( определенная хроническая болезнь Шагаса), которая чаще всего поражает сердце или пищеварительную систему . [2] [4]
Наиболее распространенным долгосрочным проявлением является болезнь сердца , которая встречается у 14–45% людей с хронической болезнью Шагаса. [2] Люди с болезнью сердца Шагаса часто испытывают учащенное сердцебиение , а иногда и обмороки из-за нерегулярной работы сердца. По данным электрокардиограммы , люди с болезнью сердца Шагаса чаще всего имеют аритмии . По мере прогрессирования заболевания желудочки сердца увеличиваются ( дилатационная кардиомиопатия ), что снижает его способность перекачивать кровь. Во многих случаях первым признаком болезни сердца Шагаса является сердечная недостаточность , тромбоэмболия или боль в груди, связанная с аномалиями в микроциркуляторном русле . [18]
Также при хронической болезни Шагаса часто встречается поражение пищеварительной системы, которое затрагивает 10–21% людей. [2] Наиболее распространенными проблемами с пищеварением являются расширение пищевода или толстой кишки . [16] Люди с увеличенным пищеводом часто испытывают боль ( одинофагию ) или затрудненное глотание ( дисфагию ), кислотный рефлюкс , кашель и потерю веса. Люди с увеличенной толстой кишкой часто испытывают запоры и могут развить серьезную закупорку кишечника или его кровоснабжения . До 10% хронически инфицированных людей развивают повреждение нервов , которое может привести к онемению и изменению рефлексов или движений. [2] Хотя хроническое заболевание обычно развивается в течение десятилетий, у некоторых людей с болезнью Шагаса (менее 10%) сразу после острого заболевания развивается поражение сердца. [18]
Признаки и симптомы различаются у людей, инфицированных T. cruzi менее распространенными путями. Люди, инфицированные при употреблении паразитов, как правило, в течение трех недель после употребления в пищу развивают тяжелую форму заболевания, симптомы включают лихорадку, рвоту , одышку , кашель и боль в груди, животе и мышцах . [2] У тех, кто инфицирован врожденно, обычно мало симптомов или они отсутствуют, но могут быть легкие неспецифические симптомы или серьезные симптомы, такие как желтуха , респираторный дистресс и проблемы с сердцем. [2] У людей, инфицированных при трансплантации органов или переливании крови, как правило, наблюдаются симптомы, похожие на симптомы трансмиссивных заболеваний, но симптомы могут не проявляться в течение от недели до пяти месяцев. [2] У хронически инфицированных людей, у которых иммунитет подавлен из-за ВИЧ- инфекции, может быть особенно тяжелое и отчетливое заболевание, которое чаще всего характеризуется воспалением мозга и окружающих тканей или абсцессами мозга . [4] Симптомы сильно различаются в зависимости от размера и расположения абсцессов мозга, но обычно включают лихорадку, головные боли, судороги, потерю чувствительности или другие неврологические проблемы , которые указывают на определенные места повреждения нервной системы. [19] Иногда у этих людей также наблюдается острое воспаление сердца, поражения кожи и заболевания желудка, кишечника или брюшины . [4]
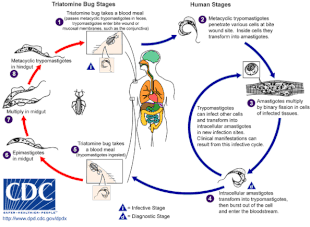
Болезнь Шагаса вызывается заражением простейшим паразитом T. cruzi , который обычно попадает в организм человека через укус триатомовых клопов, также называемых «целующимися клопами». [4] Когда насекомое испражняется в месте укуса, подвижные формы T. cruzi , называемые трипомастиготами, попадают в кровоток и проникают в различные клетки хозяина. [5] Внутри клетки хозяина паразит трансформируется в репликативную форму, называемую амастиготой, которая проходит несколько раундов репликации. [5] Реплицированные амастиготы снова трансформируются в трипомастигот, которые разрывают клетку хозяина и высвобождаются в кровоток. [2] Затем трипомастиготы распространяются по всему организму в различные ткани, где они проникают в клетки и размножаются. [2] В течение многих лет циклы репликации паразита и иммунный ответ могут серьезно повредить эти ткани, особенно сердце и пищеварительный тракт. [2]

T. cruzi может передаваться различными триатомовыми клопами родов Triatoma , Panstrongylus и Rhodnius . [2] Основными переносчиками заражения человека являются виды триатомовых клопов, обитающие в человеческих жилищах, а именно Triatoma infestans , Rhodnius prolixus , Triatoma dimidiata и Panstrongylus megistus . [20] Эти насекомые известны под рядом местных названий, включая vinchuca в Аргентине, Боливии, Чили и Парагвае, barbeiro ( цирюльник ) в Бразилии, pito в Колумбии, chinche в Центральной Америке и chipo в Венесуэле. [21] Клопы, как правило, питаются ночью , предпочитая влажные поверхности около глаз или рта. [16] [20] Триатомовый клоп может заразиться T. cruzi , когда он питается на инфицированном хозяине. [16] T. cruzi размножается в кишечном тракте насекомого и выделяется с фекалиями клопа. [16] Когда зараженный триатомин питается, он прокалывает кожу и поглощает кровь , одновременно испражняясь, чтобы освободить место для новой пищи. [16] Укус обычно безболезнен, но вызывает зуд. [16] Расчесывание места укуса приводит к попаданию фекалий, содержащих T. cruzi , в рану от укуса, что вызывает инфекцию. [16]
Помимо классического переноса, болезнь Шагаса может передаваться через употребление пищи или питья, загрязненных насекомыми-триатоминами или их фекалиями. [22] Поскольку нагревание или высушивание убивают паразитов, напитки и особенно фруктовые соки являются наиболее частым источником заражения. [22] Этот оральный путь передачи был задействован в нескольких вспышках, где он привел к необычно тяжелым симптомам, вероятно, из-за заражения более высокой паразитарной нагрузкой, чем от укуса триатоминового клопа — [6] [22] один измельченный триатомин в пище или напитке, содержащих T cruzi , может содержать около 600 000 метациклических трипомастигот, в то время как фекалии триатомина содержат 3000-4000 на мкл. [23]
T. cruzi может передаваться независимо от триатомового клопа во время переливания крови, после трансплантации органов или через плаценту во время беременности. [2] Переливание крови инфицированного донора заражает реципиента в 10–25% случаев. [2] Чтобы предотвратить это, во многих странах с эндемичной болезнью Шагаса, а также в Соединенных Штатах, донорская кровь проверяется на наличие T. cruzi . [6] Аналогичным образом, трансплантация твердых органов от инфицированного донора может передавать T. cruzi реципиенту. [2] Это особенно актуально для трансплантации сердца , при которой T. cruzi передается в 75–100% случаев, и в меньшей степени для трансплантации печени ( 0–29%) или почки (0–19%). [2] Инфицированная мать может передать T. cruzi своему ребенку через плаценту; это происходит в 15% случаев родов у инфицированных матерей. [24] По состоянию на 2019 год 22,5% новых случаев заражения произошло в результате внутриутробной передачи. [25]

В острой фазе заболевания признаки и симптомы напрямую вызваны репликацией T. cruzi и реакцией иммунной системы на нее. [2] Во время этой фазы T. cruzi можно обнаружить в различных тканях по всему телу, а также циркулировать в крови. [2] В течение первых недель инфекции репликация паразита контролируется выработкой антител и активацией воспалительной реакции хозяина , в частности клеток, которые нацелены на внутриклеточные патогены, такие как NK-клетки и макрофаги , управляемые сигнальными молекулами воспаления, такими как TNF-α и IFN-γ . [2]
При хронической болезни Шагаса долгосрочное повреждение органов развивается в течение многих лет из-за постоянной репликации паразита и повреждения иммунной системы. На ранних стадиях заболевания T. cruzi часто обнаруживается в поперечно-полосатых мышечных волокнах сердца. [26] По мере прогрессирования заболевания сердце обычно увеличивается, при этом значительные области сердечных мышечных волокон заменяются рубцовой тканью и жиром . [26] Зоны активного воспаления разбросаны по всему сердцу, и в каждой из них находятся воспалительные иммунные клетки, как правило, макрофаги и Т-клетки . [26] На поздних стадиях заболевания паразиты редко обнаруживаются в сердце и могут присутствовать только в очень низких количествах. [26]
В сердце, толстой кишке и пищеводе хроническое заболевание приводит к массивной потере нервных окончаний . [18] В сердце это может способствовать аритмиям и другим нарушениям сердечной деятельности. [18] В толстой кишке и пищеводе потеря контроля нервной системы является основным фактором дисфункции органов. [18] Потеря нервов ухудшает движение пищи по пищеварительному тракту, что может привести к закупорке пищевода или толстой кишки и ограничению их кровоснабжения. [18]

Присутствие T. cruzi в крови является диагностическим признаком болезни Шагаса. Во время острой фазы инфекции его можно обнаружить с помощью микроскопического исследования свежей антикоагулированной крови или ее лейкоцитарной пленки для подвижных паразитов; или путем приготовления тонких и толстых мазков крови, окрашенных по Гимзе , для прямой визуализации паразитов. [4] [6] Исследование мазков крови обнаруживает паразитов в 34–85% случаев. Чувствительность увеличивается, если для концентрирования крови используются такие методы, как микрогематокритное центрифугирование . [2] При микроскопическом исследовании окрашенных мазков крови трипомастиготы T. cruzi выглядят как S- или U-образные организмы со жгутиком , соединенным с телом волнистой мембраной. Внутри тела паразита видны ядро и более мелкая структура, называемая кинетопластом ; кинетопласт T. cruzi относительно большой, что помогает отличить его от других видов трипаносом, которые заражают людей. [27]
Альтернативно, ДНК T. cruzi может быть обнаружена с помощью полимеразной цепной реакции (ПЦР). При острой и врожденной болезни Шагаса ПЦР более чувствительна, чем микроскопия, [25] и более надежна, чем тесты на антитела для диагностики врожденного заболевания, поскольку на нее не влияет передача антител против T. cruzi от матери к ее ребенку ( пассивный иммунитет ). [28] ПЦР также используется для мониторинга уровней T. cruzi у реципиентов трансплантированных органов и людей с ослабленным иммунитетом, что позволяет обнаружить инфекцию или реактивацию на ранней стадии. [2] [4] [25]
При хронической болезни Шагаса концентрация паразитов в крови слишком низкая для надежного обнаружения с помощью микроскопии или ПЦР, [2] поэтому диагноз обычно ставится с помощью серологических тестов, которые обнаруживают антитела иммуноглобулина G против T. cruzi в крови. [6] Для подтверждения диагноза требуются два положительных результата серологии, полученные с использованием разных методов тестирования. [4] Если результаты теста не являются окончательными, можно использовать дополнительные методы тестирования, такие как вестерн-блоттинг . [2]
Существуют различные быстрые диагностические тесты на болезнь Шагаса. Эти тесты легко транспортировать, и их могут выполнять люди без специальной подготовки. [29] Они полезны для скрининга большого количества людей и тестирования людей, которые не могут получить доступ к медицинским учреждениям, но их чувствительность относительно низкая, [2] и рекомендуется использовать второй метод для подтверждения положительного результата. [29] [30]
Паразиты T. cruzi могут быть выращены из образцов крови с помощью гемокультуры , ксенодиагностики или путем инокуляции животных кровью человека. В методе гемокультуры эритроциты человека отделяются от плазмы и добавляются в специализированную питательную среду для стимулирования размножения паразита. Для получения результата может потребоваться до шести месяцев. Ксенодиагностика включает в себя кормление кровью триатомовых насекомых, а затем исследование их фекалий на наличие паразита через 30–60 дней. [29] Эти методы не используются обычно, так как они медленные и имеют низкую чувствительность. [31] [29]

Усилия по предотвращению болезни Шагаса в основном были сосредоточены на контроле переносчиков для ограничения воздействия триатомовых клопов. Программы распыления инсектицидов были основой контроля переносчиков, состоящей из распыления домов и прилегающих территорий остаточными инсектицидами. [32] Первоначально это делалось с помощью органохлорированных , органофосфатных и карбаматных инсектицидов, которые в 1980-х годах были заменены пиретроидами . [32] Эти программы резко сократили передачу в Бразилии и Чили , [16] и устранили основных переносчиков из определенных регионов: Triatoma infestans из Бразилии, Чили, Уругвая и частей Перу и Парагвая , а также Rhodnius prolixus из Центральной Америки . [18] Контроль переносчиков в некоторых регионах был затруднен из-за развития устойчивости к инсектицидам у триатомовых клопов. [32] В ответ на это программы по борьбе с переносчиками болезней внедрили альтернативные инсектициды (например, фенитротион и бендиокарб в Аргентине и Боливии ), обработку домашних животных (которыми также питаются триатомовые клопы) пестицидами, пропитанные пестицидами краски и другие экспериментальные подходы. [32] В районах, где обитают триатомовые клопы, передачу T. cruzi можно предотвратить, если спать под противомоскитными сетками и улучшать жилищные условия, чтобы не допустить заселения домов триатомовыми клопами. [16]
Переливание крови ранее было вторым по распространенности способом передачи болезни Шагаса. [33] T. cruzi может выживать в охлажденной хранящейся крови, а также может выдерживать замораживание и оттаивание, что позволяет ему сохраняться в цельной крови, эритроцитарной массе , гранулоцитах , криопреципитате и тромбоцитах . [33] Разработка и внедрение скрининговых тестов в банках крови значительно снизили риск заражения во время переливания крови. [33] Почти все доноры крови в странах Латинской Америки проходят скрининг Шагаса. [33] Широко распространенный скрининг также распространен в неэндемичных странах со значительными популяциями иммигрантов из эндемичных районов, включая Соединенное Королевство (внедрено в 1999 году), Испанию (2005 год), Соединенные Штаты (2007 год), Францию и Швецию (2009 год), Швейцарию (2012 год) и Бельгию (2013 год). [34] Серологические тесты, обычно ИФА , используются для обнаружения антител к белкам T. cruzi в крови донора. [33]
Другие пути передачи были направлены на программы профилактики болезни Шагаса. Лечение матерей, инфицированных T. cruzi, во время беременности снижает риск врожденной передачи инфекции. [24] С этой целью многие страны Латинской Америки внедрили плановый скрининг беременных женщин и младенцев на наличие инфекции T. cruzi , а Всемирная организация здравоохранения рекомендует проводить скрининг всех детей, рожденных инфицированными матерями, чтобы предотвратить развитие врожденной инфекции в хроническое заболевание. [1] [35] Подобно переливанию крови, многие страны с эндемичной болезнью Шагаса проверяют органы для трансплантации с помощью серологических тестов. [2]
Вакцины против болезни Шагаса не существует. [8] Несколько экспериментальных вакцин были испытаны на животных, инфицированных T. cruzi , и смогли снизить количество паразитов в крови и сердце, [36] но по состоянию на 2016 год ни одна из вакцин-кандидатов не прошла клинические испытания на людях. [37]
.jpg/440px-NECT_treatment_(cropped).jpg)
Болезнь Шагаса лечится с помощью противопаразитарных препаратов для устранения T. cruzi из организма и симптоматического лечения для устранения последствий инфекции. [6] По состоянию на 2018 год бензнидазол и нифуртимокс были противопаразитарными препаратами выбора для лечения болезни Шагаса, [2] хотя бензнидазол является единственным препаратом, доступным в большинстве стран Латинской Америки. [38] Для любого препарата лечение обычно состоит из двух-трех пероральных доз в день в течение 60-90 дней. [2] Противопаразитарное лечение наиболее эффективно на ранней стадии инфекции: оно устраняет T. cruzi от 50 до 80% людей в острой фазе (ВОЗ: «почти 100 %» [39] ), но только 20–60% людей в хронической фазе. [6] Лечение хронического заболевания более эффективно у детей, чем у взрослых, а показатель излечения врожденного заболевания приближается к 100%, если лечение проводится в первый год жизни. [2] Противопаразитарное лечение также может замедлить прогрессирование заболевания и снизить вероятность врожденной передачи. [1] Устранение T. cruzi не излечивает сердечные и желудочно-кишечные повреждения, вызванные хронической болезнью Шагаса, поэтому эти состояния следует лечить отдельно. [6] Противопаразитарное лечение не рекомендуется людям, у которых уже развилась дилатационная кардиомиопатия. [18]
Бензнидазол обычно считается препаратом первой линии , поскольку он имеет более мягкие побочные эффекты , чем нифуртимокс, и его эффективность лучше изучена. [2] [25] Как бензнидазол, так и нифуртимокс имеют общие побочные эффекты , которые могут привести к прекращению лечения. Наиболее распространенными побочными эффектами бензнидазола являются кожная сыпь, проблемы с пищеварением, снижение аппетита , слабость, головная боль и проблемы со сном . Эти побочные эффекты иногда можно лечить антигистаминными препаратами или кортикостероидами , и, как правило, они исчезают при прекращении лечения. [2] Однако прием бензнидазола прекращается в 29% случаев. [2] Нифуртимокс имеет более частые побочные эффекты, затрагивающие до 97,5% лиц, принимающих препарат. [2] Наиболее распространенными побочными эффектами являются потеря аппетита, потеря веса, тошнота и рвота, а также различные неврологические расстройства, включая изменения настроения, бессонницу , парестезию и периферическую невропатию . [2] Лечение прекращается в 75% случаев. [2] [25] Оба препарата противопоказаны к применению у беременных женщин и людей с печеночной или почечной недостаточностью . [1] По состоянию на 2019 год сообщалось о резистентности к этим препаратам. [38]
На хронической стадии лечение заключается в контроле клинических проявлений заболевания. Лечение кардиомиопатии Шагаса похоже на лечение других форм заболеваний сердца. [2] Могут быть назначены бета-блокаторы и ингибиторы АПФ , но некоторые люди с болезнью Шагаса могут быть не в состоянии принимать стандартную дозу этих препаратов из-за низкого артериального давления или низкой частоты сердечных сокращений . [2] [18] Для лечения нерегулярного сердцебиения людям могут быть назначены антиаритмические препараты, такие как амиодарон , или имплантирован кардиостимулятор . [4] Для профилактики тромбоэмболии и инсульта могут использоваться препараты для разжижения крови . [18] Хроническое заболевание сердца, вызванное нелеченой инфекцией T. cruzi , является частой причиной операции по трансплантации сердца . [16] Поскольку реципиенты трансплантата принимают иммунодепрессанты для предотвращения отторжения органа , их контролируют с помощью ПЦР для выявления реактивации заболевания. Люди с болезнью Шагаса, перенесшие трансплантацию сердца, имеют более высокие показатели выживаемости, чем среднестатистический реципиент трансплантата сердца. [18]
Легкие желудочно-кишечные заболевания можно лечить симптоматически, например, используя слабительные средства при запорах или принимая прокинетические препараты, такие как метоклопрамид, перед едой для облегчения симптомов со стороны пищевода. [4] [40] Хирургическое вмешательство по рассечению мышц нижнего пищеводного сфинктера ( кардиомиотомия ) может быть выполнено в более тяжелых случаях заболеваний пищевода, [40] а хирургическое удаление пораженной части органа может потребоваться при запущенном мегаколоне и мегаэзофагусе. [4] [31]


По оценкам, в 2019 году болезнью Шагаса страдали 6,5 миллионов человек во всем мире, ежегодно регистрировалось около 173 000 новых случаев заражения и 9 490 смертей. [3] В 2013 году болезнь привела к глобальному экономическому бремени, оцениваемому в 7,2 миллиарда долларов США, 86% из которых приходится на эндемичные страны. [34] [43] Болезнь Шагаса приводит к потере более 800 000 лет жизни с поправкой на инвалидность каждый год. [2]
Эндемичный район болезни Шагаса простирается от юга США до севера Чили и Аргентины, при этом самая высокая распространенность заболевания наблюдается в Боливии (6,1%), Аргентине (3,6%) и Парагвае (2,1%). [2] В континентальной Латинской Америке болезнь Шагаса эндемична для 21 страны: Аргентины, Белиза, Боливии, Бразилии, Чили, Колумбии, Коста-Рики, Эквадора, Сальвадора, Французской Гвианы, Гватемалы, Гайаны, Гондураса, Мексики, Никарагуа, Панамы, Парагвая, Перу, Суринама, Уругвая и Венесуэлы. [1] [2] В эндемичных районах, в основном благодаря усилиям по контролю за переносчиками и скринингу донорской крови, ежегодные случаи заражения и смерти снизились на 67% и более чем на 73% соответственно по сравнению с пиковыми значениями в 1980-х годах по 2010 год. [2] [44] Передача через насекомых-переносчиков и переливание крови была полностью прекращена в Уругвае (1997), Чили (1999) и Бразилии (2006), [44] а в Аргентине векторная передача была прекращена в 13 из 19 эндемичных провинций по состоянию на 2001 год. [45] Во время гуманитарного кризиса в Венесуэле векторная передача начала происходить в районах, где она ранее была прекращена, и показатели серопревалентности болезни Шагаса возросли. [46] Показатели передачи также возросли в регионе Гран-Чако из-за устойчивости к инсектицидам и в бассейне Амазонки из-за оральной передачи. [2]
В то время как уровень заболеваемости болезнью Шагаса, передающейся через переносчиков, снизился в большинстве стран Латинской Америки, уровень заболеваемости оральным путем возрос, возможно, из-за растущей урбанизации и вырубки лесов , что привело к более тесному контакту людей с триатоминами и изменению распространения видов триатоминов. [22] [47] [48] Болезнь Шагаса, передающаяся через рот, вызывает особую обеспокоенность в Венесуэле, где в период с 2007 по 2018 год было зарегистрировано 16 вспышек. [46]
Шагас существует в двух различных экологических зонах. В регионе Южного конуса основной переносчик обитает в человеческих домах и вокруг них. В Центральной Америке и Мексике основной вид переносчика обитает как внутри жилых помещений, так и в необитаемых районах. В обеих зонах Шагас встречается почти исключительно в сельской местности, где T. cruzi также циркулирует среди диких и домашних животных. [49] T. cruzi обычно заражает более 100 видов млекопитающих по всей Латинской Америке, включая опоссумов ( Didelphis spp.), [50] броненосцев , мартышек , летучих мышей , различных грызунов [51] и собак [50], все из которых могут быть инфицированы переносчиками или перорально, поедая триатомовых клопов и других инфицированных животных. [51] [50] Для животных -энтомофагов это обычный способ. [50] Didelphis spp. уникальны тем, что им не нужен триатомин для передачи, они завершают жизненный цикл через собственную мочу и фекалии. [50] Ветеринарная передача также происходит путем вертикальной передачи через плаценту, переливание крови и трансплантацию органов . [50]
Хотя болезнь Шагаса традиционно считается болезнью сельской местности Латинской Америки, международная миграция рассеяла больных этим заболеванием по многочисленным неэндемичным странам, в первую очередь в Северной Америке и Европе. [1] [34] По состоянию на 2020 год в Соединенных Штатах проживает около 300 000 инфицированных людей, [52] а в 2018 году было подсчитано, что от 30 000 до 40 000 человек в Соединенных Штатах страдали кардиомиопатией Шагаса. [18] Подавляющее большинство случаев в Соединенных Штатах происходит у иммигрантов из Латинской Америки , [18] [25] но возможна и местная передача. Одиннадцать видов триатомовых являются местными для Соединенных Штатов, и в некоторых южных штатах наблюдаются постоянные циклы передачи заболевания между насекомыми-переносчиками и животными-резервуарами, [2] [25] к которым относятся лесные крысы, опоссумы, еноты , броненосцы и скунсы . [53] Однако локально приобретенная инфекция встречается очень редко: с 1955 по 2015 год было зарегистрировано всего 28 случаев. [2] [52] По состоянию на 2013 год стоимость лечения в Соединенных Штатах оценивалась в 900 миллионов долларов США в год (глобальная стоимость — 7 миллиардов долларов США), включая госпитализацию и медицинские устройства, такие как кардиостимуляторы. [43]
По состоянию на 2019 год болезнь Шагаса затронула приблизительно 68 000–123 000 человек в Европе. [54] Испания, где наблюдается высокий уровень иммиграции из Латинской Америки, имеет самую высокую распространенность этого заболевания. По оценкам, от 50 000 до 70 000 человек в Испании живут с болезнью Шагаса, что составляет большинство случаев в Европе. [55] Распространенность сильно различается в европейских странах из-за различных схем иммиграции. [54] Италия занимает второе место по распространенности, за ней следуют Нидерланды, Великобритания и Германия. [55]

T. cruzi , вероятно, циркулировал среди южноамериканских млекопитающих задолго до прибытия людей на континент. [56] T. cruzi был обнаружен в древних человеческих останках по всей Южной Америке, от 9000-летней мумии Чинчорро в пустыне Атакама до останков разного возраста в Минас-Жерайс и 1100-летней мумии на севере, в пустыне Чиуауа недалеко от Рио-Гранде . [56] Во многих ранних письменных источниках описываются симптомы, соответствующие болезни Шагаса, причем ранние описания заболевания иногда приписываются Мигелю Диасу Пименте (1707), Луису Гомешу Феррейре (1735) и Теодоро Дж. Х. Ланггарду (1842). [56]
Официальное описание болезни Шагаса было сделано Карлосом Шагасом в 1909 году после обследования двухлетней девочки с лихорадкой, опухшими лимфатическими узлами и увеличенной селезенкой и печенью. [56] При исследовании ее крови Шагас увидел трипаносомы, идентичные тем, которые он недавно идентифицировал из задней части кишечника триатомовых клопов и назвал Trypanosoma cruzi в честь своего наставника, бразильского врача Освальдо Круза . [56] Он отправил зараженных триатомовых клопов Крузу в Рио-де-Жанейро , который показал, что укус зараженного триатомина может также передавать T. cruzi обезьянам - мармозеткам . [56] Всего за два года, 1908 и 1909, Шагас опубликовал описания болезни, организма, который ее вызвал, и насекомого-переносчика, необходимого для заражения. [57] [58] [59] Почти сразу после этого, по предложению Мигеля Коуту , тогдашнего профессора Медицинского факультета Рио-де-Жанейро , болезнь стали широко называть «болезнью Шагаса». [57] Открытие Шагаса принесло ему национальную и международную известность, но, подчеркивая неадекватность реакции бразильского правительства на болезнь, Шагас навлек на себя критику и на болезнь, которая носила его имя, подавляя исследования его открытия и, вероятно, сорвав его номинацию на Нобелевскую премию в 1921 году. [57] [60]
В 1930-х годах Сальвадор Мацца возродил исследования болезни Шагаса, описав более тысячи случаев в аргентинской провинции Чако . [56] В Аргентине болезнь известна как mal de Chagas-Mazza в его честь. [61] Серологические тесты на болезнь Шагаса были введены в 1940-х годах, показав, что инфекция T. cruzi широко распространена по всей Латинской Америке. [56] Это, в сочетании с успехами в ликвидации переносчика малярии с помощью использования инсектицидов, стимулировало создание кампаний общественного здравоохранения, направленных на обработку домов инсектицидами для уничтожения триатомовых клопов. [32] [56] В 1950-х годах было обнаружено, что обработка крови кристаллическим фиолетовым может уничтожить паразита, что привело к его широкому использованию в программах скрининга переливания крови в Латинской Америке. [56] Крупномасштабные программы контроля начали формироваться в 1960-х годах, сначала в Сан-Паулу , затем в различных местах в Аргентине, а затем и на национальном уровне по всей Латинской Америке. [62] Эти программы получили значительный импульс в 1980-х годах с появлением пиретроидных инсектицидов, которые не оставляли пятен или запаха после применения, были более долговечными и более экономически эффективными. [56] [62] Региональные органы, занимающиеся борьбой с болезнью Шагаса, возникли благодаря поддержке Панамериканской организации здравоохранения , с Инициативой Южного конуса по ликвидации болезней Шагаса, запущенной в 1991 году, за которой последовали Инициатива стран Анд (1997), Инициатива стран Центральной Америки (1997) и Инициатива стран Амазонки (2004). [32]
Фексинидазол , противопаразитарный препарат, одобренный для лечения африканского трипаносомоза, показал активность против болезни Шагаса в животных моделях. По состоянию на 2019 год он проходит II фазу клинических испытаний для хронической болезни Шагаса в Испании. [38] [63] Другие кандидаты на лекарственные препараты включают GNF6702 , ингибитор протеасомы , который эффективен против болезни Шагаса у мышей и проходит предварительные исследования токсичности, и AN4169, который показал многообещающие результаты в животных моделях. [11] [64]
Ряд экспериментальных вакцин были испытаны на животных. В дополнение к субъединичным вакцинам , некоторые подходы включали вакцинацию ослабленными паразитами T. cruzi или организмами, которые экспрессируют некоторые из тех же антигенов, что и T. cruzi , но не вызывают заболеваний у человека, такими как Trypanosoma rangeli или Phytomonas serpens . Также изучалась ДНК-вакцинация . По состоянию на 2019 год исследования вакцин в основном ограничивались моделями на мелких животных. [10]
По состоянию на 2018 год стандартные диагностические тесты на болезнь Шагаса были ограничены в своей способности измерять эффективность противопаразитарного лечения, поскольку серологические тесты могут оставаться положительными в течение многих лет после того, как T. cruzi выводится из организма, а ПЦР может давать ложноотрицательные результаты, когда концентрация паразита в крови низкая. Несколько потенциальных биомаркеров ответа на лечение находятся в стадии изучения, такие как иммуноферментный анализ против специфических антигенов T. cruzi , проточная цитометрия для выявления антител против различных стадий жизни T. cruzi и маркеры физиологических изменений, вызванных паразитом, такие как изменения в коагуляции и липидном обмене . [18]
Еще одной областью исследований является использование биомаркеров для прогнозирования прогрессирования хронического заболевания. Уровни сывороточного фактора некроза опухоли альфа , мозгового и предсердного натрийуретического пептида и ангиотензинпревращающего фермента 2 были изучены как индикаторы прогноза кардиомиопатии Шагаса. [65]
T. cruzi выделяет острый фазовый антиген (SAPA), который можно обнаружить в крови с помощью ИФА или вестерн-блоттинга [24] , и который использовался в качестве индикатора ранней острой и врожденной инфекции. [65] Разработан анализ на антигены T. cruzi в моче для диагностики врожденного заболевания. [24]