Альдольная реакция ( альдольное присоединение ) — это реакция в органической химии , которая объединяет два карбонильных соединения (например, альдегиды или кетоны ) с образованием нового β-гидроксикарбонильного соединения. Ее простейшая форма может включать нуклеофильное присоединение енолизированного кетона к другому:

Эти продукты известны как альдолы , от альдегид + спирт , структурный мотив, который можно увидеть во многих продуктах. Использование альдегида в названии происходит из его истории: альдегиды более реакционноспособны, чем кетоны, поэтому реакция была обнаружена первой с ними. [2] [3] [4]
Альдольная реакция является парадигматической в органической химии и, возможно, наиболее распространенным способом образования связей углерод-углерод в органической химии . [5] [6] [7] Она дала свое название семейству альдольных реакций , и подобные методы анализируют целое семейство реакций карбонильного α-замещения , а также конденсации дикетонов . Когда нуклеофил и электрофил различны, реакция называется перекрестной альдольной реакцией ; и наоборот, когда нуклеофил и электрофил одинаковы, реакция называется альдольной димеризацией .
Альдольные структурные единицы встречаются во многих важных молекулах, как природных, так и синтетических. [8] [9] Реакция используется в нескольких промышленных синтезах, в частности, пентаэритрита , [10] триметилолпропана , пластификатора 2-этилгексанола и препарата Липитор ( аторвастатин , кальциевая соль). [11] Для многих товарных применений стереохимия альдольной реакции не важна, но эта тема представляет большой интерес для синтеза многих специальных химикатов.

Альдольная реакция имеет один основной механизм, но проявляется в разных формах в зависимости от pH: [12]
Если катализатором является умеренное основание, такое как гидроксид -ион или алкоксид , альдольная реакция происходит посредством нуклеофильной атаки резонансно -стабилизированного енолята на карбонильную группу другой молекулы. Продуктом является алкоксидная соль альдольного продукта. Затем образуется сам альдоль, который затем может подвергаться дегидратации с образованием ненасыщенного карбонильного соединения. Схема показывает простой механизм катализируемой основанием альдольной реакции альдегида с самим собой.

Хотя в некоторых случаях требуется только каталитическое количество основания, более обычной процедурой является использование стехиометрического количества сильного основания, такого как LDA или NaHMDS . В этом случае образование енолята необратимо, и альдольный продукт не образуется до тех пор, пока алкоксид металла альдольного продукта не протонируется на отдельном этапе обработки.
При использовании кислотного катализатора начальный этап механизма реакции включает кислотно-катализируемую таутомеризацию карбонильного соединения в енол. Кислота также служит для активации карбонильной группы другой молекулы путем протонирования, делая ее высокоэлектрофильной. Енол является нуклеофильным на α-углероде, что позволяет ему атаковать протонированное карбонильное соединение, что приводит к альдолю после депротонирования . Некоторые могут также дегидратироваться мимо предполагаемого продукта, давая ненасыщенное карбонильное соединение через альдольную конденсацию .

Несмотря на привлекательность альдольного многообразия, существует несколько проблем, которые необходимо решить, чтобы сделать процесс эффективным. Первая проблема — термодинамическая: большинство альдольных реакций обратимы. Кроме того, равновесие также едва смещено в сторону продуктов в случае простых альдольных реакций альдегида и кетона. [13] Если условия особенно жесткие (например, NaOMe/MeOH/ рефлюкс ), может произойти конденсация, но этого обычно можно избежать с помощью мягких реагентов и низких температур (например, LDA (сильное основание), ТГФ, −78 °C). Хотя альдольное присоединение обычно протекает почти до завершения в необратимых условиях, изолированные альдольные аддукты чувствительны к ретроальдольному расщеплению, вызванному основанием, для возврата исходных материалов. Напротив, ретроальдольные конденсации редки, но возможны. [14] Это основа каталитической стратегии альдолаз класса I в природе, а также многочисленных низкомолекулярных аминных катализаторов. [15]
При реакции смеси несимметричных кетонов можно ожидать образования четырех продуктов перекрестной альдольной ( присоединения ):

Таким образом, если кто-то хочет получить только один из перекрестных продуктов, он должен контролировать, какой карбонил становится нуклеофильным енолом/енолятом, а какой остается в своей электрофильной карбонильной форме. Самый простой контроль — если только один из реагентов имеет кислотные протоны, и только эта молекула образует енолят. Например, добавление диэтилмалоната в бензальдегид дает только один продукт:

Если одна группа значительно более кислая, чем другая, наиболее кислый протон отрывается основанием, и на этом карбониле образуется енолят, в то время как менее кислый карбонил остается электрофильным. Этот тип контроля работает только в том случае, если разница в кислотности достаточно велика, а основание является ограничивающим реагентом . Типичным субстратом для этой ситуации является ситуация, когда депротонируемое положение активируется более чем одной карбонилоподобной группой. Обычными примерами являются группа CH2, фланкированная двумя карбонилами или нитрилами (см., например, конденсацию Кнёвенагеля и первые этапы синтеза малонового эфира и синтеза ацетоуксусного эфира ).
В противном случае, наиболее кислотные карбонилы обычно являются также наиболее активными электрофилами: сначала альдегиды , затем кетоны , затем эфиры и, наконец, амиды . Таким образом, реакции перекрестных альдегидов обычно являются наиболее сложными, поскольку они могут легко полимеризоваться или реагировать неселективно, давая статистическую смесь продуктов. [16]
Одним из распространенных решений является образование енолята одного партнера сначала, а затем добавление другого партнера под кинетическим контролем . [17] Кинетический контроль означает, что прямая реакция альдольного присоединения должна быть значительно быстрее, чем обратная ретроальдольная реакция. Для успешного подхода должны быть выполнены также два других условия: должно быть возможно количественно образовать енолят одного партнера, а прямая альдольная реакция должна быть значительно быстрее, чем передача енолята от одного партнера к другому. Общие условия кинетического контроля включают образование енолята кетона с LDA при −78 °C с последующим медленным добавлением альдегида.
Альдольная реакция объединяет две относительно простые молекулы в более сложную. Повышенная сложность возникает из-за того, что каждый конец новой связи может стать стереоцентром . Современная методология не только разработала высокопродуктивные альдольные реакции, но и полностью контролирует как относительную, так и абсолютную конфигурацию этих новых стереоцентров. [6]
Для описания относительной стереохимии на α- и β-углероде в более старых работах используется номенклатура эритро/трео химии сахаридов ; в более современных работах используется следующее соглашение син / анти . Когда пропионатные (или более высокого порядка) нуклеофилы присоединяются к альдегидам, читатель визуализирует группу R кетона и группу R' альдегида, выровненные в виде «зигзага» на бумаге (или экране). Расположение образованных стереоцентров считается син или анти , в зависимости от того, находятся ли они на одной или противоположных сторонах основной цепи:

Основным фактором, определяющим стереоселективность альдольной реакции, является енолизирующий противоион металла . Более короткие связи металл-кислород «сжимают» переходное состояние и обеспечивают большую стереоселективность. [18] Бор часто используется [19] [20], поскольку длины его связей значительно короче, чем у других дешевых металлов ( лития , алюминия или магния ). Следующая реакция дает соотношение син:анти 80:20 с использованием енолята лития по сравнению с 97:3 с использованием енолята бибутилбора.

Там, где противоион определяет силу стереоиндукции , изомер енолята определяет ее направление . Изомеры E дают анти -продукты, а Z дают син-продукты : [21]

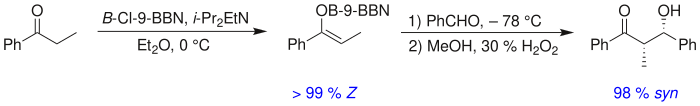
Если два реагента имеют карбонилы, смежные с уже существующим стереоцентром, то новые стереоцентры могут образовываться в фиксированной ориентации относительно старого . Этот «стереоконтроль на основе субстрата» подвергся обширному изучению, и примеры его наводняют литературу. Во многих случаях стилизованное переходное состояние , называемое моделью Циммермана-Тракслера , может предсказать новую ориентацию из конфигурации 6-членного кольца . [22]
Если енол имеет смежный стереоцентр, то два стереоцентра, фланкирующие карбонил в продукте, естественно, син : [23]

Основная механистическая причина зависит от изомера енола. Для енолята E стереоиндукция необходима для избежания 1,3- аллильного напряжения , тогда как енолят Z вместо этого стремится избежать 1,3-диаксиальных взаимодействий: [24]

Однако Фратер и Зеебах показали , что хелатирующий фрагмент основания Льюиса, смежный с енолом, вместо этого вызовет антиприсоединение .
Еноляты E проявляют диастереофациальный отбор Фелкина , тогда как еноляты Z проявляют антифелкиновскую селективность. Общая модель представлена ниже: [25] [26]
Поскольку переходное состояние для Z -енолятов должно содержать либо дестабилизирующее взаимодействие син -пентана, либо анти-Фелкин ротамер , Z -еноляты менее диастереоселективны: [27] [28]
Если и енолят, и альдегид содержат уже существующую хиральность, то результат «двойной стереодифференцирующей» альдольной реакции можно предсказать с помощью объединенной стереохимической модели, которая учитывает все эффекты, обсуждавшиеся выше. [29] Вот несколько примеров: [28]
В конце 1970-х и 1980-х годов Дэвид А. Эванс и его коллеги разработали методику стереоселекции в альдольных синтезах альдегидов и карбоновых кислот . [30] [31] Метод работает путем временного присоединения хирального вспомогательного оксазолидинона для создания хирального енолята. Предшествующая хиральность от вспомогательного вещества затем переносится в альдольный аддукт с помощью методов Циммермана-Тракслера, а затем оксазолидинон отщепляется.
Коммерческие оксазолидиноны относительно дороги, но их получают в 2 этапа синтеза из сравнительно недорогих аминокислот. (Экономичные крупномасштабные синтезы готовят вспомогательные вещества внутри компании.) Сначала борогидрид восстанавливает кислотную часть . Затем полученный аминоспирт дегидратативно циклизуется с простым карбонатным эфиром, таким как диэтилкарбонат.
Ацилирование оксазолидинона неформально называют «загрузкой» .
Анти -аддукты, для которых требуется енолят E , не могут быть надежно получены с помощью метода Эванса. Однако еноляты Z , приводящие к син -аддуктам, могут быть надежно образованы с помощью мягкой енолиза, опосредованной бором: [32]
Часто один диастереомер может быть получен путем одной кристаллизации альдольного аддукта.
Многие методы расщепляют вспомогательный элемент: [33]
Распространенным дополнительным хиральным вспомогательным веществом является тиоэфирная группа: [33] [b]
В подходе Кримминса с тиазолидинтионом [34] [35] тиазолидинтион является хиральным вспомогательным веществом [36] и может производить аддукты "син Эванса" или "не-син Эванса" простым изменением количества (−)-спартеина . Предполагается, что реакция протекает через шестичленные, связанные с титаном переходные состояния , аналогичные предлагаемым переходным состояниям для вспомогательного вещества Эванса.
Распространенная модификация альдольной реакции использует другие, похожие функциональные группы, как эрзац- енолы. В альдольной реакции Мукаямы [37] эфиры силил енолов присоединяются к карбонилам в присутствии катализатора кислоты Льюиса , такого как трифторид бора (в виде эфирата трифторида бора ) или тетрахлорид титана [38] [39 ]
В алкилировании енаминов по Сторку вторичные амины образуют енамины при воздействии кетонов. Затем эти енамины реагируют (возможно, энантиоселективно [ 40]) с подходящими электрофилами. Эта стратегия предлагает простой энантиоселектив без переходных металлов. В отличие от предпочтения син -аддуктов, обычно наблюдаемого в альдольных присоединениях на основе енолята, эти альдольные присоединения являются антиселективными .
В водном растворе енамин затем может быть гидролизован из продукта, что делает его катализатором небольшой органической молекулы . В основополагающем примере пролин эффективно катализировал циклизацию трикетона:
Эта комбинация представляет собой реакцию Хайоса-Пэрриша [41] [42] [43] В условиях Хайоса-Пэрриша необходимо только каталитическое количество пролина (3 мол.%). Опасности ахиральной фоновой реакции нет, поскольку переходные промежуточные енамины гораздо более нуклеофильны, чем их исходные кетоны-енолы.
Стратегия типа Stork также допускает сложные перекрестные реакции между двумя альдегидами. Во многих случаях условия достаточно мягкие, чтобы избежать полимеризации: [44]
Однако селективность требует медленного контролируемого шприцевым насосом добавления желаемого электрофильного партнера, поскольку оба реагирующих партнера обычно имеют енолизируемые протоны. Если один альдегид не имеет енолизируемых протонов или альфа- или бета-разветвлений, можно добиться дополнительного контроля.
В обычном альдольном присоединении карбонильное соединение депротонируется с образованием енолята. Енолят добавляется к альдегиду или кетону, который образует алкоксид, который затем протонируется при обработке. Превосходный метод, в принципе, избегал бы необходимости в многошаговой последовательности в пользу «прямой» реакции, которая может быть выполнена за один шаг процесса.
Если один из партнеров по сочетанию предпочтительно енолизируется, то общая проблема заключается в том, что добавление генерирует алкоксид, который является гораздо более основным, чем исходные материалы. Этот продукт прочно связывается с енолизирующим агентом, не давая ему катализировать дополнительные реагенты:

Один из подходов, продемонстрированный Эвансом, заключается в силилировании альдольного аддукта. [45] [46] В реакцию добавляется кремниевый реагент, такой как TMSCl , который заменяет металл на алкоксиде, обеспечивая оборот металлического катализатора:
Традиционные синтезы гексоз используют вариации итеративных стратегий защиты-снятия защиты , требующие 8–14 этапов; органокатализ позволяет получить доступ ко многим из тех же субстратов с помощью двухэтапного протокола, включающего катализируемую пролином димеризацию альфа-оксиальдегидов с последующей тандемной альдольной циклизацией Мукаямы.
Альдольная димеризация альфа-оксиальдегидов требует, чтобы альдольный аддукт, сам по себе являющийся альдегидом, был инертен к дальнейшим альдольным реакциям. [47] Более ранние исследования показали, что альдегиды, несущие альфа-алкилокси или альфа- силилокси заместители, подходят для этой реакции, в то время как альдегиды, несущие электроноакцепторные группы, такие как ацетокси, были нереакционноспособны. Защищенный продукт эритрозы затем можно было преобразовать в четыре возможных сахара посредством альдольного присоединения Мукаямы с последующим образованием лактола . Это требует соответствующего диастереоконтроля в альдольном присоединении Мукаямы и продукта силилоксикарбениевого иона для предпочтительной циклизации, а не для дальнейшей альдольной реакции. В конце концов, были синтезированы глюкоза , манноза и аллоза :
Примерами альдольных реакций в биохимии являются расщепление фруктозо-1,6-бисфосфата на дигидроксиацетон и глицеральдегид-3-фосфат на четвертой стадии гликолиза , что является примером обратной («ретро») альдольной реакции, катализируемой ферментом альдолазой А (также известной как фруктозо-1,6-бисфосфатальдолаза).
В глиоксилатном цикле растений и некоторых прокариот изоцитратлиаза производит глиоксилат и сукцинат из изоцитрата . После депротонирования группы ОН изоцитратлиаза расщепляет изоцитрат на четырехуглеродный сукцинат и двухуглеродный глиоксилат посредством реакции альдольного расщепления. Это расщепление механически похоже на реакцию альдолазы А гликолиза.
Альдольная реакция была открыта независимо русским химиком (и композитором-романтиком) Александром Бородиным в 1869 году [48] [49] [50] и французским химиком Шарлем-Адольфом Вюрцем в 1872 году, который первоначально использовал альдегиды для проведения реакции. [2] [3] [4]
Говард Циммерман и Марджори Д. Трэкслер предложили свою модель стереоиндукции в статье 1957 года. [22]