

Цитокинез ( / ˌ s aɪ t oʊ k ɪ ˈ n iː s ɪ s / ) — часть процесса деления клеток и часть митоза, во время которого цитоплазма одной эукариотической клетки делится на две дочерние клетки. Деление цитоплазмы начинается во время или после поздних стадий деления ядра при митозе и мейозе . В ходе цитокинеза веретенообразный аппарат разделяет и транспортирует дублированные хроматиды в цитоплазму отделяющихся дочерних клеток . Таким образом, это гарантирует, что число и состав хромосом сохраняются от одного поколения к другому и что, за исключением особых случаев, дочерние клетки будут функциональными копиями родительской клетки. После завершения телофазы и цитокинеза каждая дочерняя клетка вступает в интерфазу клеточного цикла .
Отдельные функции требуют различных отклонений от процесса симметричного цитокинеза; например, при оогенезе у животных яйцеклетка занимает почти всю цитоплазму и органеллы . Это оставляет очень мало для образующихся полярных тел , которые у большинства видов умирают, не функционируя, хотя у других видов они берут на себя различные специальные функции. [1] Другая форма митоза встречается в таких тканях, как печень и скелетные мышцы ; в нем отсутствует цитокинез, в результате чего образуются многоядерные клетки ( см. синцитий ).
Цитокинез растений отличается от цитокинеза животных, отчасти из-за жесткости стенок растительных клеток. Вместо растительных клеток, образующих борозду расщепления, которая возникает между дочерними клетками животных, в цитоплазме формируется разделительная структура, известная как клеточная пластинка , которая вырастает в новую, удвоенную клеточную стенку между дочерними клетками растений. Он делит клетку на две дочерние клетки.
Цитокинез во многом напоминает прокариотический процесс бинарного деления , но из-за различий между структурами и функциями прокариотических и эукариотических клеток механизмы различаются. Например, бактериальная клетка имеет кольцевую хромосому (одну хромосому в форме замкнутой петли), в отличие от линейных , обычно множественных, хромосом эукариот. Соответственно, бактерии не строят митотического веретена при делении клеток. Также дупликация прокариотической ДНК происходит при фактическом разделении хромосом; при митозе дупликация происходит во время интерфазы до начала митоза, хотя дочерние хроматиды не разделяются полностью до анафазы .
В слове «цитокинез» ( / ˌ s aɪ t oʊ k aɪ ˈ n iː s ɪ s , - t ə -, - k ə -/ [ 2] [3] ) используются сочетающиеся формы цито- + кине- + -сис . , неолатинское от классической латыни и древнегреческого , отражающее « клетку » и kinesis («движение, движение»). Он был придуман Чарльзом Отисом Уитменом в 1887 году. [4]
Происхождение этого термина - от греческого κύτος ( китос , полость), латинского производного цито (клеточный), греческого κίνησις ( кинезис , движение).
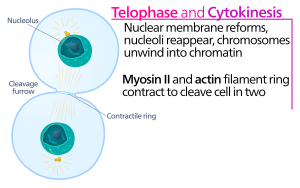
Цитокинез клеток животных начинается вскоре после начала разделения сестринских хроматид в анафазе митоза . Этот процесс можно разделить на следующие отдельные этапы: реорганизация анафазного веретена, спецификация плоскости деления, сборка и сокращение актин-миозинового кольца и отделение. [5] Точное разделение генома на возникающие дочерние клетки обеспечивается за счет тесной временной координации вышеупомянутых отдельных событий с помощью молекулярных сигнальных путей.
Цитокинез клеток животных начинается со стабилизации микротрубочек и реорганизации митотического веретена с образованием центрального веретена. Центральное веретено (или средняя зона веретена ) образуется, когда некинетохорные волокна микротрубочек связываются между полюсами веретена. Ряду различных видов, включая H. sapiens , D. melanogaster и C. elegans, требуется центральное веретено для эффективного осуществления цитокинеза, хотя специфический фенотип , связанный с его отсутствием, варьируется от одного вида к другому (например, некоторые клетки дрозофилы типы не способны образовывать борозду дробления без центрального веретена, тогда как как у эмбрионов C. elegans , так и в клетках культуры тканей человека наблюдается образование и проникновение борозды дробления, но затем регрессия до завершения цитокинеза). Процесс реорганизации митотического веретена и формирования центрального веретена обусловлен снижением активности CDK1 во время анафазы. [5] Снижение активности CDK1 при переходе метафаза-анафаза приводит к дефосфорилированию тормозных сайтов на нескольких компонентах центрального веретена. Прежде всего, удаление фосфорилирования CDK1 из субъединицы CPC (хромосомного пассажирского комплекса) позволяет его транслокализировать в центральное веретено из центромер, где он находится во время метафазы. Помимо того, что CPC является структурным компонентом самого центрального веретена, он также играет роль в фосфоррегуляции других компонентов центрального веретена, включая PRC1 (белок, связывающий микротрубочки, необходимый для цитокинеза 1) и MKLP1 (моторный белок кинезина). Первоначально ингибируемый CDK1-опосредованным фосфорилированием, PRC1 теперь способен образовывать гомодимер, который избирательно связывается с границей раздела между антипараллельными микротрубочками, облегчая пространственную организацию микротрубочек центрального веретена. MKLP1 вместе с белком CYK-4, активирующим ГТФазу семейства Rho (также называемым MgcRacGAP), образует комплекс централспиндлин. Centralspindlin связывается с центральным веретеном в виде кластеров более высокого порядка. Формированию кластера централспиндлина способствует фосфорилирование MLKP1 с помощью Aurora B, компонента CPC. Короче говоря, самосборка центрального веретена инициируется посредством фосфорегуляции множества компонентов центрального веретена за счет снижения активности CDK1, прямо или косвенно, при метафазно-анафазном переходе. Центральное веретено может выполнять множество функций в цитокинезе, включая контроль положения борозды расщепления, доставку мембранных везикул в борозду расщепления и формирование структуры среднего тела, которая необходима для заключительных стадий деления. [6]
Второй этап цитокинеза клеток животных включает спецификацию плоскости деления и образование цитокинетической борозды. Точное расположение плоскости деления между двумя массами сегрегированных хромосом имеет важное значение для предотвращения потери хромосом. Между тем, механизм, с помощью которого веретено определяет плоскость деления в клетках животных, является, пожалуй, самой непреходящей загадкой цитокинеза и предметом интенсивных дискуссий. Существуют три гипотезы индукции борозд. [6] Первая — это гипотеза астральной стимуляции, которая постулирует, что астральные микротрубочки от полюсов веретена передают сигнал, индуцирующий борозды, в кору клеток, где сигналы от двух полюсов каким-то образом фокусируются в кольцо на веретене. Вторая возможность, называемая гипотезой центрального веретена, заключается в том, что борозда расщепления индуцируется положительным стимулом, исходящим из экватора центрального веретена. Центральное веретено может способствовать спецификации плоскости деления, способствуя концентрации и активации малой ГТФазы RhoA в экваториальной коре. Третья гипотеза — это гипотеза астральной релаксации. Он постулирует, что активные актин-миозиновые пучки распределены по всей коре клетки, и ингибирование их сокращения вблизи полюсов веретена приводит к градиенту сократительной активности, который является самым высоким в средней точке между полюсами. Другими словами, астральные микротрубочки генерируют отрицательный сигнал, который усиливает релаксацию коры вблизи полюсов. Генетические исследования и исследования с помощью лазерной микроманипуляции на эмбрионах C. elegans показали, что веретено посылает в кору клеток два избыточных сигнала: один исходит от центрального веретена, а второй сигнал исходит от веретена астры, что позволяет предположить участие нескольких механизмов, объединенных в расположение борозды расщепления. Преобладание одного конкретного сигнала варьируется в зависимости от типа клеток и организмов. А для обеспечения надежности системы и повышения пространственной точности может потребоваться множество и частичная избыточность сигналов. [5]
В борозде цитокинезного расщепления именно актин-миозиновое сократительное кольцо запускает процесс расщепления, во время которого клеточная мембрана и стенка растут внутрь, что в конечном итоге сжимает материнскую клетку надвое. Ключевыми компонентами этого кольца являются нитевидный белок актин и моторный белок миозин II. Сократительное кольцо собирается экваториально (в середине клетки) в коре клетки (рядом с клеточной мембраной). Семейство белков Rho (белок RhoA в клетках млекопитающих) является ключевым регулятором образования и сокращения сократительных колец в клетках животных. [6] Путь RhoA способствует сборке актин-миозинового кольца двумя основными эффекторами. Во-первых, RhoA стимулирует зарождение неразветвленных актиновых филаментов путем активации связанных с Diaphanous форминов. Это локальное поколение новых актиновых филаментов важно для формирования сократительного кольца. [6] Этот процесс формирования актиновых нитей также требует белка под названием профилин, который связывается с мономерами актина и помогает загрузить их на конец нити. Во-вторых, RhoA способствует активации миозина II с помощью киназы ROCK, которая активирует миозин II непосредственно путем фосфорилирования легкой цепи миозина, а также ингибирует фосфатазу миозина путем фосфорилирования субъединицы MYPT, нацеленной на фосфатазу. Помимо актина и миозина II, сократительное кольцо содержит каркасный белок аниллин. Аниллин связывается с актином, миозином, RhoA и CYK-4 и тем самым связывает экваториальную кору с сигналами центрального веретена. Он также способствует связыванию актин-миозинового кольца с плазматической мембраной. Кроме того, аниллин генерирует сократительные силы, устраняя температурные колебания. [7] Предполагается, что другой белок, септин, служит структурным каркасом, на котором организован аппарат цитокинеза. После сборки сокращение актин-миозинового кольца приводит к проникновению прикрепленной плазматической мембраны, которая разделяет цитоплазму на два домена возникающих сестринских клеток. Сила сократительных процессов создается движениями вдоль актина моторного белка миозина II. Миозин II использует свободную энергию, высвобождаемую при гидролизе АТФ , для движения вдоль этих актиновых нитей, сжимая клеточную мембрану, образуя борозду расщепления . Продолжающийся гидролиз приводит к проникновению этой борозды расщепления (движению внутрь) - поразительный процесс, который хорошо виден в световой микроскоп .
Цитокинетическая борозда проникает до тех пор, пока не образуется структура среднего тела (состоящая из электронно-плотного белкового материала), где актин-миозиновое кольцо достигает диаметра около 1–2 мкм. Большинство типов клеток животных остаются связанными межклеточным цитокинетическим мостиком в течение нескольких часов, пока они не будут разделены актин-независимым процессом, называемым абсциссией, последним этапом цитокинеза. [5] [8]
Процесс отделения физически раскалывает среднее тело на две части. Отторжение происходит за счет удаления структур цитоскелета из цитокинетического мостика, сужения коры клетки и деления плазматической мембраны. Межклеточный мостик заполнен плотными пучками антипараллельных микротрубочек, отходящих от центрального веретена. Эти микротрубочки перекрываются в средней части тела, которая обычно считается целевой платформой для механизма отрыва.
Белок спастин , разрезающий микротрубочки , в значительной степени отвечает за разборку пучков микротрубочек внутри межклеточного мостика. Полное сужение коры также требует удаления нижележащих структур цитоскелета. Разборка актиновых филаментов во время позднего цитокинеза зависит от комплекса PKCε-14-3-3, который инактивирует RhoA после проникновения в борозды. Разборка актина дополнительно контролируется GTPase Rab35 и ее эффектором, фосфатидилинозитол-4,5-бисфосфат-5-фосфатазой OCRL. Понимание механизма, посредством которого в конечном итоге расщепляется плазматическая мембрана, требует дальнейшего изучения.
Цитокинез необходимо контролировать во времени, чтобы гарантировать, что он происходит только после разделения сестринских хроматид во время анафазной части нормальных пролиферативных делений клеток. Для достижения этой цели многие компоненты механизма цитокинеза строго регулируются, чтобы гарантировать, что они способны выполнять определенную функцию только на определенной стадии клеточного цикла . [9] [10] Цитокинез происходит только после того, как APC связывается с CDC20. [ нужна цитация ] Это позволяет разделению хромосом и миозину работать одновременно.
После цитокинеза некинетохорные микротрубочки реорганизуются и исчезают в новом цитоскелете, когда клеточный цикл возвращается в интерфазу (см. также клеточный цикл ).
Из-за наличия клеточной стенки цитокинез в растительных клетках значительно отличается от цитокинеза в клетках животных. Вместо того, чтобы образовывать сократительное кольцо, растительные клетки создают клеточную пластинку в середине клетки. Стадии формирования клеточной пластинки включают (1) создание фрагмопласта , набора микротрубочек , который направляет и поддерживает формирование клеточной пластинки ; (2) перемещение везикул в плоскость деления и их слияние с образованием трубчато-везикулярной сети; (3) продолжающееся слияние мембранных канальцев и их трансформация в мембранные листы при отложении каллозы с последующим отложением целлюлозы и других компонентов клеточной стенки ; (4) рециркуляция избыточной мембраны и другого материала клеточной пластинки ; и (5) слияние с родительской клеточной стенкой [11] [12]
Фрагмопласт собирается из остатков митотического веретена и служит путем для доставки везикул в среднюю зону фрагмопласта. Эти везикулы содержат липиды, белки и углеводы, необходимые для формирования новой клеточной границы. Электронно-томографические исследования выявили, что источником этих везикул является аппарат Гольджи , [13] [14] , но другие исследования показали, что они также содержат эндоцитозированный материал. [15] [16]
Эти канальцы затем расширяются и сливаются латерально друг с другом, в конечном итоге образуя плоский окончатый листок [8] . По мере созревания клеточной пластинки большое количество мембранного материала удаляется посредством клатрин-опосредованного эндоцитоза [7] . В конце концов, края клеточной пластинки сливаются с родительской плазматической мембраной , часто асимметрично, [17] , таким образом завершая цитокинез. Остальные фенестры содержат проходящие через них нити эндоплазматического ретикулума и считаются предшественниками плазмодесм [8] .
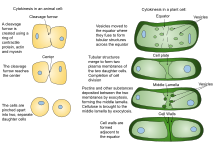
Строительство новой клеточной стенки начинается в просвете узких канальцев молодой клеточной пластинки . Порядок отложения различных компонентов клеточной стенки был определен в основном с помощью иммуноэлектронной микроскопии. Первыми поступающими компонентами являются пектины , гемицеллюлозы и белки арабиногалактана , переносимые секреторными пузырьками, которые сливаются, образуя клеточную пластинку. [18] Следующим добавляемым компонентом является каллоза , которая полимеризуется непосредственно на клеточной пластинке под действием каллозосинтазы. По мере того как клеточная пластинка продолжает созревать и сливается с родительской плазматической мембраной, каллоза медленно заменяется целлюлозой , основным компонентом зрелой клеточной стенки [6] . Средняя пластинка (клееобразный слой, содержащий пектин) развивается из клеточной пластинки и служит для связывания клеточных стенок соседних клеток вместе. [19] [20]
Цитокинетическая ингрессия в борозды обеспечивается миозиновой АТФазой II типа . Поскольку миозины рекрутируются в медиальную область, сократительные силы, действующие на кору, напоминают сужение «кошелька», тянущееся внутрь. Это приводит к внутреннему сужению. Плазматическая мембрана в силу ее тесной связи с корой через сшивающие белки [21] Для сужения борозды расщепления общая площадь поверхности должна быть увеличена за счет снабжения плазматической мембраны посредством экзоцитоза. [22]
Теоретические модели показывают, что симметричное сжатие требует как боковой стабилизации, так и усилий сжатия. [23] Снижение внешнего давления и поверхностного натяжения (за счет перемещения мембраны) уменьшает необходимые силы стабилизации и сжатия.
CEP55 представляет собой митотический фосфопротеин, который играет ключевую роль в цитокинезе, заключительной стадии клеточного деления. [24] [25]
В некоторых случаях клетка может делиться свой генетический материал и увеличиваться в размерах, но не подвергается цитокинезу. Это приводит к образованию более крупных клеток с более чем одним ядром. Обычно это нежелательная аберрация, которая может быть признаком раковых клеток. [26]