MT-ATP6 (или ATP6 ) — это митохондриальный ген с полным названием «митохондриально кодируемая субъединица мембраны АТФ-синтазы 6», который кодирует субъединицу F o 6 (или субъединицу/цепь A) АТФ-синтазы . Эта субъединица принадлежит комплексу F o большой трансмембранной АТФ-синтазы F-типа . [5] Этот фермент, также известный как комплекс V, отвечает за конечный этап окислительного фосфорилирования в цепи переноса электронов . В частности, один сегмент АТФ-синтазы позволяет положительно заряженным ионам , называемым протонами , проходить через специализированную мембрану внутри митохондрий. Другой сегмент фермента использует энергию, создаваемую этим потоком протонов, для преобразования молекулы, называемой аденозиндифосфатом (АДФ), в АТФ . Мутации в гене MT-ATP6 были обнаружены примерно у 10–20 процентов людей с синдромом Лея . [6]

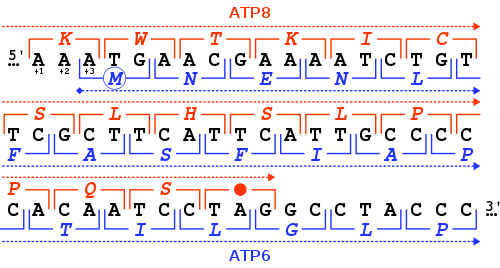
Ген MT-ATP6 предоставляет информацию для создания белка, который необходим для нормальной функции митохондрий. Человеческий ген MT-ATP6 , расположенный в митохондриальной ДНК , имеет длину 681 пары оснований . [7] Необычной особенностью MT-ATP6 является 46- нуклеотидное перекрытие его первых кодонов с концом гена MT-ATP8 . Что касается рамки считывания MT-ATP6 (+3), ген MT-ATP8 заканчивается в рамке считывания +1 стоп-кодоном TAG .
Белок MT-ATP6 весит 24,8 кДа и состоит из 226 аминокислот . [8] [9] Белок является субъединицей F 1 F o АТФазы, также известной как Комплекс V , которая состоит из 14 ядерно- и 2 митохондриально-кодируемых субъединиц. Как субъединица A, MT-ATP6 содержится в некаталитической, трансмембранной части F o комплекса. [7]
Номенклатура фермента имеет долгую историю. Фракция F 1 получила свое название от термина «Фракция 1», а F o (пишется как подстрочная буква «o», а не «ноль») получила свое название от связывающей фракции для олигомицина , типа антибиотика природного происхождения, который способен ингибировать единицу F o АТФ-синтазы. [10] [11] Область F o АТФ-синтазы представляет собой протонную пору, встроенную в митохондриальную мембрану. Она состоит из трех основных субъединиц A, B и C, и (у человека) шести дополнительных субъединиц, d , e , f , g , F6 и 8 (или A6L). Трехмерная структура гомолога этой субъединицы E. coli была смоделирована на основе данных электронной микроскопии (цепь M PDB : 1c17 ). Образует трансмембранный 4-α-пучок.
Эта субъединица является ключевым компонентом протонного канала и может играть прямую роль в транслокации протонов через мембрану. Катализ в комплексе F 1 зависит от вращения центрального стебля и F o c-кольца, которое, в свою очередь, управляется потоком протонов через мембрану через интерфейс между F0 c-кольцом и субъединицей A. Периферийный стебель связывает субъединицу A с внешней поверхностью домена F 1 и, как полагают, действует как статор, противодействуя тенденции субъединицы A и каталитической части F 1 alpha 3 beta 3 вращаться с центральным вращающимся элементом. [12]
Мутации MT-ATP6 и других генов, влияющих на окислительное фосфорилирование в митохондриях, связаны с различными нейродегенеративными и сердечно-сосудистыми расстройствами, включая дефицит митохондриального комплекса V, наследственную оптическую нейропатию Лебера (LHON), митохондриальную энцефаломиопатию с инсультоподобными эпизодами ( MELAS ), синдром Лея и синдром NARP . Большинство клеток организма содержат тысячи митохондрий, каждая из которых имеет одну или несколько копий митохондриальной ДНК . Тяжесть некоторых митохондриальных расстройств связана с процентом митохондрий в каждой клетке, которая имеет определенное генетическое изменение. Люди с синдромом Лея из-за мутации гена MT-ATP6, как правило, имеют очень высокий процент митохондрий с мутацией (от более 90 процентов до 95 процентов). Менее серьезные признаки NARP являются результатом более низкого процента митохондрий с мутацией, обычно от 70 до 90 процентов. Поскольку эти два состояния являются результатом одних и тех же генетических изменений и могут возникать у разных членов одной семьи, исследователи полагают, что они могут представлять собой спектр перекрывающихся признаков, а не два отдельных синдрома. [6]
Дефицит митохондриального комплекса V — это недостаток (дефицит) или потеря функции в комплексе V цепи переноса электронов , что может вызывать широкий спектр признаков и симптомов, влияющих на многие органы и системы организма, особенно на нервную систему и сердце . Расстройство может быть опасным для жизни в младенчестве или раннем детстве. У пораженных людей могут быть проблемы с питанием, медленный рост, низкий мышечный тонус ( гипотония ), сильная усталость ( летаргия ) и задержка развития . У них, как правило, повышается уровень молочной кислоты в крови ( лактацидоз ), что может вызывать тошноту, рвоту, слабость и учащенное дыхание. Высокий уровень аммиака в крови ( гипераммониемия ) также может возникать у пораженных людей, и в некоторых случаях приводит к нарушению функции мозга ( энцефалопатия ) и повреждению других органов. [13] У пациентов с мутацией сдвига рамки считывания в MT-ATP6 наблюдались атаксия , микроцефалия , задержка развития и умственная отсталость. Это приводит к вставке C в позиции 8612, что приводит к укорочению белка длиной всего 36 аминокислот, и двум полиморфизмам T > C с одним нуклеотидом в позициях 8610 и 8614, которые приводят к образованию гомополимерного участка цитозина . [14]
Другой распространенной чертой дефицита митохондриального комплекса V является гипертрофическая кардиомиопатия . Это состояние характеризуется утолщением ( гипертрофией ) сердечной мышцы , что может привести к сердечной недостаточности . [13] Мутация m.8528T>C происходит в перекрывающейся области генов MT-ATP6 и MT-ATP8 и была описана у нескольких пациентов с детской кардиомиопатией. Эта мутация изменяет инициирующий кодон в MT-ATP6 на треонин, а также изменяет триптофан на аргинин в позиции 55 MT-ATP8 . [15] [16] Люди с дефицитом митохондриального комплекса V также могут иметь характерный рисунок черт лица, включая высокий лоб, изогнутые брови, внешние уголки глаз, направленные вниз (нисходящие глазные щели ), выступающую переносицу, низко посаженные уши, тонкие губы и маленький подбородок ( микрогнатия ). [13]
Известно, что патогенные варианты митохондриального гена MT-ATP6 вызывают синдром Лея , связанный с мтДНК , — прогрессирующее заболевание мозга, которое обычно проявляется в младенчестве или раннем детстве. У больных детей может наблюдаться задержка развития , мышечная слабость, проблемы с движением или затрудненное дыхание. [6] Другие варианты, которые, как известно, вызывают синдром Лея, связанный с мтДНК, включают MT-TL1 , MT-TK , MT-TW , MT-TV , MT-ND1 , MT-ND2 , MT-ND3 , MT- ND4 , MT-ND5 , MT-ND6 и MT-CO3 . Нарушения в генерации энергии митохондриями приводят к нейродегенеративным расстройствам, таким как синдром Лея , который характеризуется появлением симптомов в возрасте от 12 месяцев до трех лет. Симптомы часто проявляются после вирусной инфекции и включают двигательные расстройства и периферическую невропатию , а также гипотонию , спастичность и мозжечковую атаксию . Примерно половина пораженных пациентов умирают от дыхательной или сердечной недостаточности к трем годам. Синдром Лея является наследственным по материнской линии заболеванием, и его диагноз устанавливается с помощью генетического тестирования вышеупомянутых митохондриальных генов, включая MT-ATP6. [17] Мутации гена MT-ATP6, связанные с синдромом Лея, изменяют один строительный блок ДНК ( нуклеотид ) в гене MT-ATP6. Наиболее распространенное генетическое изменение заменяет нуклеотид тимин на гуанин в позиции 8993 (пишется как T8993G). Мутации, вызывающие синдром Лея, нарушают функцию или стабильность комплекса АТФ-синтазы , ингибируя выработку АТФ и нарушая окислительное фосфорилирование . Хотя точный механизм неясен, исследователи полагают, что нарушенное окислительное фосфорилирование может привести к гибели клетки из-за снижения доступной в клетке энергии. Некоторые ткани, которым требуется большое количество энергии, такие как мозг, мышцы и сердце, кажутся особенно чувствительными к снижению клеточной энергии. Смерть клеток в мозге, вероятно, вызывает характерные изменения в мозге, наблюдаемые при синдроме Лея, которые способствуют признакам и симптомам этого состояния. Смерть клеток в других чувствительных тканях также может способствовать признакам синдрома Лея. ГетероплазматическийМутация T→C MT-ATP6 в позиции 9185 приводит к замене высококонсервативного лейцина на пролин в кодоне 220, а гетероплазматическая миссенс-мутация T→C в позиции 9191 преобразует высококонсервативный лейцин в пролин в позиции 222 полипептида , что приводит к фенотипу типа Лея . Мутация T9185C привела к легкому и обратимому фенотипу , при этом 97% образцов мышц и крови пациента отражали мутацию. Мутация T9191C представила гораздо более тяжелый фенотип, который привел к смерти пациента в возрасте 2 лет. [18]
Некоторые из мутаций гена ATP6, вызывающих синдром Лея, также ответственны за похожее, но менее тяжелое состояние, называемое нейропатией, атаксией и пигментным ретинитом (NARP). [19] Небольшое количество мутаций в гене MT-ATP6 было выявлено у людей с NARP. Каждая из этих мутаций изменяет один нуклеотид в гене MT-ATP6. Как и при синдроме Лея, наиболее распространенное генетическое изменение, связанное с NARP, заменяет нуклеотид тимин на гуанин в позиции 8993 (записывается как T8993G). Мутации, вызывающие NARP, изменяют структуру или функцию АТФ-синтазы , снижая способность митохондрий вырабатывать АТФ. Хотя точные эффекты этих мутаций неясны, исследователи продолжают изучать, как изменения в гене MT-ATP6 мешают выработке АТФ и приводят к мышечной слабости, потере зрения и другим признакам NARP. [6]
Состояние, называемое семейным двусторонним некрозом полосатого тела, которое похоже на синдром Лея, также может быть результатом изменений в гене MT-ATP6. В нескольких зарегистрированных случаях с этими мутациями у пострадавших детей наблюдались задержка развития, проблемы с движением и координацией, слабый мышечный тонус ( гипотония ) и необычно маленький размер головы ( микроцефалия ). Исследователи не определили, почему мутации MT-ATP6 приводят к такому сочетанию признаков и симптомов у детей с двусторонним некрозом полосатого тела. [6]
Было показано, что MT-ATP6 имеет 20 бинарных белок-белковых взаимодействий, включая 17 ко-комплексных взаимодействий. MT-ATP6, по-видимому, взаимодействует с SP1 . [20]
Исследовательский фонд SENS опубликовал статью, в которой подробно описывается успешная аллотопическая экспрессия замещающей ДНК для гена MT-ATP6 в ядерной ДНК клетки. [21]
В данной статье использован текст из Национальной медицинской библиотеки США , являющийся общественным достоянием .