Нейрофармакология — это изучение того, как лекарства влияют на функции нервной системы, а также нейронных механизмов, посредством которых они влияют на поведение. [1] Существует два основных направления нейрофармакологии: поведенческая и молекулярная. Поведенческая нейрофармакология фокусируется на изучении того, как наркотики влияют на поведение человека ( нейропсихофармакология ), включая изучение того, как наркозависимость и наркомания влияют на мозг человека . [2] Молекулярная нейрофармакология включает изучение нейронов и их нейрохимических взаимодействий с общей целью разработки лекарств, которые оказывают благотворное влияние на неврологические функции. Обе эти области тесно связаны, поскольку обе связаны с взаимодействиями нейротрансмиттеров , нейропептидов , нейрогормонов , нейромодуляторов , ферментов , вторичных мессенджеров , котранспортеров , ионных каналов и рецепторных белков в центральной и периферической нервной системе . Изучая эти взаимодействия, исследователи разрабатывают лекарства для лечения множества различных неврологических расстройств, включая боль , нейродегенеративные заболевания, такие как болезнь Паркинсона и болезнь Альцгеймера , психологические расстройства, зависимость и многие другие.
Нейрофармакология не появлялась в научной сфере до тех пор, пока в начале 20-го века учёные не смогли получить базовое представление о нервной системе и о том, как нервы взаимодействуют друг с другом. До этого открытия были обнаружены лекарства, оказывающие определенное влияние на нервную систему. В 1930-х годах французские ученые начали работать с соединением под названием фенотиазин в надежде синтезировать лекарство, способное бороться с малярией. Хотя этот препарат не показал особой надежды на применение против лиц, инфицированных малярией, было обнаружено, что он оказывает седативное действие, а также оказывает благоприятное воздействие на пациентов с болезнью Паркинсона. Этот метод «черного ящика», при котором исследователь вводил лекарство и исследовал реакцию, не зная, как связать действие лекарства с реакцией пациента, был основным подходом в этой области до тех пор, пока в конце 1940-х и начале 1950-х годов ученые не смогли идентифицировать специфические нейротрансмиттеры, такие как норадреналин (участвующий в сужении кровеносных сосудов, увеличении частоты сердечных сокращений и артериального давления), дофамин (химическое вещество, нехватка которого приводит к болезни Паркинсона) и серотонин (который вскоре будет признан тесно связанным с депрессией). [ нужна цитата ] ). В 1950-х годах ученые также стали лучше измерять уровни определенных нейрохимических веществ в организме и, таким образом, коррелировать эти уровни с поведением. [3] Изобретение клещей напряжения в 1949 году позволило изучить ионные каналы и потенциал нервного действия . Эти два важнейших исторических события в нейрофармакологии позволили ученым не только изучить, как информация передается от одного нейрона к другому, но и изучить, как нейрон обрабатывает эту информацию внутри себя. [ нужна цитата ]
Нейрофармакология — очень широкая область науки, которая охватывает многие аспекты нервной системы: от манипуляций с отдельными нейронами до целых областей головного мозга, спинного мозга и периферических нервов. Чтобы лучше понять основу разработки лекарств , нужно сначала понять, как нейроны общаются друг с другом. [ нужна цитата ]

Чтобы понять потенциальные достижения в медицине, которые может принести нейрофармакология, важно понять, как человеческое поведение и мыслительные процессы передаются от нейрона к нейрону и как лекарства могут изменить химические основы этих процессов. [ нужна цитата ]
Нейроны известны как возбудимые клетки, поскольку на их поверхностной мембране имеется множество белков, известных как ионные каналы, которые позволяют небольшим заряженным частицам проникать в клетку и выходить из нее. Структура нейрона позволяет химической информации приниматься его дендритами , распространяться через перикарион (тело клетки) и вниз по аксону и в конечном итоге передаваться другим нейронам через окончание аксона . Эти потенциалзависимые ионные каналы обеспечивают быструю деполяризацию во всей клетке. Эта деполяризация, если она достигнет определенного порога, вызовет потенциал действия . Как только потенциал действия достигает окончания аксона, он вызывает приток ионов кальция в клетку. Ионы кальция затем заставят везикулы, небольшие пакеты, наполненные нейротрансмиттерами , связываться с клеточной мембраной и высвобождать ее содержимое в синапс. Эта клетка известна как пресинаптический нейрон, а клетка, которая взаимодействует с высвобождаемыми нейротрансмиттерами, известна как постсинаптический нейрон. Как только нейротрансмиттер высвобождается в синапс, он может либо связываться с рецепторами постсинаптической клетки, пресинаптическая клетка может повторно поглощать его и сохранять для последующей передачи, либо он может расщепляться ферментами в синапсе. специфичный для этого определенного нейромедиатора. Эти три различных действия являются основными областями, в которых действие лекарств может повлиять на связь между нейронами. [3]
Существует два типа рецепторов, с которыми взаимодействуют нейротрансмиттеры на постсинаптическом нейроне. Первые типы рецепторов представляют собой лиганд-управляемые ионные каналы или LGIC. Рецепторы LGIC представляют собой самые быстрые типы трансдукции химического сигнала в электрический сигнал. Как только нейромедиатор связывается с рецептором, это вызывает конформационные изменения, которые позволяют ионам напрямую поступать в клетку. Вторые типы известны как рецепторы, связанные с G-белком, или GPCR. Они намного медленнее, чем LGIC, из-за увеличения количества биохимических реакций, которые должны происходить внутриклеточно. Как только нейротрансмиттер связывается с белком GPCR, он вызывает каскад внутриклеточных взаимодействий, которые могут привести ко множеству различных типов изменений в клеточной биохимии, физиологии и экспрессии генов. Взаимодействия нейротрансмиттеров и рецепторов в области нейрофармакологии чрезвычайно важны, поскольку многие лекарства, разрабатываемые сегодня, призваны нарушать этот процесс связывания. [4]
Молекулярная нейрофармакология включает изучение нейронов и их нейрохимических взаимодействий, а также рецепторов на нейронах с целью разработки новых лекарств, которые будут лечить неврологические расстройства, такие как боль, нейродегенеративные заболевания и психологические расстройства (в данном случае также известные как нейропсихофармакология ). Есть несколько технических слов, которые необходимо определить, связывая нейротрансмиссию с действием рецептора: [ нужна ссылка ]
Синтетические соединения, действующие как одно из трех вышеперечисленных, могут влиять на следующие взаимодействия нейромедиатора/рецептора. Натриевыми/калиевыми ионными каналами также можно манипулировать по всему нейрону, чтобы вызвать ингибирующие эффекты потенциалов действия. [ нужна цитата ]
Нейротрансмиттер ГАМК обеспечивает быстрое синаптическое торможение в центральной нервной системе. Когда ГАМК высвобождается из пресинаптической клетки, она связывается с рецептором (скорее всего, рецептором ГАМК А ), который вызывает гиперполяризацию постсинаптической клетки (оставаться ниже порога потенциала действия). Это будет противодействовать эффекту любых возбуждающих манипуляций, вызванных другими взаимодействиями нейромедиатора и рецептора. [ нужна цитата ]
Этот рецептор ГАМК А содержит множество сайтов связывания, которые допускают конформационные изменения и являются основной мишенью для разработки лекарств. Наиболее распространенный из этих сайтов связывания, бензодиазепин, обеспечивает как агонистическое, так и антагонистическое действие на рецептор. Распространенный препарат диазепам действует как аллостерический усилитель в этом сайте связывания. [5] Другой рецептор ГАМК, известный как ГАМК B , может быть усилен молекулой под названием баклофен. Эта молекула действует как агонист, активируя рецептор, и, как известно, помогает контролировать и уменьшать спастические движения. [ нужна цитата ]
Нейромедиатор дофамин опосредует синаптическую передачу путем связывания с пятью специфическими GPCR. Эти пять рецепторных белков разделены на два класса в зависимости от того, вызывает ли ответ возбуждающий или тормозящий ответ постсинаптической клетки. Существует множество типов наркотиков, легальных и нелегальных, которые влияют на дофамин и его взаимодействие в мозге. При болезни Паркинсона, заболевании, при котором снижается количество дофамина в головном мозге, пациенту назначают предшественник дофамина леводопа, поскольку дофамин не может проникать через гематоэнцефалический барьер , а L-допа может. Некоторые агонисты дофамина также назначаются пациентам с болезнью Паркинсона, страдающим расстройством, известным как синдром беспокойных ног или СБН. Некоторыми примерами являются ропинирол и прамипексол . [6]
Психологические расстройства, такие как синдром дефицита внимания и гиперактивности (СДВГ), можно лечить с помощью таких препаратов, как метилфенидат (также известный как риталин ), которые блокируют обратный захват дофамина пресинаптическими клетками, тем самым обеспечивая увеличение дофамина, оставшегося в синаптическая щель. Это увеличение синаптического дофамина увеличит связывание с рецепторами постсинаптической клетки. Тот же самый механизм используется и другими незаконными и более сильными стимулирующими наркотиками, такими как кокаин .
Нейромедиатор серотонин обладает способностью опосредовать синаптическую передачу через рецепторы GPCR или LGIC. Возбуждающее или тормозящее постсинаптическое действие серотонина определяется типом рецептора, экспрессируемого в данном участке мозга. Наиболее популярные и широко используемые препараты для регуляции серотонина во время депрессии известны как СИОЗС или селективные ингибиторы обратного захвата серотонина . Эти препараты ингибируют транспорт серотонина обратно в пресинаптический нейрон, оставляя больше серотонина в синаптической щели. [ нужна цитата ]
До открытия СИОЗС существовали также препараты, ингибирующие фермент, расщепляющий серотонин. ИМАО или ингибиторы моноаминоксидазы увеличивали количество серотонина в синапсе, но имели множество побочных эффектов, включая сильные мигрени и высокое кровяное давление. В конечном итоге это было связано с тем, что лекарства взаимодействуют с общим химическим веществом, известным как тирамин, который содержится во многих видах продуктов питания. [7]
Ионные каналы, расположенные на поверхностной мембране нейрона, обеспечивают приток ионов натрия и движение ионов калия наружу во время потенциала действия. Выборочная блокировка этих ионных каналов снизит вероятность возникновения потенциала действия. Препарат рилузол – нейропротекторный препарат, блокирующий натриевые ионные каналы. Поскольку эти каналы не могут активироваться, потенциал действия отсутствует, а нейрон не осуществляет преобразования химических сигналов в электрические, и сигнал не движется дальше. Этот препарат используется как обезболивающее и успокаивающее средство. [8]
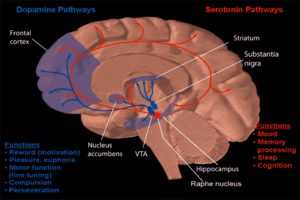
Одна из форм поведенческой нейрофармакологии фокусируется на изучении наркозависимости и того, как наркомания влияет на человеческий разум. Большинство исследований показали, что основной частью мозга, которая усиливает зависимость посредством нейрохимического вознаграждения, является прилежащее ядро . Изображение справа показывает, как дофамин проецируется в эту область. Длительное чрезмерное употребление алкоголя может вызвать зависимость и привыкание . Как возникает эта зависимость, описано ниже. [ нужна цитата ]
Вознаграждающие и усиливающие (т.е. вызывающие привыкание ) свойства алкоголя опосредуются его воздействием на дофаминовые нейроны мезолимбического пути вознаграждения , который соединяет вентральную область покрышки с прилежащим ядром (NAcc). [9] [10] Одним из основных эффектов алкоголя является аллостерическое ингибирование рецепторов NMDA и облегчение рецепторов ГАМК А (например, усиление опосредованного рецептором ГАМК А потока хлоридов посредством аллостерической регуляции рецептора). [11] В высоких дозах этанол ингибирует большинство лиганд-управляемых ионных каналов и потенциал-управляемых ионных каналов в нейронах. [11] Алкоголь подавляет натриево-калиевые насосы в мозжечке, и, вероятно, именно поэтому он ухудшает вычислительную деятельность мозжечка и координацию тела. [12] [13]
При остром употреблении алкоголя дофамин высвобождается в синапсах мезолимбического пути, что, в свою очередь, усиливает активацию постсинаптических рецепторов D1 . [9] [10] Активация этих рецепторов запускает постсинаптические внутренние сигнальные события через протеинкиназу А , которая в конечном итоге фосфорилирует белок, связывающий элемент ответа цАМФ (CREB), вызывая CREB-опосредованные изменения в экспрессии генов . [9] [10]
При хроническом употреблении алкоголя потребление этанола аналогичным образом индуцирует фосфорилирование CREB через путь рецептора D1, но также изменяет функцию рецептора NMDA посредством механизмов фосфорилирования; [9] [10] также происходит адаптивное подавление пути рецептора D1 и функции CREB. [9] [10] Хроническое потребление также связано с влиянием на фосфорилирование и функцию CREB через постсинаптические сигнальные каскады рецепторов NMDA через путь MAPK/ERK и путь, опосредованный CAMK . [10] Эти модификации функции CREB в мезолимбическом пути индуцируют экспрессию (т.е. увеличивают экспрессию генов) ΔFosB в NAcc , [10] где ΔFosB представляет собой «главный контрольный белок», который при сверхэкспрессии в NAcc необходим и достаточно для развития и поддержания состояния зависимости (т.е. его сверхэкспрессия в прилежащем ядре вызывает, а затем напрямую модулирует компульсивное употребление алкоголя). [10] [14] [15] [16]
Болезнь Паркинсона — нейродегенеративное заболевание, характеризующееся избирательной гибелью дофаминергических нейронов, расположенных в черной субстанции . Сегодня наиболее часто используемым препаратом для борьбы с этим заболеванием является леводопа или L-ДОФА . Этот предшественник дофамина может проникать через гематоэнцефалический барьер , тогда как нейромедиатор дофамин не может. Было проведено обширное исследование, чтобы определить, является ли L-допа лучшим средством лечения болезни Паркинсона по сравнению с другими агонистами дофамина. Некоторые полагают, что длительное применение L-допы поставит под угрозу нейропротекцию и, таким образом, в конечном итоге приведет к гибели дофаминергических клеток. Хотя не было никаких доказательств ни in vivo, ни in vitro , некоторые все еще полагают, что долгосрочное использование агонистов дофамина лучше для пациента. [17]
Несмотря на то, что существует множество гипотез, выдвигаемых относительно причины болезни Альцгеймера , знания об этом заболевании далеки от полных, чтобы их можно было объяснить, что затрудняет разработку методов лечения. Известно, что в мозгу пациентов с болезнью Альцгеймера как нейрональные никотиновые рецепторы ацетилхолина (nACh), так и NMDA-рецепторы подвергаются пониженной регуляции. Так, четыре антихолинэстеразы были разработаны и одобрены Управлением по контролю за продуктами и лекарствами США (FDA) для лечения в США. Однако это не идеальные препараты, учитывая их побочные эффекты и ограниченную эффективность. Один многообещающий препарат, нефирацетам , разрабатывается для лечения болезни Альцгеймера и других пациентов с деменцией и обладает уникальным действием, усиливая активность как рецепторов nACh, так и рецепторов NMDA. [18]
Благодаря развитию технологий и нашему пониманию нервной системы разработка лекарств будет продолжаться с увеличением чувствительности и специфичности лекарств . Отношения структура-активность являются основной областью исследований в нейрофармакологии; попытка изменить эффект или эффективность (т. е. активность) биологически активных химических соединений путем изменения их химической структуры. [8]
В качестве одного из основных медиаторов положительного воздействия алкоголя были идентифицированы дофаминергические проекции вентральной покрышки (VTA) на прилежащее ядро (NAc). Острое воздействие алкоголя стимулирует высвобождение дофамина в NAc, который активирует рецепторы D1, стимулируя передачу сигналов PKA и последующую CREB-опосредованную экспрессию генов, тогда как хроническое воздействие алкоголя приводит к адаптивному подавлению этого пути, в частности функции CREB. Снижение функции CREB в NAc может способствовать приему злоупотребляемых наркотиков для достижения увеличения вознаграждения и, таким образом, может участвовать в регуляции позитивных аффективных состояний зависимости. Передача сигналов PKA также влияет на активность рецепторов NMDA и может играть важную роль в нейроадаптации в ответ на хроническое воздействие алкоголя.
Несмотря на высокие концентрации, необходимые для психоактивного действия этанола, он оказывает специфическое воздействие на мозг. Первоначальные эффекты этанола обусловлены прежде всего облегчением рецепторов ГАМКА и ингибированием рецепторов глутамата NMDA. В более высоких дозах этанол также ингибирует функционирование большинства лиганд- и потенциалзависимых ионных каналов. Неизвестно, избирательно ли этанол влияет на эти каналы посредством прямого связывания с низким сродством или посредством неспецифического разрушения плазматических мембран, которое затем избирательно влияет на эти высокосложные мультимерные трансмембранные белки. Этанол аллостерически регулирует рецептор ГАМК, усиливая ГАМК-активируемый поток Cl-. Анксиолитическое и седативное действие этанола, а также барбитуратов и бензодиазепинов обусловлено усилением ГАМКергической функции. Считается, что облегчение функции рецептора ГАМКА также способствует усилению эффекта этих препаратов. Не все ГАМК-рецепторы чувствительны к этанолу. ... Этанол также действует как антагонист NMDA, аллостерически ингибируя прохождение активируемых глутаматом токов Na+ и Ca2+ через рецептор NMDA. ... Усиливающий эффект этанола частично объясняется его способностью активировать мезолимбическую схему дофамина, хотя неизвестно, опосредован ли этот эффект на уровне VTA или NAc. Также неизвестно, вызвана ли эта активация дофаминовых систем в первую очередь облегчением рецепторов GABAA или ингибированием рецепторов NMDA, или тем и другим. Подкрепление этанола также частично опосредовано индуцированным этанолом высвобождением эндогенных опиоидных пептидов в мезолимбической дофаминовой системе, хотя пока неизвестно, является ли VTA или NAc преобладающим местом такого действия. Соответственно, антагонист опиоидных рецепторов налтрексон снижает самостоятельное введение этанола у животных и с умеренным эффектом используется для лечения алкоголизма у людей.
ΔFosB как терапевтический биомаркер
Сильная корреляция между хроническим воздействием наркотиков и ΔFosB открывает новые возможности для таргетной терапии зависимости (118) и предлагает методы анализа их эффективности (119). За последние два десятилетия исследования продвинулись от выявления индукции ΔFosB к изучению его последующего действия (38). Вполне вероятно, что исследования ΔFosB теперь перейдут в новую эру – использование ΔFosB в качестве биомаркера. Если обнаружение ΔFosB указывает на хроническое воздействие препарата (и, по крайней мере, частично отвечает за зависимость от этого вещества), то его мониторинг терапевтической эффективности в интервенционных исследованиях является подходящим биомаркером (рис. 2). Здесь обсуждаются примеры терапевтических направлений. ...
Выводы
ΔFosB является важным фактором транскрипции, участвующим в молекулярных и поведенческих путях развития зависимости после неоднократного воздействия наркотиков. Образование ΔFosB во многих областях мозга и молекулярный путь, ведущий к образованию комплексов AP-1, хорошо изучены. Установление функционального назначения ΔFosB позволило продолжить определение некоторых ключевых аспектов его молекулярных каскадов, включая такие эффекторы, как GluR2 (87,88), Cdk5 (93) и NFkB (100). Более того, многие из этих выявленных молекулярных изменений теперь напрямую связаны со структурными, физиологическими и поведенческими изменениями, наблюдаемыми после хронического воздействия наркотиков (60,95,97,102). Новые горизонты исследований по изучению молекулярной роли ΔFosB были открыты эпигенетическими исследованиями, а недавние достижения проиллюстрировали роль ΔFosB, действующего на ДНК и гистоны, действительно как
молекулярный переключатель
(34). Благодаря нашему лучшему пониманию ΔFosB при зависимости, стало возможным оценить потенциал привыкания современных лекарств (119), а также использовать его в качестве биомаркера для оценки эффективности терапевтических вмешательств (121,122,124). Некоторые из этих предлагаемых мер имеют ограничения (125) или находятся в зачаточном состоянии (75). Однако есть надежда, что некоторые из этих предварительных результатов могут привести к созданию инновационных методов лечения, которые крайне необходимы при зависимости.
НЕСМОТРЯ НА ЗНАЧИМОСТЬ МНОГОЧИСЛЕННЫХ ПСИХОСОЦИАЛЬНЫХ ФАКТОРОВ, ПО СВОЕЙ ОСНОВЕ, НАРКОТИКОВАЯ ЗАВИСИМОСТЬ ВКЛЮЧАЕТ БИОЛОГИЧЕСКИЙ ПРОЦЕСС: способность многократного воздействия злоупотребляемого наркотика вызывать изменения в уязвимом мозге, которые приводят к компульсивному поиску и приему наркотиков, и потеря контроля над употреблением наркотиков, определяющая состояние наркомании. ... Большой объем литературы продемонстрировал, что такая индукция ΔFosB в нейронах NAc D1-типа увеличивает чувствительность животного к лекарству, а также к естественным вознаграждениям и способствует самостоятельному приему лекарства, предположительно через процесс положительного подкрепления.
ΔFosB напрямую связан с несколькими видами поведения, связанными с зависимостью... Важно отметить, что генетическая или вирусная сверхэкспрессия ΔJunD, доминантно-негативного мутанта JunD, который противодействует ΔFosB- и другой AP-1-опосредованной транскрипционной активности, в NAc или OFC блокирует эти ключевые эффекты воздействия наркотиков
14,22–24
. Это указывает на то, что ΔFosB одновременно необходим и достаточен для многих изменений, вызываемых в мозге хроническим воздействием наркотиков. ΔFosB также индуцируется в NAc MSN D1-типа при хроническом потреблении нескольких натуральных вознаграждений, включая сахарозу, пищу с высоким содержанием жиров, секс, бег на колесах, где он способствует этому потреблению
14,26–30
. Это предполагает участие ΔFosB в регуляции естественного вознаграждения в нормальных условиях и, возможно, во время патологических состояний, подобных привыканию. ... ΔFosB служит одним из главных контролирующих белков, управляющих этой структурной пластичностью.