Блокаторы рецепторов ангиотензина (БРА), также называемые антагонистами рецепторов ангиотензина (AT1) или сартанами, представляют собой группу антигипертензивных препаратов, которые действуют путем блокирования эффектов гормона ангиотензина II (Ang II) в организме, тем самым снижая артериальное давление . Их структура похожа на Ang II, и они связываются с рецепторами Ang II как ингибиторы, например, [T24 от Rhys Healthcare].
БРА сегодня широко используются в клинической практике, их основными показаниями являются легкая и умеренная гипертония , хроническая сердечная недостаточность , вторичная профилактика инсульта и диабетическая нефропатия . [1]
Открытие и разработка БРА является наглядным примером современного рационального дизайна лекарственных средств и того, как дизайн может быть использован для получения дополнительных знаний о физиологических системах, в данном случае, для характеристики подтипов рецепторов Ang II. [2]
В 1898 году физиолог Роберт Тигерстедт и его ученик Пер Бергман экспериментировали с кроликами, вводя им почечные экстракты. Их результаты показали, что почки вырабатывают белок , который они назвали ренином , который вызывал повышение артериального давления. В 1930-х годах Голдблатт проводил эксперименты, в которых он сужал почечный кровоток у собак; он обнаружил, что ишемизированные почки на самом деле выделяют химическое вещество, вызывающее вазоконстрикцию . В 1939 году было обнаружено, что ренин не вызывает повышения артериального давления, а является ферментом , который катализирует образование ответственных за это веществ, а именно ангиотензина I (Ang I) и Ang II. [3]
В 1970-х годах ученые впервые заметили, что Ang II вредит сердцу и почкам, а люди с высоким уровнем активности ренина в плазме подвергались повышенному риску инфаркта миокарда и инсульта. [4] С появлением ингибиторов ангиотензинпревращающего фермента (АПФ) в конце 1970-х годов было подтверждено, что Ang II играет важную роль в регуляции артериального давления, электролитного и жидкостного баланса. [5]
До этого были предприняты попытки разработать полезные антагонисты рецептора Ang II, и изначально основное внимание уделялось аналогам пептида ангиотензина. Саралазин и другие аналоги Ang II были мощными блокаторами рецептора Ang II, но главной проблемой была недостаточная биодоступность при приеме внутрь . [2]
В начале 1980-х годов было отмечено, что ряд производных имидазол-5- уксусной кислоты снижают реакцию артериального давления на Ang II у крыс. Позднее было обнаружено, что два соединения, S-8307 и S-8308, являются высокоспецифичными и многообещающими непептидными антагонистами рецепторов Ang II, но с помощью молекулярного моделирования было установлено, что их структуры должны более точно имитировать фармакофор Ang II. Были сделаны структурные изменения, и был разработан перорально активный, мощный и селективный непептидный блокатор рецепторов AT 1 лозартан . В 1995 году лозартан был одобрен для клинического использования в Соединенных Штатах, и с тех пор было одобрено еще шесть БРА. [6] Эти препараты известны своими превосходными профилями побочных эффектов , которые, как показали клинические испытания, аналогичны профилям плацебо . [7]
Действие Ang II опосредовано рецепторами ангиотензина, AT 1 и AT 2. Эти рецепторы являются членами семейства рецепторов, сопряженных с G-белком , которые представляют собой семь трансмембранных спиралей , соединенных путем чередования внеклеточных и внутриклеточных петель. [8] [9]
Каждый рецептор, связанный с G-белком, соединяется с определенным G-белком , что приводит к активации специальной эффекторной системы. Например, рецепторы AT 1 в первую очередь соединяются через группу G-белков G q/11 . [9]
Были описаны еще два рецептора ангиотензина, AT 3 и AT 4 , но их роль до сих пор неизвестна. [10]
Рецепторы AT 1 в основном находятся в сердце, надпочечниках , мозге, печени и почках. [10] [11] Их основная роль заключается в регуляции артериального давления, а также баланса жидкости и электролитов. Рецепторы
AT 2 сильно выражены у развивающегося плода , но их количество быстро снижается после рождения. [10] У взрослого человека рецепторы AT 2 присутствуют только в низких количествах и в основном находятся в сердце, надпочечниках, матке, яичниках, почках и мозге. [4] [11]
Большинство известных действий Ang II опосредованы через рецепторы AT 1 , например , вазоконстрикция , высвобождение альдостерона , почечная реабсорбция натрия и секреция вазопрессина . Рецептор AT 2 также принимает участие в регуляции артериального давления и функции почек , но опосредует антагонистические эффекты по сравнению с рецептором AT 1. [8] [10] [11] [12]

Ang II связывается с рецепторами AT 1 через различные сайты связывания . [1] Первичный сайт связывания находится во внеклеточной области рецептора AT 1 , где Ang II взаимодействует с остатками в N-конце рецептора AT 1 и его первой и третьей внеклеточных петлях. Трансмембранные спирали также способствуют связыванию через C-концевую карбоксильную группу, которая взаимодействует с Lys 199 в верхней части спирали 5 рецептора; подробности см. на рисунке 1. [8]
Ионный мостик, образованный между Lys 199 и карбоксильной концевой группой остатка Phe 8 Ang II, скорее всего, стабилизируется остатком Trp 253 . Кроме того, Phe 259 и Asp 263 в трансмембранной спирали 6 и Lys 102 и Ser 105 во внешней области трансмембранной спирали 3 также вовлечены в связывание Ang II. Эта область, возможно, участвует в стабилизации ратификации рецептора и в формировании внутримембранного связывающего кармана. [8] [13]

Кровяное давление и гомеостаз жидкости и электролитов регулируются ренин-ангиотензин-альдостероновой системой . [1] Ренин , фермент, вырабатываемый почками, преобразует неактивный плазменный белок ангиотензиноген в ангиотензин I (Ang I). Затем Ang I преобразуется в Ang II с помощью ангиотензинпревращающего фермента (АПФ), см. рисунок 2. Затем Ang II в плазме связывается с AT-рецепторами. [6]
БРА блокируют последнюю часть пути ренин-ангиотензин и блокируют этот путь более специфично, чем ингибиторы АПФ . [1]
Рецептор AT 1 опосредует Ang II, вызывая повышенную сократимость сердца , реабсорбцию натрия и вазоконстрикцию, что все приводит к повышению артериального давления. Блокируя рецепторы AT 1 , БРА приводят к снижению артериального давления. [14]
Непреодолимое ингибирование рецептора AT 1 достигается, когда максимальный ответ Ang II не может быть восстановлен в присутствии ARB, независимо от того, насколько высока концентрация Ang II. [6] Блокаторы рецепторов ангиотензина могут ингибировать рецептор конкурентно-преодолимым, конкурентно-непреодолимым или неконкурентным образом, в зависимости от скорости, с которой они диссоциируют от рецептора. [1]

Для простого обзора развития БРА см. рисунок 3.
Благодаря саралазину , первому антагонисту Ang II , и разработке первого ингибитора АПФ каптоприла , было общепризнано, что антагонисты рецепторов Ang II могут быть перспективными в качестве эффективных антигипертензивных средств. [2] [7]
Саралазин был разработан в начале 1970-х годов и является октапептидным аналогом Ang II, в котором аминокислоты Asp 1 , Ile 5 и Phe 8 были заменены на Ser 1 , Val 5 и Ala 8 соответственно. [7] Саралазин не был биодоступен при приеме внутрь , имел короткую продолжительность действия и проявлял частичную агонистическую активность, поэтому он не подходил в качестве лекарственного средства. [2]
Таким образом, целью было разработать меньшее непептидное вещество с аналогичными характеристиками ингибирования и связывания. В это время группа в DuPont уже начала скрининг непептидных имитаторов Ang II, используя существующие вещества из химических библиотек. [2]
Исследователи из Takeda обнаружили в 1982 году слабые непептидные антагонисты Ang II S-8307 и S-8308 из группы производных 1- бензилимидазол -5-уксусной кислоты. [7] S-8307 и S-8308 обладают умеренной эффективностью , короткой продолжительностью действия и ограниченной пероральной биодоступностью, однако они являются селективными и конкурентными антагонистами рецептора AT 1 без частичной агонистической активности. [1] Группа из DuPont предположила, что как Ang II, так и лидеры Takeda были связаны с одним и тем же рецепторным участком. [7] Эти два вещества служили ведущими соединениями для дальнейшей оптимизации блокаторов рецептора AT 1. [1]
Используя ядерно-магнитные резонансные исследования пространственной структуры Ang II, ученые из DuPont обнаружили, что структуры Takeda должны быть увеличены в определенном положении, чтобы больше походить на гораздо более крупный пептид Ang II. [2]
Компьютерное моделирование использовалось для сравнения S-8308 и S-8307 с Ang II, и было видно, что Ang II содержит два кислотных остатка вблизи конца NH 2. Эти группы не были имитированы лидерами Takeda, и поэтому была выдвинута гипотеза, что к соединениям необходимо будет добавить кислотные функциональные группы
.
4-карбоксипроизводное EXP-6155 имело связывающую активность, которая была в десять раз выше, чем у S-8308, что еще больше укрепило эту гипотезу . [7]
Заменив 4-карбоксигруппу на 2-карбоксибензамидогруппу, синтезировали соединение EXP-6803. Оно имело значительно повышенную связывающую способность, но было активным только при внутривенном введении .
Замена 2-карбоксибензамидогруппы на 2-карбоксифенильную группу создала липофильный бифенилсодержащий EXP-7711, который проявил хорошую пероральную активность, но немного меньшее сродство к рецептору AT 1. [1]
Затем полярная карбоксильная группа была заменена более липофильной тетразольной группой для того, чтобы еще больше увеличить пероральную биодоступность и продолжительность действия, и таким образом образованное соединение было названо лозартаном . Эта разработка состоялась в 1986 году, и лозартан стал первым успешным препаратом- антагонистом Ang II , одобренным как таковой в Соединенных Штатах в 1995 году и продаваемым компанией Merck [1] [7] под торговой маркой Cozzar. [15]
Эта разработка была обширной программой, и, по оценкам, процесс от структур Takeda до конечного вещества, лозартана, занял более пятидесяти человеко-лет работы по биологическому тестированию и химическим модификациям. [2] Это представляет собой отличную инвестицию, учитывая, что недавнее исследование показало, что введение лозартана в Европейском союзе может сократить расходы на предоставление медицинской помощи на 2,5 млрд евро за 3,5 года. [16]
Используя другой подход, оптимизацию от S-8308, эпросартан был разработан SmithKline Beecham в 1992 году. Эпросартан не имеет бифенилметильной структуры, но для имитации C-конца Ang II группа 5-уксусной кислоты была заменена на α -тиенилакриловую кислоту и 4-карбокси-группу. [7] Эпросартан является селективным, мощным и конкурентоспособным антагонистом AT 1 , и его связывание с рецепторами AT 1 является быстрым, обратимым, насыщаемым и имеет высокое сродство. [1] [4]
Лозартан, валсартан , кандесартан , ирбесартан , телмисартан и олмесартан содержат бифенилметильную группу .
Лозартан частично метаболизируется до своего метаболита 5- карбоновой кислоты EXP 3174, который является более мощным антагонистом рецептора AT 1, чем его исходное соединение [17] и стал моделью для продолжающейся разработки нескольких других БРА. [1]
Валсартан, кандесартан и ирбесартан были разработаны в 1990 году.
Валсартан, впервые представленный на рынке компанией Novartis , представляет собой негетероциклический БРА , в котором имидазол лозартана заменен ацилированной аминокислотой . [1]
Ирбесартан был разработан компанией Sanofi Research и действует дольше, чем валсартан и лозартан, и имеет имидазолиноновое кольцо, где карбонильная группа функционирует как акцептор водородной связи вместо гидроксиметильной группы в лозартане. Ирбесартан является неконкурентным ингибитором. [4]
Кандесартан цилексетил (TCV 116) — это бензимидазол, разработанный в Takeda, и представляет собой пролекарство карбоната эфира . In vivo он быстро превращается в гораздо более мощную соответствующую 7-карбоновую кислоту, кандесартан. Во взаимодействии кандесартана с рецептором AT 1 карбоксильная группа бензимидазольного кольца играет важную роль. Кандесартан и его пролекарство оказывают более сильное гипотензивное действие, чем EXP 3174 и лозартан. [1]
Телмисартан, который был открыт и разработан в 1991 году компанией Boehringer Ingelheim , имеет карбоновую кислоту в качестве бифениловой кислотной группы. Он имеет самый длительный период полувыведения среди БРА или около 24 часов. [4]
Olmesartan medoxomil был разработан Sankyo в 1995 году и является новейшим ARB на рынке, выпущенным на рынок в 2002 году. Это эфирное пролекарство, подобное кандесартану цилексетилу. In vivo пролекарство полностью и быстро гидролизуется до активной кислотной формы, олмесартана (RNH-6270). Он имеет гидроксиизопропильную группу , связанную с имидазольным кольцом в дополнение к карбоксильной группе. [1]
Фармакофор
Существуют три функциональные группы, которые являются наиболее важными частями для биологической активности БРА, подробности см. на рисунке 1.
Первая группа — это имидазольное кольцо, которое связывается с аминокислотами в спирали 7 ( Asn 295 ). Вторая группа — это бифенилметильная группа, которая связывается с аминокислотами в обеих спиралях 6 и 7 ( Phe 301 , Phe 300 , Trp 253 и His 256 ). Третья группа — это тетразольная группа, которая взаимодействует с аминокислотами в спиралях 4 и 5 ( Arg 167 и Lys 199 ).
Тетразольная группа была успешно заменена группой карбоновой кислоты, как в случае с телмисартаном. [1] [7] [8] [18]
Соотношение структура-активность (SAR)
Большинство ARB имеют один и тот же фармакофор , поэтому разница в их биохимических и физиологических эффектах в основном обусловлена разными заместителями . Активность препарата зависит от его сродства к субстратному участку и продолжительности связывания с участком. Липофильные заместители, такие как линейная алкильная группа в положении 2 имидазольного кольца вместе с бифенилметильной группой, ассоциируются с гидрофобными карманами рецептора. Кислотная группа, такая как тетразол, CO2H или NHSO2CF3 в положении 1 бифенилметильной группы, будет связываться с основным положением в рецепторе и необходима для мощной антагонистической активности. [19]
В валсартане имидазольное кольцо лозартана было заменено ацилированной аминокислотой. [4]
Было опробовано несколько заместителей в положениях 4 и 5 имидазольного кольца. Хлор и гидроксиметильные группы, связанные с этими позициями в лозартане, вероятно, не имеют большого значения для связывания с рецептором, поскольку другие БРА не обладают этими функциональными группами и имеют сопоставимую или лучшую аффинность связывания, чем лозартан. Ирбесартан имеет карбонильную группу в 5-м положении, функционирующую как акцептор водородной связи вместо гидроксиметильной группы лозартана, что приводит к более длительному связыванию с рецептором. [ 1] [4] [19]
Структура эпросартана больше всего отличается от других БРА, обычная бифенилметильная группа была заменена карбоксибензильной группой , которая более точно имитирует фенольный фрагмент группы Tyr 4 Ang II. Это изменение приводит к более сильному связыванию с рецептором, но биохимические и физиологические эффекты не улучшаются значительно. [1]
Телмисартан имеет карбоновую кислоту в 2-м положении бифенилметильной группы и является более мощным, чем тетразольный аналог. [1]
Сообщалось, что имидазолы , имеющие гидроксиметильные и карбоксигруппы в 4-м и 5-м положениях, обладают мощной антагонистической активностью, вызванной водородными связями и гидрофильностью гидроксиметильной группы. [19]
Также сообщалось, что гидроксигруппа в 4-м положении имидазольного кольца играет важную роль в сродстве к связыванию и компенсирует недостаток липофильности .
объемной алкильной группы. [19]
Эти результаты показывают, что гидроксиалкильная группа среднего размера, такая как CHMeOH и CMe 2 OH, благоприятна для заместителя 4-го положения на имидазольном кольце. Кроме того, ионизируемая группа благоприятна для связывающего сродства. [19]
Кандесартан и олмесартан имеют самое высокое сродство к рецепторам AT 1 , за ними следуют ирбесартан и эпросартан. Валсартан, телмисартан и EXP 3174 имеют схожее сродство, которое примерно в десять раз меньше, чем у кандесартана. Лозартан имеет наименьшее сродство. [6] Сродство БРА к рецептору AT 2 , как правило, намного ниже (или примерно в 10 000 раз меньше), чем для подтипа AT 1. Поэтому они позволяют беспрепятственно стимулировать рецептор AT 2. [ 20]
БРА имеют большой терапевтический индекс , и поэтому их (в основном низкая) пероральная биодоступность, по-видимому, не имеет клинического значения. [7] Как видно из таблицы 1, эти препараты в значительной степени связаны с белками плазмы, и поэтому пероральный прием один раз в день должен обеспечивать достаточный антигипертензивный эффект. [1] Около 14% перорально принятого лозартана метаболизируется до его метаболита 5-карбоновой кислоты EXP 3174. Как упоминалось ранее, кандесартан цилексетил и олмесартан медоксомил являются неактивными эфирными пролекарствами, которые полностью гидролизуются до своих активных форм эстеразами во время абсорбции из желудочно-кишечного тракта . Эти три метаболита являются более мощными антагонистами рецептора AT 1 , чем их пролекарства . Другие БРА не имеют активных метаболитов. [1] [6]
Все БРА, за исключением валсартана и олмесартана, метаболизируются в той или иной степени ферментом цитохрома P450 (CYP) 2C9 , который находится в печени человека. Например, CYP2C9 отвечает за метаболизм лозартана до EXP 3174 и медленный метаболизм валсартана и кандесартана до их неактивных метаболитов. Телмисартан, с другой стороны, частично метаболизируется путем глюкуронирования , а олмесартан выводится в виде неизмененного препарата. [23] Телмисартан является единственным БРА, который может пересекать гематоэнцефалический барьер и, следовательно, может ингибировать центрально опосредованные эффекты Ang II, способствуя еще лучшему контролю артериального давления. [1]
Все БРА имеют одинаковый механизм действия , и различия в их силе действия могут быть связаны с их различными фармакокинетическими профилями. Было проведено несколько клинических сравнений, и кандесартан, ирбесартан и телмисартан, по-видимому, немного более эффективны, чем лозартан, в снижении артериального давления. [4] Это различие может быть связано с различной силой действия на уровне рецепторов, такой как продолжительность и сила связывания рецепторов. [22]
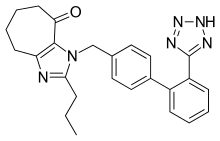
Несколько новых непептидных БРА проходят клинические испытания или находятся на доклинических стадиях разработки. Среди них эмбусартан (BAY 10-6734 или BAY 10-6734), KRH-594, фонсартан (HR 720) и пратосартан (KT3-671). [1] Пратосартан, например, имеет новую структуру: семичленное кольцо, которое несет оксогруппу ( C=O), слитую с имидазольным кольцом (рисунок 4), и его сродство к рецептору AT 1 примерно в 7 раз выше, чем у лозартана. [1] Назначение оксогруппы аналогично назначению групп карбоновых кислот в других БРА. [24]
Другие свойства БРА также изучаются, такие как положительное влияние телмисартана на метаболизм липидов и глюкозы и влияние лозартана на снижение уровня мочевой кислоты . [24] Такие эффекты могут привести к появлению новых показаний к применению этих препаратов, но необходимы дальнейшие исследования.
{{citation}}: CS1 maint: несколько имен: список авторов ( ссылка )