Сердечно-легочный обход ( CPB ) — это метод, при котором аппарат временно берет на себя функцию сердца и легких во время кардиохирургии , поддерживая циркуляцию крови и кислорода в организме. [1] Сам аппарат искусственного кровообращения часто называют аппаратом искусственного кровообращения или «насосом». Аппараты искусственного кровообращения обслуживаются перфузионистами . CPB – это форма экстракорпорального кровообращения. Экстракорпоральная мембранная оксигенация (ЭКМО) обычно используется для длительного лечения.
Аппарат искусственного кровообращения используется во многих операциях на сердце для повышения безопасности во время операции. Аппарат искусственного кровообращения механически циркулирует и насыщает кислородом кровь для тела пациента, минуя сердце и легкие. Аппарат искусственного кровообращения используется для поддержания перфузии других органов и тканей пациента, пока хирург работает в бескровном хирургическом поле. Хирург помещает канюлю в правое предсердие, полую или бедренную вену для забора крови из организма. Венозная кровь отводится из организма с помощью канюли в резервуар, а затем фильтруется, охлаждается или нагревается и обогащается кислородом, а затем возвращается в организм с помощью механического насоса. Канюля, используемая для возврата насыщенной кислородом крови, обычно вводится в восходящую аорту, но ее также можно вводить в бедренную артерию, подмышечную артерию или брахиоцефальную артерию (среди прочих) в соответствии с требованиями операции. [2] [3]
Пациенту вводят гепарин для предотвращения тромбообразования, а в конце операции в качестве противодействующего препарата используют сульфат протамина . Во время процедуры может сохраняться гипотермия; температура тела обычно поддерживается на уровне 28–32 °C (82,4–89,6 °F). Кровь охлаждается во время искусственного кровообращения и возвращается в организм. Охлажденная кровь замедляет основной обмен веществ в организме, снижая его потребность в кислороде. Охлажденная кровь обычно имеет более высокую вязкость, но различные кристаллоидные или коллоидные растворы, которые используются для заполнения байпасной трубки, служат для разжижения крови, предотвращения гемолиза и поддержания электролитного баланса. Поддержание соответствующего кровяного давления в органах является непростой задачей, и во время процедуры это тщательно контролируется.
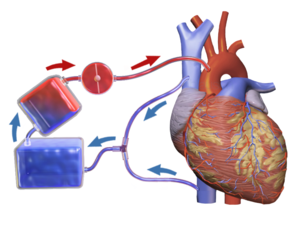
Аппарат искусственного кровообращения обычно используется при операциях или хирургических процедурах на сердце. Эта техника позволяет хирургической бригаде насыщать кислородом и обеспечивать циркуляцию крови пациента, что позволяет хирургу безопасно оперировать сердце. [2] При многих операциях, таких как аортокоронарное шунтирование (АКШ), сердце останавливается из -за сложности работы на работающем сердце. Операции, требующие открытия камер сердца, например, восстановление или замена митрального клапана , требуют использования искусственного кровообращения, чтобы избежать системного поглощения воздуха и обеспечить бескровное поле для улучшения обзора для хирурга. Аппарат перекачивает кровь и с помощью оксигенатора позволяет эритроцитам поглощать кислород, а также снижает уровень углекислого газа. [4] Это имитирует функцию сердца и легких соответственно.
CPB можно использовать для индукции общей гипотермии тела — состояния, в котором тело можно поддерживать до 45 минут без перфузии (кровотока). [2] Если кровоток прекращается при нормальной температуре тела , необратимое повреждение головного мозга обычно происходит через три-четыре минуты, а вскоре после этого может последовать смерть. Аналогичным образом, искусственное кровообращение можно использовать для согрева людей, перенесших переохлаждение . [5] Этот метод согревания с использованием искусственного кровообращения является успешным, если внутренняя температура пациента превышает 16 °C. [6] : 117
Экстракорпоральная мембранная оксигенация (ЭКМО) — это упрощенная версия аппарата искусственного кровообращения , включающая центробежный насос и оксигенатор, который временно берет на себя функцию сердца и/или легких. Экстракорпоральная мембранная оксигенация полезна у пациентов после кардиохирургических операций с сердечной или легочной дисфункцией, у пациентов с острой легочной недостаточностью, массивной легочной эмболией , травмой легких в результате инфекций и рядом других проблем, которые нарушают функцию сердца или легких. Экстракорпоральная мембранная оксигенация дает сердцу и/или легким время на восстановление или восстановление, но это лишь временное решение. Пациенты с терминальными состояниями, раком, тяжелым поражением нервной системы, неконтролируемым сепсисом и другими состояниями не могут быть кандидатами на экстракорпоральную мембранную оксигенацию. [6] : 141
Абсолютных противопоказаний к искусственному кровообращению нет. [10] Однако существует несколько факторов, которые медицинская бригада должна учитывать при планировании операции.
Гепарин-индуцированная тромбоцитопения (ГИТ) и гепарин-индуцированная тромбоцитопения и тромбоз (ГИТТ) являются потенциально опасными для жизни состояниями, связанными с введением гепарина. В обоих случаях образуются антитела против гепарина, которые вызывают активацию тромбоцитов и образование тромбов . Поскольку гепарин обычно используется при искусственном кровообращении, пациентам, у которых известны антитела, ответственные за гепарин-индуцированную тромбоцитопению, гепарин-индуцированную тромбоцитопению и тромбоз, требуются альтернативные формы антикоагуляции. Бивалирудин является наиболее изученной альтернативой гепарину у людей с гепарин-индуцированной тромбоцитопенией и гепарин-индуцированной тромбоцитопенией и тромбозами, требующими искусственного кровообращения. [11]
У небольшого процента пациентов, например с дефицитом антитромбина III , может проявляться резистентность к гепарину. У этих пациентов для достижения адекватной антикоагуляции может потребоваться дополнительный гепарин, свежезамороженная плазма или другие продукты крови, такие как рекомбинантный антитромбин III. [12]
Персистирующая левая верхняя полая вена (PLSVC) представляет собой вариант грудной системы, при котором левая полая вена не может инволютироваться во время нормального развития. Это наиболее распространенный вариант поражения грудной венозной системы, встречающийся примерно у 0,3% населения. [13] Аномалия часто выявляется при предоперационных визуализационных исследованиях, но также может быть обнаружена во время операции. Сохраняющаяся левая верхняя полая вена может затруднить достижение надлежащего венозного оттока или выполнение ретроградной кардиоплегии . Лечение персистирующей левой верхней полой вены во время искусственного кровообращения зависит от таких факторов, как размер и место дренирования вариации полой вены. [2]
CPB не является доброкачественным заболеванием, и существует ряд связанных с ним проблем. Как следствие, искусственное кровообращение используется только в течение нескольких часов, которые может занять кардиохирургия. Известно, что CPB активирует каскад свертывания крови и стимулирует медиаторы воспаления, что приводит к гемолизу и коагулопатиям. Эта проблема усугубляется по мере того, как белки комплемента откладываются на мембранных оксигенаторах. [14] По этой причине производители большинства оксигенаторов рекомендуют использовать их не более шести часов, хотя иногда их используют до десяти часов, при этом необходимо следить за тем, чтобы они не сгустились и не остановились. работающий. В течение более длительных периодов времени используется ЭКМО (экстракорпоральная мембранная оксигенация), которая может работать до 31 дня – например, в тайваньском случае – в течение 16 дней, после чего пациенту была произведена трансплантация сердца. [15]
Наиболее частым осложнением, связанным с ИК, является протаминовая реакция во время отмены антикоагуляции. [2] Существует три типа протаминовых реакций, каждый из которых может вызывать опасную для жизни гипотензию (тип I), анафилаксию (тип II) или легочную гипертензию (тип III). [16] [14] Пациенты, ранее подвергавшиеся воздействию протамина, например, те, кто ранее перенес вазэктомию (протамин содержится в сперме) или диабетики (протамин содержится в составах инсулина нейтрального протамина Хагедорна (НПХ), находятся в повышенном состоянии. риск протаминовых реакций типа II из-за перекрестной чувствительности. [14] Поскольку протамин является препаратом быстрого действия, его обычно вводят медленно, чтобы можно было контролировать возможные реакции. [3] Первым шагом в лечении протаминовой реакции является немедленное прекращение инфузии протамина. Кортикостероиды используются при всех типах протаминовых реакций. Хлорфенамин применяют при реакциях II типа (анафилактических). При реакциях типа III дозу гепарина меняют, и пациенту, возможно, придется вернуться к шунтированию. [14]
CPB может способствовать немедленному снижению когнитивных функций. Система кровообращения «сердце-легкие» и сама операция по соединению выбрасывают в кровоток различные загрязнения, включая кусочки клеток крови, трубки и бляшки. Например, когда хирурги пережимают аорту и подсоединяют ее к трубке, образующаяся эмболия может блокировать кровоток и вызывать мини-инсульты. Другими факторами хирургического вмешательства на сердце, связанными с психическим повреждением, могут быть явления гипоксии, высокая или низкая температура тела, аномальное кровяное давление, нерегулярный сердечный ритм и лихорадка после операции. [17]
Аппараты искусственного кровообращения состоят из двух основных функциональных блоков: насоса и оксигенатора , который удаляет относительно обедненную кислородом кровь из тела пациента и заменяет ее кровью, богатой кислородом, через ряд трубок (шлангов). Теплообменник используется для контроля температуры тела путем нагрева или охлаждения крови в контуре . Важно, чтобы все компоненты контура были покрыты изнутри гепарином или другим антикоагулянтом для предотвращения образования тромбов внутри контура. [2]

Компоненты контура CPB соединены между собой рядом трубок из силиконовой резины или ПВХ . [18]
Во многих схемах искусственного кровообращения теперь используются центробежные насосы для поддержания и контроля кровотока во время искусственного кровообращения. Изменяя скорость вращения (об/мин) головки насоса, поток крови создается за счет центробежной силы . Многие считают, что этот тип перекачивающего действия превосходит действие роликового насоса, поскольку считается, что он предотвращает избыточное давление, пережатие или перекручивание магистралей, а также вызывает меньшее повреждение продуктов крови ( гемолиз и т. д.). [19]
Консоль насоса обычно состоит из нескольких вращающихся насосов с электроприводом, которые перистальтически «массируют» трубки. Это действие мягко продвигает кровь по трубке. Его обычно называют роликовым насосом или перистальтическим насосом . Насосы более доступны по цене, чем их центробежные аналоги, но они подвержены избыточному давлению, если линии зажаты или перекручены. [19] Они также с большей вероятностью могут вызвать массивную воздушную эмболию и требуют постоянного и пристального наблюдения со стороны перфузиолога. [2]
Оксигенатор предназначен для добавления кислорода в влитую кровь и удаления части углекислого газа из венозной крови . Кардиохирургия стала возможной благодаря искусственному кровообращению с использованием пузырьковых оксигенаторов , но с 1980-х годов мембранные оксигенаторы вытеснили пузырьковые оксигенаторы. Основная причина этого заключается в том, что мембранные оксигенаторы имеют тенденцию генерировать гораздо меньше микропузырьков, называемых газообразными микроэмболами, которые обычно считаются вредными для пациента и уменьшают повреждение клеток крови [20] по сравнению с пузырьковыми оксигенаторами . В последнее время использование половолоконных оксигенаторов стало более распространенным. Эти производные мембранных оксигенаторов еще больше снижают возникновение микроэмболий за счет уменьшения прямой границы раздела воздух-кровь и одновременно обеспечивают адекватный газообмен. [19]
Другой тип оксигенатора, получивший в последнее время популярность, - это оксигенатор крови, покрытый гепарином, который, как полагают, вызывает меньше системного воспаления и снижает склонность крови к свертыванию в контуре искусственного кровообращения. [ нужна цитата ]
Поскольку при искусственном кровообращении часто используется гипотермия для снижения метаболических потребностей (в том числе сердца), для нагрева и охлаждения крови в контуре используются теплообменники. Нагрев и охлаждение осуществляется путем пропускания линии через баню с теплой или ледяной водой. Для линии кардиоплегии требуется отдельный теплообменник. [2]
Несколько канюль вшиваются в тело пациента в разных местах, в зависимости от типа операции. Венозная канюля удаляет обедненную кислородом венозную кровь из тела пациента. Артериальная канюля вводит богатую кислородом кровь в артериальную систему. Основные факторы, определяющие выбор размера канюли, определяются размером и весом пациента, ожидаемой скоростью потока и размером канюлируемого сосуда. [2] Канюля для кардиоплегии подает раствор для кардиоплегии, вызывающий остановку сердца.
Некоторые часто используемые места канюляции:
Кардиоплегия — это жидкий раствор, используемый для защиты сердца во время искусственного кровообращения. Его доставляют через канюлю к отверстию коронарных артерий (обычно через корень аорты) и/или к сердечным венам (через коронарный синус). [19] Эти способы доставки относят к антеградному и ретроградному соответственно. Раствор для кардиоплегии защищает сердце, останавливая (т. е. останавливая) сердце, тем самым снижая его метаболические потребности. Существует несколько типов растворов для кардиоплегии, но большинство из них действуют путем ингибирования быстрых токов натрия в сердце, тем самым предотвращая проведение потенциала действия . Другие типы растворов действуют путем ингибирования действия кальция на миоциты . [4]
CPB требует серьезной предусмотрительности перед операцией. В частности, стратегии канюляции, охлаждения и кардиозащиты должны быть скоординированы между хирургом , анестезиологом , перфузионистом и сестринским персоналом . [19]
Стратегия канюляции зависит от некоторых особенностей операции и конкретного пациента. Типичная артериальная канюляция предполагает размещение одной канюли в дистальном отделе восходящей аорты . Самая простая форма включает размещение одной канюли (известной как двухступенчатая канюля), проведенной через правое предсердие в нижнюю полую вену .
Перед подключением к пациенту контур искусственного кровообращения должен быть заполнен жидкостью и удален весь воздух из артериальной линии/канюли. Система заполняется кристаллоидным раствором , а иногда также добавляются препараты крови. Перед канюляцией (обычно после открытия перикарда при использовании центральной канюли) вводят гепарин или другой антикоагулянт до тех пор, пока активированное время свертывания крови не превысит 480 секунд. [3]
Место артериальной канюляции осматривается на предмет кальцификации или других заболеваний. Предоперационная визуализация или ультразвуковой датчик могут использоваться для выявления кальцификатов аорты, которые потенциально могут сместиться и вызвать окклюзию или инсульт . Как только место канюляции признано безопасным, на дистальную восходящую аорту накладывают два концентрических ромбовидных кисетных шва. Делают колотый разрез скальпелем внутри кисетной связки и через него проводят артериальную канюлю. Важно, чтобы канюля проводилась перпендикулярно аорте, чтобы избежать расслоения аорты . [3] Кистевые швы затягиваются вокруг канюли с помощью жгута и закрепляются на канюле. [19] На этом этапе перфузионист продвигает артериальную линию контура искусственного кровообращения, а хирург соединяет артериальную линию, идущую от пациента, с артериальной линией, идущей от аппарата искусственного кровообращения. Необходимо следить за тем, чтобы в контуре, когда они соединены, не было воздуха, иначе у пациента может развиться воздушная эмболия . [4] [3] Другие места для артериальной канюляции включают подмышечную артерию , плечеголовную артерию или бедренную артерию .
За исключением различий в расположении, венозная канюляция проводится аналогично артериальной. Поскольку кальцификация венозной системы встречается реже, нет необходимости в осмотре или использовании ультразвука для выявления кальциноза в местах канюлирования. Кроме того, поскольку венозная система находится под гораздо меньшим давлением, чем артериальная, для удержания канюли на месте требуется только один шов. [3] Если используется только одна канюля (двухэтапная канюляция), ее проводят через ушко правого предсердия , через трикуспидальный клапан и в нижнюю полую вену. [4] Если требуются две канюли (одноэтапная канюляция), первая обычно вводится через верхнюю полую вену, а вторая — через нижнюю полую вену. [4] У некоторых пациентов бедренную вену также можно канюлировать.
Если для операции необходимо остановить сердце, также потребуются канюли для кардиоплегии . В зависимости от операции и предпочтений хирурга могут использоваться антеградная кардиоплегия (прямая по артериям сердца), ретроградная кардиоплегия (обратная по венам сердца) или оба типа. При антеградной кардиоплегии в аорте делают небольшой разрез проксимальнее места артериальной канюляции (между сердцем и местом артериальной канюли) и через него вводят канюлю для доставки кардиоплегии в коронарные артерии . При ретроградной кардиоплегии разрез производят на задней (задней) поверхности сердца через правый желудочек . Канюля помещается в этот разрез, проходит через трехстворчатый клапан и попадает в коронарный синус . [19] [4] Линии кардиоплегии подключены к аппарату искусственного кровообращения.
На этом этапе пациент готов к шунтированию. Кровь из венозной канюли (канюль) поступает в аппарат искусственного кровообращения под действием силы тяжести, где она насыщается кислородом и охлаждается (при необходимости), прежде чем вернуться в организм через артериальную канюлю. Теперь можно применить кардиоплегию, чтобы остановить сердце, и на аорту между артериальной канюлей и канюлей для кардиоплегии накладывают перекрестный зажим, чтобы предотвратить обратный ток артериальной крови в сердце. Важным фактором является установление соответствующих целевых показателей артериального давления для поддержания здоровья и функционирования органов, включая мозг и почки. [21]
Как только пациент готов отказаться от шунтирования, перекрестный зажим и канюли снимают и вводят сульфат протамина , чтобы обратить вспять антикоагулянтное действие гепарина.



Австрийско-немецкий физиолог Максимилиан фон Фрей сконструировал ранний прототип аппарата искусственного кровообращения в 1885 году в Физиологическом институте Карла Людвига Лейпцигского университета . [22] Однако такие машины были невозможны до открытия в 1916 году гепарина , который предотвращает свертывание крови . Советский учёный Сергей Брюхоненко в 1926 году разработал аппарат искусственного кровообращения для тотальной перфузии тела под названием « Автоджектор» , который использовался в экспериментах на собаках, некоторые из которых были продемонстрированы в фильме 1940 года « Эксперименты по возрождению организмов» . Группа ученых из Бирмингемского университета (в том числе Эрик Чарльз, инженер-химик) была среди пионеров этой технологии. [23] [24]
Доктор Кларенс Деннис возглавил команду Медицинского центра Университета Миннесоты , которая 5 апреля 1951 года провела первую операцию на человеке, включающую открытую кардиотомию с временным механическим перехватом функций сердца и легких. Пациент не выжил из-за неожиданно возникшего сложного врожденного порока сердца. Одним из членов команды был доктор Рассел М. Нельсон , который позже стал президентом Церкви Иисуса Христа Святых последних дней и провел первую операцию на открытом сердце в штате Юта . [25]
Первая успешная механическая поддержка функции левого желудочка была выполнена 3 июля 1952 года Форестом Дьюи Додриллом с использованием аппарата Dodrill-GMR , разработанного совместно с General Motors . Позже аппарат использовался для поддержки функции правого желудочка. [26]
Первая успешная операция на открытом сердце у человека с использованием аппарата искусственного кровообращения была выполнена Джоном Гиббоном и Фрэнком Ф. Олбриттеном-младшим [27] 6 мая 1953 года в Университетской больнице Томаса Джефферсона в Филадельфии . Они исправили дефект межпредсердной перегородки у 18-летней женщины. [28] В середине 1950-х годов машина Гиббона была превращена в надежный инструмент хирургической бригадой под руководством Джона В. Кирклина в клинике Майо в Рочестере, штат Миннесота . [29]
Оксигенатор был впервые задуман в 17 веке Робертом Гуком , а в 19 веке французские и немецкие физиологи-экспериментаторы превратили его в практические экстракорпоральные оксигенаторы. Пузырьковые оксигенаторы не имеют промежуточного барьера между кровью и кислородом, их называют оксигенаторами «прямого контакта». Мембранные оксигенаторы создают газопроницаемую мембрану между кровью и кислородом, что снижает травму крови при использовании оксигенаторов прямого контакта. Большая работа, начиная с 1960-х годов, была сосредоточена на преодолении нарушений газообмена, вызванных мембранным барьером, что привело к разработке высокоэффективных микропористых оксигенаторов из полых волокон, которые в конечном итоге заменили оксигенаторы прямого контакта в кардиологических отделениях. [30]
В 1983 году Кен Литци запатентовал закрытую систему экстренного шунтирования сердца, которая уменьшила сложность схемы и компонентов. [31] Это устройство улучшило выживаемость пациентов после остановки сердца, поскольку его можно было быстро использовать в нехирургических условиях. [32]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )