
Химия алюминийорганических соединений — это изучение соединений, содержащих связи между углеродом и алюминием . Это одна из основных тем в металлоорганической химии . [1] [2] Иллюстративные алюминийорганические соединения — это димер триметилалюминия , мономер триизобутилалюминия и титано-алюминиевое соединение, называемое реагентом Теббе . Поведение алюминийорганических соединений можно понять с точки зрения полярности связи C−Al и высокой кислотности Льюиса трехкоординированных видов. В промышленности эти соединения в основном используются для производства полиолефинов .
Первое алюминийорганическое соединение (C 2 H 5 ) 3 Al 2 I 3 было открыто в 1859 году. [3] Однако алюминийорганические соединения были малоизвестны до 1950-х годов, когда Карл Циглер и его коллеги открыли прямой синтез триалкилалюминиевых соединений и применили эти соединения для каталитической полимеризации олефинов . Это направление исследований в конечном итоге привело к присуждению Циглеру Нобелевской премии.
Алюмоорганические соединения обычно имеют трех- и четырехкоординированные центры Al, хотя более высокие координационные числа наблюдаются с неорганическими лигандами, такими как фторид . В соответствии с обычными тенденциями, четырехкоординированный Al предпочитает быть тетраэдрическим. В отличие от бора, алюминий является более крупным атомом и легко вмещает четыре углеродных лиганда. Таким образом, триорганоалюминиевые соединения обычно являются димерными с парой мостиковых алкильных лигандов, например, Al 2 (C 2 H 5 ) 4 (μ-C 2 H 5 ) 2 . Таким образом, несмотря на его общее название триэтилалюминий, это соединение содержит два алюминиевых центра и шесть этильных групп . Когда алюмоорганическое соединение содержит гидрид или галогенид , эти меньшие лиганды имеют тенденцию занимать мостиковые сайты. Три координации происходят, когда группы R являются объемными, например , Al(Mes) 3 (Mes = 2,4,6-Me3C6H2 или мезитил ) или изобутил . [4]

Димеры триалкилалюминия часто участвуют в динамических равновесиях, что приводит к взаимозамене мостиковых и терминальных лигандов, а также к обмену лигандами между димерами. Даже в некоординирующих растворителях обмен Al-Me происходит быстро, что подтверждается протонной ЯМР- спектроскопией. Например, при −25 °C спектр ЯМР 1 H Me 6 Al 2 содержит два сигнала в соотношении 1:2, как и ожидалось из структуры твердого тела. При 20 °C наблюдается только один сигнал, поскольку обмен терминальными и мостиковыми метильными группами происходит слишком быстро, чтобы его можно было разрешить с помощью ЯМР. [5] Высокая кислотность Льюиса мономерных видов связана с размером центра Al(III) и его тенденцией достигать конфигурации октета .
Первое алюминийорганическое соединение со связью Al-Al было описано в 1988 году как (((Me 3 Si) 2 CH) 2 Al) 2 (диаллан). Обычно их получают восстановлением хлоридов диалкилалюминия металлическим калием: [6]
Другая заметная группа алан — тетрааланы, содержащие четыре центра Al(I). Эти соединения имеют тетраэдрическое ядро , как показано на примере ( Cp* Al) 4 и (( Me3Si3C ) Al) 4 . Кластер [Al12 ( i -Bu ) 12 ] 2− был получен в результате родственных исследований по восстановлению алюминийорганических соединений. Этот дианион имеет икосаэдрическую структуру, напоминающую додекаборат ([B12H12 ] 2− ) . Его формальная степень окисления меньше единицы.
В промышленности простые алкилы алюминия типа Al 2 R 6 (R = Me, Et) получают в двухстадийном процессе, начинающемся с алкилирования алюминиевого порошка:
Реакция напоминает синтез реактивов Гриньяра . Продукт, (CH 3 CH 2 ) 3 Al 2 Cl 3 , называется этилалюминийсесквихлоридом . Термин сесквихлорид относится к тому факту, что в среднем соотношение Cl:Al составляет 1,5. Эти сесквихлориды могут быть преобразованы в триорганоалюминиевые производные путем восстановления:
Этот метод используется для производства триметилалюминия и триэтилалюминия . [7]
Общая реакция получения этих простых алкилалюминиевых соединений выглядит следующим образом:
Алюминиевый порошок напрямую реагирует с некоторыми терминальными алкенами в присутствии водорода. Процесс включает два этапа, первый из которых производит диалкилалюминиевые гидриды. Такие реакции обычно проводятся при повышенных температурах и требуют активации триалкилалюминиевыми реагентами:
Для необъемных групп R органоалюминиевые гидриды обычно являются тримерными. На следующем этапе эти гидриды обрабатываются большим количеством алкена для осуществления гидроалюминирования:
Гидрид диизобутилалюминия , который является димерным, получают путем элиминирования гидрида из триизобутилалюминия:
Алюмоорганические соединения могут реагировать с алкенами и алкинами, что приводит к чистому присоединению одной органильной группы и фрагмента металла через кратную связь (карбоалюминирование). Этот процесс может протекать чисто термическим способом или в присутствии катализатора переходного металла. Для некатализируемого процесса моноприсоединение возможно только при замещении алкена. Для этилена карбоалюминирование приводит к распределению Пуассона высших видов алкилалюминия. Реакция является региоселективной для 1-алкенов . [8] Так называемая реакция ZACA , впервые описанная Эй-ичи Негиши, является примером асимметричного карбоалюминирования алкенов, катализируемого хиральным цирконоценовым катализатором. [9]
Метилалюминирование алкинов в присутствии Cp 2 ZrCl 2 [10] [11] используется для синтеза стереоопределенных тризамещенных олефиновых фрагментов, общей подструктуры в терпеновых и поликетидных природных продуктах. Синтез ( E )-4-иод-3-метилбут-3-ен-1-ола [12], показанный ниже, является типичным применением этой реакции:
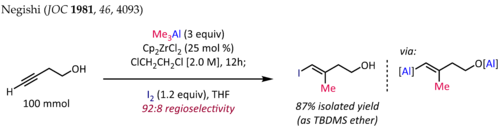
Для терминальных алкинов реакция обычно протекает с хорошей региоселективностью (>90:10 rr) и полной синселективностью , даже в присутствии пропаргиловых или гомопропаргиловых гетероатомных заместителей. К сожалению, расширение катализируемого цирконоценом метилалюминирования до алкилалюминирования с высшими алкилами приводит к более низким выходам и плохой региоселективности.
Хотя простые члены коммерчески доступны по низкой цене, было разработано много методов их синтеза в лабораторных условиях, включая метатезис или трансметаллирование .
Высокая реакционная способность алюминийорганических соединений по отношению к электрофилам объясняется разделением зарядов между алюминием и атомом углерода .
Алюмоорганические соединения являются жесткими кислотами и легко образуют аддукты с основаниями, такими как пиридин , ТГФ и третичные амины . Эти аддукты являются тетраэдрическими по Al.
Связь Al–C поляризована, так что углерод имеет высокую щелочность. Кислоты реагируют, давая алканы. Например, спирты дают алкоксиды :
Помимо простых минеральных кислот можно использовать широкий спектр кислот. Амины дают амидопроизводные. С диоксидом углерода триалкилалюминиевые соединения дают диалкилалюминиевый карбоксилат, а затем алкилалюминиевые дикарбоксилаты:
Превращение напоминает карбонизацию реактивов Гриньяра . [13] [14] [15]
Аналогично реакция между соединениями триалкилалюминия и диоксидом углерода использовалась для синтеза спиртов, олефинов [13] или кетонов [16] .
С кислородом получаются соответствующие алкоголяты, которые могут быть гидролизованы до спиртов:
Структурно охарактеризованный органоалюминиевый пероксид - [{HC[C(Me)NC 6 H 5 ] 2 }Al(R)-OO-CMe 3 ] [R=CH(SiMe 3 ) 2 ]. [17]
Реакция между чистыми соединениями триалкилалюминия и водой , спиртами , фенолами , аминами , диоксидом углерода , оксидами серы , оксидами азота , галогенами и галогенированными углеводородами может быть бурной. [18] [19]
Алюмоорганические соединения широко используются в производстве алкенов, спиртов и полимеров. Некоторые соответствующие процессы включают процесс Циглера для производства спиртов из этилена. Существует несколько технологий олигомеризации этилена для получения альфа-олефинов. [20] Алюмоорганические соединения используются в качестве катализаторов для полимеризации алкенов в полиолефины , например, катализатор метилалюмоксан .
{{cite journal}}: Отсутствует или пусто |title=( помощь )