Анкилостомоз — это инфекция, вызываемая кишечным паразитом , известным как анкилостома . [1] [5] Первоначально в месте заражения могут возникнуть зуд и сыпь. У тех, кто заражен только несколькими червями, симптомы могут отсутствовать. У тех, кто заражен многими червями, могут возникнуть боли в животе , диарея, потеря веса и усталость . Может быть нарушено умственное и физическое развитие детей. Может возникнуть анемия . [1]
Две распространенные инфекции анкилостомид у людей — это анкилостомоз и некатороз , вызываемые видами Ancylostoma duodenale и Necator americanus соответственно. Яйца анкилостом откладываются в стуле инфицированных людей. Если они попадают в окружающую среду, они могут вылупиться в личинки (незрелые черви), которые затем могут проникнуть в кожу. Один тип также может распространяться через зараженную пищу. Факторы риска включают хождение босиком в теплом климате, где плохие санитарные условия . Диагноз ставится путем исследования образца стула под микроскопом . [1]
Риск заражения можно снизить на индивидуальном уровне, не гуляя босиком в районах, где распространено это заболевание. На уровне населения эффективными являются уменьшение дефекации на открытом воздухе , отказ от использования сырых фекалий в качестве удобрения и массовая дегельминтизация . [1] Лечение обычно проводится с помощью лекарств альбендазол или мебендазол в течение одного-трех дней. Людям с анемией могут потребоваться добавки железа . [3]
Анкилостомозом было инфицировано около 428 миллионов человек в 2015 году. [4] Тяжелые инфекции могут возникать как у детей, так и у взрослых, но у взрослых они встречаются реже. [2] Они редко приводят к летальному исходу. [6] Анкилостомоз — это гельминтоз, передающийся через почву , и классифицируется как забытое тропическое заболевание . [7]
Нет симптомов или признаков, специфичных для заражения анкилостомами, но они вызывают сочетание кишечного воспаления и прогрессирующей железодефицитной анемии и дефицита белка . Кашель, боль в груди, хрипы и лихорадка иногда являются результатом тяжелой инфекции. Боли в эпигастрии, расстройство желудка, тошнота, рвота, запор и диарея могут возникать как на ранних, так и на поздних стадиях, хотя желудочно-кишечные симптомы, как правило, со временем улучшаются. Признаками прогрессирующей тяжелой инфекции являются анемия и дефицит белка, включая истощение , сердечную недостаточность и вздутие живота с асцитом . [ необходима ссылка ]
Личиночное вторжение в кожу (в основном в Америке) может вызвать кожное заболевание, называемое кожной личинок-мигрантов, также известное как ползучая сыпь. Хозяевами этих червей являются не люди, и личинки могут проникать только в верхние пять слоев кожи, где они вызывают сильный локальный зуд , обычно на стопе или голени, известный как зуд земли . Эта инфекция вызвана личинками анкилостомы A. braziliense . Личинки мигрируют в извилистых туннелях между базальным и роговым слоями кожи, вызывая серпигинозные везикулярные поражения . По мере продвижения личинок задние части поражений становятся сухими и покрываются коркой. Поражения, как правило, сильно зудят. [8]
Инкубационный период может длиться от нескольких недель до многих месяцев и во многом зависит от количества паразитов анкилостом, которыми заражен человек. [9]

Анкилостомоз у людей включает анкилостомоз и некатороз . Анкилостомоз вызывается Ancylostoma duodenale , который является наиболее распространенным типом, встречающимся на Ближнем Востоке , в Северной Африке , Индии и (ранее) в Южной Европе . Некатороз вызывается Necator americanus , более распространенным типом в Америке , странах Африки к югу от Сахары , Юго- Восточной Азии , Китае и Индонезии . [ требуется ссылка ]
Другие животные, такие как птицы , собаки и кошки, также могут быть поражены. A. tubaeforme заражает кошек, A. caninum заражает собак, а A. braziliense и Uncinaria stenocephala заражают как кошек, так и собак. Некоторые из этих инфекций могут передаваться человеку . [10]
Черви A. duodenale серовато-белые или розоватые, с головой, слегка изогнутой по отношению к остальной части тела. Этот изгиб образует определенную форму крючка на переднем конце, за которую анкилостомы и получили свое название. Они обладают хорошо развитыми ртами с двумя парами зубов. В то время как самцы имеют размеры приблизительно один сантиметр на 0,5 миллиметра, самки часто длиннее и толще. Кроме того, самцов можно отличить от самок по наличию выступающей задней копулятивной сумки. [11]
N. americanus очень похож по морфологии на A. duodenale . N. americanus , как правило, меньше, чем A. duodenale , самцы обычно имеют длину от 5 до 9 мм, а самки — около 1 см. В то время как A. duodenale обладает двумя парами зубов, N. americanus обладает парой режущих пластин в буккальной капсуле. Кроме того, форма крючка у Necator гораздо более выражена , чем у Ancylostoma . [11]
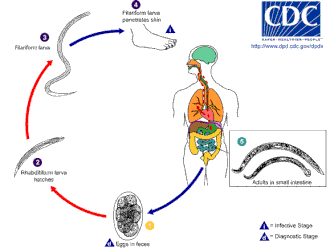
Анкилостома процветает в теплой почве, где температура превышает 18 °C (64 °F). Они существуют в основном в песчаной или суглинистой почве и не могут жить в глине или грязи. Среднее количество осадков должно быть более 1000 мм (39 дюймов) в год, чтобы они выжили. Только при наличии этих условий яйца могут вылупиться. Инфекционные личинки N. americanus могут выживать при более высоких температурах, тогда как личинки A. duodenale лучше приспособлены к более прохладному климату. Как правило, они живут максимум несколько недель в естественных условиях и почти сразу умирают при воздействии прямых солнечных лучей или высыхании . [ требуется ссылка ]
Заражение хозяина происходит личинками, а не яйцами. Хотя A. duodenale можно проглотить, обычным способом заражения является заражение через кожу; это обычно происходит при ходьбе босиком по местам, загрязненным фекалиями. Личинки способны проникать через кожу стопы, и, попав внутрь организма, они мигрируют по сосудистой системе в легкие , а оттуда вверх по трахее и проглатываются. Затем они спускаются по пищеводу и попадают в пищеварительную систему, завершая свое путешествие в кишечнике , где личинки созревают во взрослых червей. [12] [13]
Попав в кишечник хозяина, Necator имеет тенденцию вызывать длительную инфекцию, обычно от 1 до 5 лет (многие черви умирают в течение года или двух после заражения), хотя некоторые взрослые черви, как было зарегистрировано, живут 15 лет и более. Взрослые особи Ancylostoma живут недолго, в среднем всего около 6 месяцев. Однако инфекция может быть продолжительной, поскольку спящие личинки могут «набираться» последовательно из тканевых «запасов» в течение многих лет, чтобы заменить истекших взрослых червей. Это может привести к сезонным колебаниям распространенности и интенсивности инфекции (помимо обычных сезонных колебаний в передаче). [ необходима цитата ]

Они спариваются внутри хозяина, самки откладывают от 10 000 до 30 000 яиц в день и около 15–56 миллионов яиц в течение своей взрослой жизни, которые выходят с фекалиями. Поскольку для созревания, спаривания и производства яиц взрослым червям требуется от 5 до 7 недель, на ранних стадиях очень тяжелой инфекции острые симптомы могут проявляться без обнаружения яиц в фекалиях пациента. Это может сильно затруднить диагностику. [ необходима цитата ]
Яйца N. americanus и A. duodenale можно найти в теплой влажной почве, где они в конечном итоге вылупляются в личинки первой стадии, или L1. L1, питающаяся неинфекционная рабдитоформная стадия, будет питаться почвенными микробами и в конечном итоге линяет в личинки второй стадии, L2, которые также находятся в рабдитоформной стадии. Она будет питаться около 7 дней, а затем линяет в личинки третьей стадии, или L3. Это филяриевидная стадия паразита, то есть непитающаяся инфекционная форма личинок. Личинки L3 чрезвычайно подвижны и ищут возвышенности, чтобы увеличить свои шансы на проникновение через кожу человека-хозяина. Личинки L3 могут выживать до 2 недель, не находя хозяина. В то время как личинки N. americanus заражают только через проникновение через кожу, A. duodenale может заражать как через проникновение, так и через рот. После того, как личинки L3 успешно проникли в хозяина, они затем перемещаются через подкожные венулы и лимфатические сосуды хозяина-человека. В конце концов, личинки L3 попадают в легкие через легочные капилляры и вырываются в альвеолы. Затем они перемещаются вверх по трахее, где хозяин их откашливает и проглатывает. После проглатывания личинки L3 затем оказываются в тонком кишечнике, где они линяют в L4, или стадию взрослого червя. Весь процесс от проникновения через кожу до развития взрослой особи занимает около 5–9 недель. Самки взрослых червей выделяют яйца ( N. americanus около 9 000–10 000 яиц/день и A. duodenale 25 000–30 000 яиц/день), которые выводятся с фекалиями хозяина-человека. Эти яйца вылупляются в окружающей среде в течение нескольких дней, и цикл начинается заново. [12] [14] [15]
Анкилостомоз обычно считается бессимптомным, но, как описал Норман Столл в 1962 году, это чрезвычайно опасная инфекция, поскольку ее повреждение является «тихим и коварным». [16] У человека могут возникнуть общие симптомы вскоре после заражения. Зуд, который является аллергической реакцией в месте проникновения и входа паразита, часто встречается у пациентов, инфицированных N. americanus . [11] Кроме того, кашель и пневмонит могут возникнуть, когда личинки начинают проникать в альвеолы и перемещаться по трахее. Затем, как только личинки достигают тонкого кишечника хозяина и начинают созревать, инфицированный человек будет испытывать диарею и другой желудочно-кишечный дискомфорт. [11] Однако «тихие и коварные» симптомы, упомянутые Столлом, связаны с хроническими, тяжелыми инфекциями анкилостомозами. Основная заболеваемость, связанная с анкилостомозом, вызвана кишечной кровопотерей, железодефицитной анемией и белковой недостаточностью. [14] Они возникают в основном из-за того, что взрослые анкилостомы в тонком кишечнике заглатывают кровь, разрывают эритроциты и разрушают гемоглобин у хозяина. [12] Эта долгосрочная потеря крови может проявляться физически через отек лица и периферические отеки ; эозинофилия и пикацизм/ геофагия, вызванные железодефицитной анемией, также наблюдаются у некоторых пациентов, инфицированных анкилостомами. [11] В последнее время больше внимания уделяется другим важным последствиям заражения анкилостомами, которые играют большую роль в общественном здравоохранении. В настоящее время широко признано, что дети, страдающие хронической инфекцией анкилостомами, могут испытывать задержку роста, а также интеллектуальные и когнитивные нарушения. [12] [17] Кроме того, недавние исследования были сосредоточены на потенциальных неблагоприятных исходах для матери и плода, когда мать заражается анкилостомами во время беременности. [ необходима ссылка ]
Заболевание было связано с нематодами ( Ankylostoma duodenalis ) длиной от одной трети до половины дюйма, обитающими в кишечнике, главным образом благодаря трудам Теодора Бильгарца и Гризингера в Египте (1854 г.) [18] .
Симптомы могут быть связаны с воспалением в кишечнике, вызванным кормлением анкилостомами, такими как тошнота, боли в животе и прерывистая диарея, а также с прогрессирующей анемией при длительном заболевании: капризный аппетит, пикацизм / геофагия (или поедание грязи), упорный запор, за которым следует диарея , сердцебиение , нитевидный пульс, холодность кожи, бледность слизистых оболочек, усталость и слабость, одышка и в случаях со смертельным исходом дизентерия , кровоизлияния и отеки . [18] Черви сосут кровь и повреждают слизистую оболочку . Однако потеря крови в стуле визуально не видна. [ необходима цитата ]
Анализы крови на ранней стадии инфекции часто показывают рост числа эозинофилов, типа белых кровяных клеток, которые преимущественно стимулируются червями в тканях (большое количество эозинофилов также присутствует в местной воспалительной реакции). Падение уровня гемоглобина в крови будет наблюдаться в случаях длительной инфекции с анемией. [ необходима цитата ]
В отличие от большинства кишечных гельминтозов , где самые тяжелые паразитарные нагрузки, как правило, возникают у детей, распространенность и интенсивность анкилостомоза могут быть выше среди взрослых мужчин. Объяснением этого является то, что заражение анкилостомами, как правило, носит профессиональный характер, поэтому коллеги и другие близкие группы поддерживают высокую распространенность инфекции среди себя, загрязняя свою рабочую среду. Однако в большинстве эндемичных районов взрослые женщины наиболее сильно страдают от анемии, в основном потому, что у них гораздо более высокие физиологические потребности в железе (менструация, повторная беременность). Интересным следствием этого в случае заражения Ancylostoma duodenale является транслактационная передача инфекции: личинки этого вида, проникающие через кожу, не все сразу проходят через легкие и попадают в кишечник, а распространяются по всему организму через кровообращение, чтобы стать спящими внутри мышечных волокон. У беременной женщины после родов некоторые или все эти личинки стимулируются к повторному попаданию в кровообращение (предположительно, из-за внезапных гормональных изменений), а затем к попаданию в молочные железы, так что новорожденный ребенок может получить большую дозу инфекционных личинок через молоко матери. Это объясняет иначе необъяснимые случаи очень тяжелых, даже смертельных, инфекций анкилостом у детей в возрасте около месяца в таких местах, как Китай, Индия и северная Австралия. Идентичное явление гораздо чаще наблюдается при инфекциях Ancylostoma caninum у собак, когда новорожденные щенки могут даже умереть от кровотечения из кишечника, вызванного огромным количеством питающихся анкилостом. Это также отражает тесную эволюционную связь между человеческими и собачьими паразитами, которые, вероятно, имеют общего предка, восходящего к тому времени, когда люди и собаки впервые начали жить рядом. Филяриевидные личинки являются инвазионной стадией паразита: заражение происходит, когда личинки из почвы проникают в кожу или когда они попадают в организм через зараженную пищу и воду после проникновения через кожу. [ необходима цитата ]

Диагностика зависит от обнаружения характерных яиц глистов при микроскопическом исследовании стула, хотя это невозможно на ранней стадии заражения. Ранние признаки заражения у большинства собак включают лимбулярную хромоту и анальный зуд. Яйца овальные или эллиптические, размером 60 на 40 мкм, бесцветные, не окрашенные желчью и с тонкой прозрачной гиалиновой оболочкой. Когда червь высвобождается в кишечнике, яйцо содержит несегментированное яйцо . Во время прохождения по кишечнику яйцо развивается, и, таким образом, яйца, выделяемые с калом, имеют сегментированное яйцо, обычно с 4–8 бластомерами . Поскольку яйца как Ancylostoma , так и Necator (и большинства других видов анкилостом) неразличимы, для определения рода их необходимо культивировать в лаборатории, чтобы позволить личинкам вылупиться. Если образец кала оставить на день или более в тропических условиях, личинки вылупятся, поэтому яйца могут больше не быть заметны. В таком случае важно отличить анкилостомы от личинок Strongyloides , поскольку заражение последними имеет более серьезные последствия и требует иного лечения. Личинки двух видов анкилостом также можно отличить микроскопически, хотя это не делается рутинно, а обычно в исследовательских целях. Взрослые черви редко видны (за исключением эндоскопии, хирургии или аутопсии), но если они обнаружены, это позволит окончательно идентифицировать вид. Классификация может быть выполнена на основе длины ротовой полости, пространства между ротовым отверстием и пищеводом: рабдитоформные личинки анкилостомы имеют длинные ротовые полости, тогда как рабдитоформные личинки Strongyloides имеют короткие ротовые полости. [11]
Недавние исследования были сосредоточены на разработке основанных на ДНК инструментов для диагностики инфекции, специфической идентификации анкилостом и анализа генетической изменчивости в популяциях анкилостом. [19] Поскольку яйца анкилостом часто неотличимы от яиц других паразитов, анализы ПЦР могут служить молекулярным подходом для точной диагностики анкилостом в кале. [19] [20]
Инфекционные личинки развиваются и выживают в среде влажной грязи, особенно песчаной и суглинистой почвы. Они не могут выживать в глине или грязи. Основные меры предосторожности диктуются хорошим гигиеническим поведением:
Моксидектин доступен в Соединенных Штатах в виде ( имидаклоприд + моксидектин) местного раствора для собак и кошек. Он использует моксидектин для контроля и профилактики круглых червей, анкилостом, сердечных червей и власоглавов .
.jpg/440px-Medical_Civic_Action_Program_in_Shinile_Woreda,_Ethiopia,_2010_(5120478292).jpg)
Большинство этих проблем общественного здравоохранения были сосредоточены на детях, инфицированных анкилостомами. Такое внимание к детям во многом обусловлено большим количеством доказательств, которые продемонстрировали тесную связь между заражением анкилостомами и ухудшением обучения, увеличением пропусков занятий в школе и снижением будущей экономической производительности. [12] В 2001 году 54-я Всемирная ассамблея здравоохранения приняла резолюцию, требующую от государств-членов достичь минимальной цели регулярной дегельминтизации не менее 75% всех детей школьного возраста из группы риска к 2010 году. [21] В публикации Всемирной организации здравоохранения за 2008 год сообщалось об этих усилиях по лечению детей школьного возраста из группы риска. Некоторые из интересных статистических данных были следующими: 1) только 9 из 130 эндемичных стран смогли достичь целевого показателя в 75%; и 2) было охвачено менее 77 миллионов детей школьного возраста (из общего числа 878 миллионов детей из группы риска), что означает, что только 8,78% детей из группы риска проходят лечение от заражения анкилостомами. [22]
Программы массовой дегельминтизации на базе школ стали самой популярной стратегией решения проблемы заражения детей анкилостомами. Программы на базе школ чрезвычайно экономически эффективны, поскольку школы уже имеют доступную, обширную и устойчивую инфраструктуру с квалифицированной рабочей силой, которая имеет тесные связи с сообществом. [21] При небольшой подготовке в местной системе здравоохранения учителя могут легко вводить препараты, которые часто стоят менее 0,50 долл. США на ребенка в год. [23]
В последнее время многие люди начали сомневаться, являются ли программы на базе школ самым эффективным подходом. Важной проблемой школьных программ является то, что они часто не охватывают детей, которые не посещают школу, тем самым игнорируя большое количество детей из группы риска. Исследование 2008 года, проведенное Массой и др., продолжило дебаты относительно школьных программ. Они изучили эффекты лечения, направленного на сообщество, по сравнению с лечением на базе школы в регионе Танга в Танзании. Основной вывод состоял в том, что средняя интенсивность заражения анкилостомой была значительно ниже в деревнях, применяющих подход лечения, направленного на сообщество, чем подход, направленный на школу. Модель лечения, направленного на сообщество, использованная в этом конкретном исследовании, позволила жителям деревни взять под контроль лечение ребенка, заставив жителей деревни выбрать собственных дистрибьюторов лекарств для выдачи противогельминтных препаратов. Кроме того, жители деревни организовали и внедрили собственные методы распределения лекарств среди всех детей. [24] Положительные результаты, связанные с этой новой моделью, подчеркивают необходимость широкомасштабного участия сообщества в кампаниях по дегельминтизации. [ необходима ссылка ]
Многие программы массовой дегельминтизации также объединяют свои усилия с просвещением населения в области здравоохранения. Эти программы просвещения в области здравоохранения часто подчеркивают важные профилактические методы, такие как: мытье рук перед едой и избегание воды/мест, загрязненных человеческими фекалиями. Эти программы также могут подчеркивать необходимость ношения обуви, однако это несет свои собственные риски для здоровья и может быть неэффективным. [25] Модели ношения обуви в городах и деревнях по всему миру определяются культурными убеждениями и уровнем образования в этом обществе. Ношение обуви предотвратит проникновение инфекций анкилостом из окружающей почвы в нежные участки кожи, такие как области между пальцами ног. [26]
Исторические примеры, такие как кампании по борьбе с анкилостомами в Миссисипи и Флориде с 1943 по 1947 год, показали, что основной причиной заражения анкилостомами является плохая санитария, которую можно решить путем строительства и обслуживания туалетов . Но хотя эти задачи могут показаться простыми, они поднимают важные проблемы общественного здравоохранения. Большинство инфицированных групп населения проживает в бедных районах с очень плохой санитарией. Таким образом, наиболее вероятно, что дети из группы риска не имеют доступа к чистой воде для мытья рук и живут в условиях отсутствия надлежащей санитарной инфраструктуры. Поэтому санитарное просвещение должно рассматривать профилактические меры способами, которые являются как осуществимыми, так и устойчивыми в условиях ограниченных ресурсов. [ необходима цитата ]
Оценка многочисленных вмешательств в области общественного здравоохранения в целом показала, что улучшение каждого отдельного компонента, обычно приписываемого бедности (например, санитария, медицинское образование и базовый статус питания), часто оказывают минимальное влияние на передачу. Например, одно исследование показало, что введение туалетов в сообщество с ограниченными ресурсами снизило распространенность заражения анкилостомами только на четыре процента. [27] Однако другое исследование в Сальвадоре, Бразилия, показало, что улучшение дренажа и канализации оказало значительное влияние на распространенность заражения анкилостомами, но не оказало никакого влияния на интенсивность заражения анкилостомами. [28] Это, по-видимому, говорит о том, что контроль окружающей среды сам по себе оказывает ограниченное, но неполное влияние на передачу анкилостом. Поэтому крайне важно провести больше исследований для понимания эффективности и устойчивости комплексных программ, которые объединяют многочисленные профилактические методы, включая образование, санитарию и лечение.
Наиболее распространенным лечением анкилостомоза являются бензимидазолы , в частности альбендазол и мебендазол . BZA убивают взрослых червей, связываясь с β- тубулином нематоды и впоследствии ингибируя полимеризацию микротрубочек внутри паразита. [14] В определенных обстоятельствах могут использоваться левамизол и пирантела памоат . [12] Обзор 2008 года показал, что эффективность лечения однократной дозой анкилостомоза была следующей: 72% для альбендазола, 15% для мебендазола и 31% для пирантела памоата. [29] Это подтверждает предыдущие утверждения о том, что альбендазол намного эффективнее мебендазола при анкилостомозе. Также следует отметить, что Всемирная организация здравоохранения рекомендует антигельминтное лечение беременным женщинам после первого триместра. [14] Также рекомендуется, если у пациента также есть анемия, вводить сульфат железа (200 мг) три раза в день одновременно с противогельминтным лечением; это следует продолжать до тех пор, пока показатели гемоглобина не вернутся к норме, что может занять до 3 месяцев. [11]
Инфекцию, вызванную анкилостомами, можно лечить с помощью местной криотерапии , пока анкилостомы все еще находятся в коже. [30]
Альбендазол эффективен как на кишечной стадии, так и на стадии, когда паразит все еще мигрирует под кожей. [30]
В случае анемии прием добавок железа может вызвать облегчение симптомов железодефицитной анемии . Однако по мере восстановления уровня эритроцитов может развиться нехватка других необходимых веществ, таких как фолиевая кислота или витамин B12 , поэтому их также можно принимать дополнительно.
В 1910-х годах распространенными методами лечения анкилостомоза были тимол , 2-нафтол , хлороформ , бензин и эвкалиптовое масло . [31] К 1940-м годам в качестве лечения использовался тетрахлорэтилен , [32] назначаемый по 3–4 см3 натощак, а затем 30–45 г сульфата натрия . Сообщалось, что тетрахлорэтилен излечивает 80 процентов инфекций Necator и 25 процентов инфекций Ancylostoma, и часто вызывает легкую интоксикацию у пациента.
Другие важные вопросы, связанные с лечением анкилостомоза, — это повторное заражение и лекарственная устойчивость. Было показано, что повторное заражение после лечения может быть чрезвычайно высоким. Некоторые исследования даже показывают, что 80% случаев заражения анкилостомозом до лечения можно наблюдать в пролеченных сообществах в течение 30–36 месяцев. [14] Хотя повторное заражение может произойти, все равно рекомендуется проводить регулярное лечение, так как это сведет к минимуму возникновение хронических последствий. Также растет обеспокоенность по поводу проблемы лекарственной устойчивости. Лекарственная устойчивость появилась у антигельминтных средств первой линии, используемых для нематод домашнего скота. Как правило, человеческие нематоды с меньшей вероятностью вырабатывают устойчивость из-за более длительного периода размножения, менее частого лечения и более целенаправленного лечения. Тем не менее, мировое сообщество должно быть осторожным, чтобы поддерживать эффективность текущих антигельминтных средств, поскольку никакие новые антигельминтные препараты не находятся на поздней стадии разработки. [14]
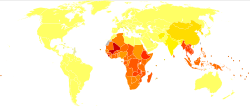
По оценкам, от 576 до 740 миллионов человек заражены анкилостомами. [33] [14] Из этих инфицированных людей около 80 миллионов имеют тяжелую форму заболевания. [19] Основной причиной заражения анкилостомами является N. americanus , который встречается в Америке, странах Африки к югу от Сахары и в Азии. [12] A. duodenale встречается в более разбросанных очаговых средах, а именно в Европе и Средиземноморье. Большинство инфицированных людей сосредоточено в странах Африки к югу от Сахары и Восточной Азии/на островах Тихого океана, при этом в каждом регионе насчитывается, по оценкам, 198 миллионов и 149 миллионов инфицированных людей соответственно. Другие пораженные регионы включают: Южную Азию (50 миллионов), Латинскую Америку и Карибский бассейн (50 миллионов), Южную Азию (59 миллионов), Ближний Восток/Северную Африку (10 миллионов). [14] Большинство этих инфицированных людей живут в бедных районах с плохой санитарией. Инфекция анкилостомами наиболее сконцентрирована среди самых бедных людей мира, которые живут менее чем на 2 доллара в день. [12]
Хотя заражение анкилостомами может и не приводить напрямую к смертности, его влияние на заболеваемость требует немедленного внимания. При рассмотрении лет жизни, скорректированных по инвалидности (DALY), забытые тропические болезни, включая заражение анкилостомами, занимают место среди диарейных заболеваний, ишемической болезни сердца , малярии и туберкулеза как одной из важнейших проблем здравоохранения в развивающихся странах.
Было подсчитано, что около 22,1 миллиона DALY были потеряны из-за заражения анкилостомами. В последнее время растет интерес к решению проблем общественного здравоохранения, связанных с заражением анкилостомами. Например, Фонд Билла и Мелинды Гейтс недавно пожертвовал 34 миллиона долларов США на борьбу с забытыми тропическими болезнями, включая заражение анкилостомами. [34] Бывший президент США Клинтон также объявил о мегаобязательстве на ежегодном собрании Глобальной инициативы Клинтона (CGI) 2008 года по дегельминтизации 10 миллионов детей. [35]
Многие цифры, касающиеся распространенности анкилостомидоза, являются оценочными, поскольку в настоящее время не существует международного механизма наблюдения для определения распространенности и глобального распространения. [12] Некоторые показатели распространенности были измерены с помощью данных опросов в эндемичных регионах по всему миру. Ниже приведены некоторые из последних результатов по показателям распространенности в регионах, эндемичных по анкилостоме.
Дарджилинг , округ Хугли , Западная Бенгалия , Индия (Пал и др., 2007) [36]
Деревня Сюлункан, провинция Хайнань , Китай (Ганди и др., 2001) [37]
Хоа Бинь , Северо-Западный Вьетнам (Верле и др., 2003) [38]
Минас-Жерайс , Бразилия (Флеминг и др., 2006) [39]
Квазулу-Натал , Южная Африка (Мабасо и др., 2004 г.) [40]
Округ Лаундес, Алабама , США [41] [42]
Также были технологические разработки, которые могут способствовать более точному картированию распространенности анкилостом. Некоторые исследователи начали использовать географические информационные системы (ГИС) и дистанционное зондирование (ДЗ) для изучения экологии и эпидемиологии гельминтов. Брукер и др. использовали эту технологию для создания карт распространения гельминтов в странах Африки к югу от Сахары. Связывая полученные со спутников данные об окружающей среде с данными о распространенности, полученными в ходе обследований в школах, они смогли создать подробные карты распространенности. Исследование было сосредоточено на широком спектре гельминтов, но были сделаны интересные выводы конкретно об анкилостоме. По сравнению с другими гельминтами анкилостома способна выживать в гораздо более жарких условиях и была широко распространена в верхней части теплового диапазона. [43]
Улучшенные молекулярные диагностические инструменты являются еще одним технологическим достижением, которое может помочь улучшить существующую статистику распространенности. Недавние исследования были сосредоточены на разработке инструмента на основе ДНК, который может быть использован для диагностики инфекции, специфической идентификации анкилостомы и анализа генетической изменчивости в популяциях анкилостомы. Опять же, это может служить основным инструментом для различных мер общественного здравоохранения против заражения анкилостомой. Большинство исследований в отношении диагностических инструментов в настоящее время сосредоточены на создании быстрого и экономически эффективного анализа для специфической диагностики заражения анкилостомой. Многие надеются, что его разработка может быть достигнута в течение следующих пяти лет. [ когда? ] [19]
Симптомы, которые сейчас приписывают анкилостоме, появляются в папирусах Древнего Египта ( около 1500 г. до н. э. ) и описываются как расстройство, характеризующееся анемией. Авиценна , персидский врач одиннадцатого века, обнаружил червя у нескольких своих пациентов и связал его с их болезнью. В более поздние времена это состояние было заметно распространено в горнодобывающей промышленности в Англии , Франции , Германии , Бельгии , Северном Квинсленде и других местах. [18]
Итальянский врач Анджело Дубини был современным первооткрывателем червя в 1838 году после вскрытия трупа крестьянки. Дубини опубликовал подробности в 1843 году и определил вид как A. duodenale . [44] Работая в египетской медицинской системе в 1852 году, немецкий врач Теодор Бильгарц , опираясь на работу коллеги Вильгельма Гризингера , обнаружил этих червей во время вскрытий и пошел на шаг дальше, связав их с местными эндемическими случаями хлороза , который сегодня, вероятно, назвали бы железодефицитной анемией .
Прорыв произошел 25 лет спустя после эпидемии диареи и анемии , которая произошла среди итальянских рабочих, занятых на Готардском железнодорожном тоннеле . [18] В статье 1880 года врачи Камилло Боццоло , Эдоардо Перрончито и Луиджи Пальяни правильно предположили, что анкилостома была связана с тем фактом, что рабочим приходилось испражняться внутри 15-километрового туннеля, и что многие носили изношенную обувь. [45] На рабочем месте часто стояла вода, иногда по колено, и личинки были способны выживать в воде несколько недель, что позволяло им заражать многих рабочих. В 1897 году было установлено, что кожа является основным путем заражения, и был выяснен биологический жизненный цикл анкилостомы.
В 1899 году американский зоолог Чарльз Уорделл Стайлз определил прогрессирующую злокачественную анемию, наблюдаемую на юге Соединенных Штатов, как вызванную анкилостомой A. duodenale . Тестирование в 1900-х годах выявило очень сильную инвазию у детей школьного возраста. В Пуэрто-Рико доктор Бейли К. Эшфорд, врач армии США, организовал и провел кампанию по лечению паразитов, в результате которой вылечилось около 300 000 человек (треть населения Пуэрто-Рико) и снизился уровень смертности от этой анемии на 90 процентов в течение 1903–04 годов.

26 октября 1909 года была организована Рокфеллеровская санитарная комиссия по искоренению анкилостомоза в результате пожертвования в размере 1 миллиона долларов США от Джона Д. Рокфеллера -старшего. Пятилетняя программа имела замечательный успех и внесла большой вклад в общественное здравоохранение Соединенных Штатов, внедряя государственное образование, медицину, полевую работу и современные государственные департаменты здравоохранения в одиннадцати южных штатах. [46] Экспозиция анкилостомоза была заметной частью ярмарки штата Миссисипи 1910 года.
Комиссия обнаружила, что в среднем 40% детей школьного возраста были инфицированы анкилостомой. Районы с более высоким уровнем заражения анкилостомой до программы по искоренению испытали более высокий рост числа учащихся, посещаемости и грамотности после вмешательства. Эконометрические исследования показали, что этот эффект не может быть объяснен различными альтернативными факторами, включая дифференциальные тенденции в разных районах, изменение цен на урожай, сдвиги в определенных политиках в области образования и здравоохранения и эффект искоренения малярии. [47] Не было обнаружено никаких существенных одновременных результатов для взрослых, которые должны были получить меньшую пользу от вмешательства из-за их существенно более низких (предыдущих) показателей инфицирования. Программа почти искоренила анкилостому и впоследствии процветала с новым финансированием в качестве Международного отдела здравоохранения Фонда Рокфеллера . [48]
Кампания РФ по анкилостоме в Мексике показала, как наука и политика играют роль в разработке политики здравоохранения. Она объединила правительственных чиновников, должностных лиц здравоохранения, работников общественного здравоохранения, должностных лиц Рокфеллера и сообщество. Эта кампания была начата с целью искоренения анкилостомы в Мексике. Хотя кампания не была сосредоточена на долгосрочном лечении, она установила условия отношений между Мексикой и Фондом Рокфеллера. Научные знания, лежащие в основе этой кампании, помогли сформировать политику общественного здравоохранения, улучшить общественное здоровье и построить прочные отношения между США и Мексикой. [49]
В 1920-х годах искоренение анкилостомы достигло Карибского бассейна и Латинской Америки, где к концу XVIII века была зарегистрирована высокая смертность среди людей в Вест-Индии , а также по описаниям, присланным из Бразилии и различных других тропических и субтропических регионов. [18]
Лечение в начале 20-го века основывалось на использовании соли Эпсома для уменьшения защитной слизи, а затем тимола для уничтожения глистов. [50] [31] К 1940-м годам основным методом стал тетрахлорэтилен . [32] Только в середине 20-го века были разработаны новые органические лекарственные соединения. [51]
По оценкам, треть всех беременных женщин в развивающихся странах инфицированы анкилостомами, 56% всех беременных женщин в развивающихся странах страдают анемией, 20% всех случаев материнской смертности напрямую или косвенно связаны с анемией. Такие цифры привели к повышению интереса к теме анемии, связанной с анкилостомами во время беременности. [52] Понимая, что хроническая инфекция анкилостомами часто может приводить к анемии, многие люди теперь задаются вопросом, может ли лечение анкилостомы повлиять на изменение показателей тяжелой анемии и, таким образом, также на здоровье матери и ребенка. Большинство данных свидетельствуют о том, что вклад анкилостомы в анемию у матери заслуживает того, чтобы все женщины детородного возраста, проживающие в эндемичных районах, подвергались периодическому антигельминтному лечению. Всемирная организация здравоохранения даже рекомендует лечить инфицированных беременных женщин после первого триместра. [14] Независимо от этих предложений, только Мадагаскар, Непал и Шри-Ланка добавили дегельминтизацию в свои программы дородового ухода. [53]
Отсутствие дегельминтизации беременных женщин объясняется тем, что большинство людей все еще опасаются, что противогельминтное лечение приведет к неблагоприятным исходам родов. Однако исследование 2006 года, проведенное Gyorkos et al., показало, что при сравнении группы беременных женщин, получавших мебендазол, с контрольной группой, получавшей плацебо, обе группы продемонстрировали довольно схожие показатели неблагоприятных исходов родов. Группа, получавшая лечение, продемонстрировала 5,6% неблагоприятных исходов родов, в то время как контрольная группа имела 6,25% неблагоприятных исходов родов. [52] Кроме того, Larocque et al. продемонстрировали, что лечение анкилостомоза на самом деле привело к положительным результатам для здоровья младенца. Это исследование пришло к выводу, что лечение мебендазолом в сочетании с добавками железа во время дородового наблюдения значительно снизило долю младенцев с очень низкой массой тела при рождении по сравнению с контрольной группой, получавшей плацебо. [54] Исследования до сих пор подтвердили рекомендации по лечению инфицированных беременных женщин от анкилостомоза во время беременности.
Обзор показал, что однократная доза антигельминтных средств (препаратов против глистов), принимаемая во втором триместре беременности, «может снизить материнскую анемию и распространенность глистов при использовании в условиях высокой распространенности материнских гельминтозов» [55] .
Интенсивность заражения анкилостомами, а также виды анкилостом еще предстоит изучить, поскольку они связаны с анемией, связанной с анкилостомами во время беременности. Кроме того, необходимо провести больше исследований в разных регионах мира, чтобы увидеть, сохраняются ли тенденции, отмеченные в завершенных исследованиях. [ необходима цитата ]
Коинфекция анкилостомой и Plasmodium falciparum распространена в Африке. [56] Хотя точные цифры неизвестны, предварительные анализы показывают, что около четверти африканских школьников (17,8–32,1 миллиона детей в возрасте 5–14 лет) могут быть одновременно подвержены риску заражения как P. falciparum , так и анкилостомой. [57] Хотя первоначальные гипотезы утверждали, что коинфекция несколькими паразитами ослабит иммунный ответ хозяина на одного паразита и увеличит восприимчивость к клиническому заболеванию, исследования дали противоположные результаты. Например, одно исследование в Сенегале показало, что риск клинической инфекции малярии был повышен у детей, инфицированных гельминтами, по сравнению с детьми, не инфицированными гельминтами, в то время как другие исследования не смогли воспроизвести такие результаты, [58] и даже среди экспериментов на лабораторных мышах влияние гельминтов на малярию является изменчивым. [59]
Некоторые гипотезы и исследования предполагают, что гельминтные инфекции могут защищать от церебральной малярии из-за возможной модуляции провоспалительных и противовоспалительных цитокиновых реакций. [60] Более того, механизмы, лежащие в основе этой предполагаемой повышенной восприимчивости к заболеванию, неизвестны. Например, гельминтные инфекции вызывают мощный и высокополяризованный иммунный ответ, характеризующийся повышенной продукцией цитокинов Т-хелперных клеток типа 2 (T h 2) и иммуноглобулина E (IgE). [61] Однако влияние таких ответов на иммунный ответ человека неизвестно. Кроме того, как малярия, так и гельминтная инфекция могут вызывать анемию, но влияние коинфекции и возможного усиления анемии изучено плохо. [51]
Гигиеническая гипотеза утверждает, что младенцы и дети, которые не подвергаются воздействию инфекционных агентов, более восприимчивы к аллергическим заболеваниям из-за модуляции развития иммунной системы. Теория была впервые предложена Дэвидом П. Страханом, который отметил, что сенная лихорадка и экзема реже встречаются у детей из больших семей. [62] С тех пор исследования отметили влияние желудочно-кишечных червей на развитие аллергии в развивающихся странах. Например, исследование в Гамбии показало, что искоренение червей в некоторых деревнях привело к увеличению кожных реакций на аллергию среди детей. [63]
Хотя ежегодное или полугодовое массовое введение противоглистных препаратов является критически важным аспектом любого вмешательства в здравоохранение, многие начали понимать, насколько оно неустойчиво из-за таких аспектов, как бедность, высокие показатели повторного заражения и снижение эффективности лекарств при повторном использовании. Поэтому текущие исследования были сосредоточены на разработке вакцины, которую можно было бы интегрировать в существующие программы контроля. Целью разработки вакцины не обязательно является создание вакцины со стерилизующим иммунитетом или полной защитой от иммунитета. Вакцина, которая снижает вероятность развития у вакцинированных лиц тяжелых инфекций и, таким образом, снижает уровень крови и питательных веществ, все еще может оказать значительное влияние на высокое бремя болезней во всем мире.
Текущие исследования сосредоточены на двух стадиях развития червя: личиночной стадии и взрослой стадии. Исследования личиночных антигенов были сосредоточены на белках, которые являются членами патогенез-связанного белкового суперсемейства, секретируемых белками Ancylostoma . [64] Хотя они были впервые описаны в Anyclostoma , эти белки также были успешно выделены из секретируемого продукта N. americanus . N. americanus ASP-2 (Na-ASP-2) в настоящее время является ведущим кандидатом на вакцину от анкилостом на личиночной стадии. Рандомизированное, двойное слепое, плацебо-контролируемое исследование уже было проведено; 36 здоровых взрослых без анкилостомной инфекции в анамнезе получили три внутримышечные инъекции трех различных концентраций Na-ASP-2 и наблюдались в течение шести месяцев после последней вакцинации. [65] Вакцина вызвала значительные анти-Na-ASP-2 IgG и клеточные иммунные ответы. Кроме того, она была безопасной и не вызывала изнуряющих побочных эффектов. Вакцина сейчас находится на первой фазе испытаний; здоровым взрослым добровольцам с документированными доказательствами предыдущей инфекции в Бразилии вводят ту же концентрацию дозы по тому же графику, что и в первоначальном исследовании. [64] Если это исследование будет успешным, следующим шагом будет проведение второй фазы испытаний для оценки скорости и интенсивности заражения анкилостомами среди вакцинированных лиц. Поскольку вакцина Na-ASP-2 нацелена только на личиночную стадию, крайне важно, чтобы все субъекты, включенные в исследование, прошли лечение противоглистными препаратами для устранения взрослых червей перед вакцинацией.
Антигены взрослых анкилостом также были идентифицированы как потенциальные кандидаты для вакцин. Когда взрослые черви прикрепляются к слизистой оболочке кишечника человека-хозяина, эритроциты разрываются в пищеварительном тракте червя, что вызывает высвобождение свободного гемоглобина, который впоследствии разрушается протеолитическим каскадом. Некоторые из этих белков, которые отвечают за этот протеолитический каскад, также необходимы для питания и выживания червя. [66] Поэтому вакцина, которая могла бы индуцировать антитела к этим антигенам, могла бы помешать пищеварительному пути анкилостомы и ухудшить выживание червя. Были идентифицированы три белка: аспарагиновая протеаза-гемоглобиназа APR-1, цистеиновая протеаза-гемоглобиназа CP-2 и глутатион S-трансфераза. [67] [68] [69] Вакцинация APR-1 и CP-2 привела к снижению потери крови хозяином и количества яиц в фекалиях у собак. [67] [68] В случае с APR-1 вакцинация даже привела к снижению нагрузки червями. [67] В настоящее время исследования зашли в тупик при разработке по крайней мере одного из этих антигенов в качестве рекомбинантного белка для тестирования в клинических испытаниях.
Термин «анкилостома» иногда используется для обозначения заражения анкилостомами. [12] Анкилостома — это тип паразитического червя ( гельминта ).
Неадекватные услуги общественного здравоохранения и общее отсутствие у граждан элементарных знаний о здоровье и гигиене отражали слабую систему государственного образования. Проблемы со здоровьем, особенно в штатах побережья Мексиканского залива, где заморозки наступили поздно, если вообще наступили, были в изобилии в эпоху, когда активные департаменты общественного здравоохранения в других частях страны искореняли алиментарные и бактериальные заболевания. Анкилостома, кишечный паразит, заразила и хронически ослабила очень много южан, возможно, около 2 миллионов. В 1930-х годах совместное исследование Управления здравоохранения штата Флорида, Фонда Рокфеллера и Университета Вандербильта обнаружило, что подростки штата в возрасте от 15 до 18 лет являются наиболее пораженной группой (44,7 процента), а Панхэндл - наиболее сильно пораженным районом, где почти половина подростков (49,2 процента) заражены анкилостомой (Эберсон, 1980; и Линк, 1988). Джон Д. Рокфеллер в начале двадцатого века считал ситуацию настолько ужасающей, что он создал и финансировал Санитарную комиссию Рокфеллера по искоренению заболевания анкилостомой.