Аортокоронарное шунтирование , также известное как аортокоронарное шунтирование ( АКШ , произносится как «капуста»), представляет собой хирургическую процедуру для лечения ишемической болезни сердца (ИБС), накопления бляшек в артериях сердца. Она может облегчить боль в груди, вызванную ИБС, замедлить прогрессирование ИБС и увеличить продолжительность жизни. Она направлена на обход сужений в артериях сердца с помощью артерий или вен, взятых из других частей тела, тем самым восстанавливая адекватное кровоснабжение ранее ишемизированного (лишенного крови) сердца.
Существует два основных подхода. Первый использует аппарат искусственного кровообращения , аппарат, который берет на себя функции сердца и легких во время операции, циркулируя кровь и кислород. При остановке сердца в кардиоплегической фазе , собранные артерии и вены используются для соединения через проблемные области — конструкция, известная как хирургический анастомоз . Во втором подходе, называемом аортокоронарным шунтированием без искусственного кровообращения (OPCAB), эти анастомозы создаются, когда сердце все еще бьется. Анастомоз, питающий левую переднюю нисходящую ветвь , является наиболее значимым, и обычно для использования собирают левую внутреннюю грудную артерию . Другими часто используемыми источниками являются правая внутренняя грудная артерия, лучевая артерия и большая подкожная вена .
Эффективные способы лечения боли в груди (в частности, стенокардии , распространенного симптома ИБС) искали с начала 20-го века. В 1960-х годах аортокоронарное шунтирование было представлено в его современной форме и с тех пор стало основным методом лечения значительной ИБС. Значительные осложнения операции включают кровотечение, проблемы с сердцем ( сердечный приступ , аритмии ), инсульт , инфекции (часто пневмония ) и повреждение почек .

Аортокоронарное шунтирование направлено на предотвращение смерти от ишемической болезни сердца и улучшение качества жизни за счет облегчения стенокардии , связанного с болью в груди. [1] Решение о проведении операции принимается на основе исследований эффективности АКШ в различных подгруппах пациентов, на основе анатомии поражений или того, насколько хорошо функционирует сердце. Эти результаты сравниваются с результатами других стратегий, наиболее важным из которых является чрескожное коронарное вмешательство (ЧКВ). [2] [3]

Ишемическая болезнь сердца возникает, когда коронарные артерии сердца накапливают атероматозные бляшки , вызывая стеноз (сужение) одной или нескольких артерий и создавая риск инфаркта миокарда , прерывания кровоснабжения сердца. ИБС может возникнуть в любом из крупных сосудов коронарного кровообращения : левом главном стволе, левой восходящей артерии, огибающей артерии и правой коронарной артерии и их ветвях. Симптомы ИБС варьируются от отсутствия симптомов до боли в груди только при физической нагрузке (стабильная стенокардия) и боли в груди даже в состоянии покоя (нестабильная стенокардия). Она может даже проявляться как инфаркт миокарда; если приток крови к сердцу не восстанавливается в течение нескольких часов, будь то спонтанно или с помощью медицинского вмешательства, лишенная крови часть сердца некротизируется ( отмирает) и покрывается рубцами. Это может привести к другим осложнениям, таким как аритмии , разрыв сосочковых мышц сердца или внезапная смерть. [4]
Существуют различные методы обнаружения и оценки ИБС. Помимо истории и клинического обследования, неинвазивные методы включают электрокардиографию (ЭКГ) в покое или во время нагрузки и рентгенографию грудной клетки . Эхокардиография может количественно оценить работу сердца, измеряя, например, увеличение левого желудочка , фракцию выброса и положение сердечных клапанов . Наиболее точными способами обнаружения ИБС являются коронарная ангиограмма и коронарная КТ-ангиография . [4] Ангиограмма может предоставить подробную анатомию коронарного кровообращения и поражений. Значимость каждого поражения определяется потерей диаметра. Потеря диаметра на 50% означает потерю площади поперечного сечения на 75%, что большинство групп считает умеренным. Тяжелый стеноз представляет собой потерю диаметра на 2/3 или более — более чем на 90% потерю площади поперечного сечения. [5] Для более точного определения тяжести стеноза интервенционные кардиологи могут также использовать внутрисосудистое ультразвуковое исследование , которое может определить тяжесть и предоставить информацию о составе атероматозной бляшки. С помощью техники фракционного резерва потока давление после стеноза сравнивается со средним аортальным давлением. Если соотношение меньше 0,80, то стеноз считается значительным. [5]
Людям со стенокардией во время физических упражнений обычно сначала назначают медикаментозную терапию. Неинвазивные тесты помогают оценить, каким пациентам может быть полезна коронарная ангиография. Как правило, если части сердечной стенки получают меньше крови, чем обычно, назначается коронарная ангиография; затем выявляются поражения и принимается решение о проведении ЧКВ или АКШ. [6]
CABG обычно предпочтительнее, чем PCI, когда есть значительное бремя бляшек на коронарных артериях, которое является обширным и сложным, из-за преимуществ для выживания. Другие показатели, что пациент получит больше пользы от CABG, чем PCI, включают: снижение функции левого желудочка; заболевание левой главной артерии ; диабет ; и сложное заболевание тройной системы (включая LAD, Cx и RCA), особенно когда поражение LAD находится в его проксимальной части. [2] [3]
Во время острого сердечного приступа, известного как острый коронарный синдром , крайне важно быстро восстановить приток крови к сердечной ткани. Обычно пациенты поступают в больницу с болью в груди. Сначала их лечат лекарственными препаратами, в частности, сильнейшими препаратами, которые предотвращают образование тромбов в сосудах (двойная антитромбоцитарная терапия: аспирин и клопидогрель ). Пациентам с риском продолжающейся ишемии проводят ЧКВ для восстановления кровотока и, следовательно, доставки кислорода к страдающему сердцу. [7] Если ЧКВ не удалось восстановить кровоток из-за анатомических особенностей или других технических проблем, показано срочное АКШ для сохранения сердечной ткани. Время операции играет роль в выживании: предпочтительно отложить операцию, если это возможно (три дня, если инфаркт затрагивает общую толщину сердечной мышцы, и шесть часов, если нет). [2]
АКШ также показано при наличии механических осложнений инфаркта ( дефект межжелудочковой перегородки , разрыв папиллярных мышц или разрыв миокарда). [8] Абсолютных противопоказаний к АКШ нет, но рассматриваются тяжелые заболевания других органов, таких как печень или мозг, ограниченная продолжительность жизни и слабость пациента. [8]
АКШ также выполняется, когда пациенту предстоит другая операция на сердце, чаще всего при клапанной болезни , и ангиография выявляет значительное поражение коронарных артерий. [9] АКШ также может решать проблему расслоения коронарных артерий, когда разрыв коронарных слоев создает псевдопросвет ( полость) и уменьшает доставку крови к сердцу. Такое расслоение может быть вызвано беременностью, заболеваниями тканей, такими как синдромы Элерса-Данлоса и синдром Марфана , злоупотреблением кокаином или ЧКВ. Коронарная аневризма также может указывать на АКШ: внутри сосуда может образоваться тромб и переместиться вниз по течению. [10]
АКШ и чрескожное коронарное вмешательство (ЧКВ) — два метода восстановления кровотока, вызванного стенотическими поражениями коронарных артерий. Выбор метода все еще является предметом дискуссий, но очевидно, что при наличии сложных поражений, значительного заболевания левой главной артерии или диабета АКШ обеспечивает лучшую долгосрочную выживаемость и результаты. [11] [10] Серьезные показания для АКШ также включают симптоматических пациентов и нарушение функции левого желудочка. [10] АКШ дает лучшие результаты, чем ЧКВ при заболевании левой главной артерии и при ИБС, которая поражает несколько сосудов, из-за защиты, которую артериальные кондуиты обеспечивают собственным артериям сердца, вырабатывая вазодилатирующие факторы и предотвращая продвижение бляшек. Исследования, опубликованные в 2023 году, показывают, что АКШ у пациентов с заболеванием левой главной артерии связано с более низкой смертностью и меньшим количеством нежелательных явлений по сравнению с ЧКВ. [12] [13]
Пациенты с незащищенным заболеванием левой главной артерии — когда отток левой главной артерии не защищен открытым трансплантатом после предыдущей операции АКШ — изучались как группа. Европейское исследование 2016 года показало, что у этих пациентов АКШ превосходит ЧКВ в долгосрочной перспективе (5 лет). Другое исследование 2016 года показало, что ЧКВ имеет схожие результаты с АКШ через 3 года, но АКШ становится лучше ЧКВ через 4 года. [14] [15]
Исследование 2012 года и последующее наблюдение за пациентами с диабетом продемонстрировали значительное преимущество АКШ перед ЧКВ. Относительное преимущество оставалось очевидным при 3,8-летнем и 7,5-летнем наблюдении, которое выявило особые преимущества у курильщиков и молодых пациентов. [16] Исследование 2015 года сравнило АКШ и последние технологические достижения ЧКВ, стенты с лекарственным покрытием второго поколения при многососудистом заболевании. Их результаты показали, что АКШ является лучшим вариантом для пациентов с ИБС. [17] Исследование, опубликованное в 2021 году, сравнивающее результаты через год, также пришло к выводу, что АКШ является более безопасным вариантом, чем ЧКВ. [18] Большое исследование, опубликованное в 2023 году, показало, что у пациентов с ЧКВ была более высокая смертность, чем у пациентов с АКШ с заболеванием левой главной коронарной артерии. [19]

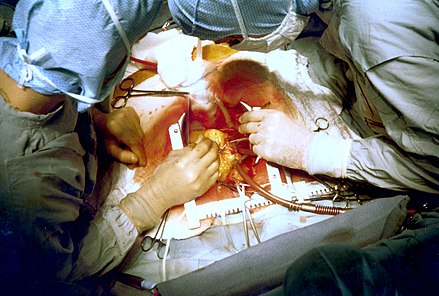
Рутинное предоперационное обследование направлено на проверку состояния систем и органов, помимо сердца. Обследование обычно включает рентгенографию грудной клетки для проверки легких, общий анализ крови , а также тесты на функцию почек и печени. Физическое обследование для определения качества трансплантатов или безопасности их удаления, например, варикозное расширение вен на ногах , или тест Аллена на руке проводится для того, чтобы убедиться, что кровоснабжение руки не будет критически нарушено. [20]
Пациент, принимающий антикоагулянты — аспирин , клопидогрель , тикагрелол и другие — прекратит их прием за несколько дней до операции, чтобы предотвратить чрезмерное кровотечение во время и после нее. Варфарин также прекращается по той же причине, и пациент начинает принимать гепариновые препараты после того, как МНО падает ниже 2,0. [20] [21]
После того, как ангиограмма будет рассмотрена хирургической бригадой, выбираются цели (то есть, какие собственные артерии будут обойдены и где должен быть размещен анастомоз). В идеале следует рассмотреть все основные поражения в значимых сосудах. Чаще всего левая внутренняя грудная артерия (LITA; ранее левая внутренняя грудная артерия, LIMA) анастомозируется с левой передней нисходящей артерией (LAD), поскольку LAD является наиболее значимой артерией сердца и снабжает кровью большую часть миокарда, чем другие артерии. [21]
Кондуит может быть использован для пересадки одной или нескольких собственных артерий. В последнем случае выполняется анастомоз конец в бок. В первом случае, используя последовательный анастомоз, трансплантат может затем доставлять кровь к двум или более собственным сосудам сердца. [21] Кроме того, проксимальная часть кондуита может быть анастомозирована с боковой стороной другого кондуита. Предпочтительно не забирать слишком много кондуита, поскольку это может потребовать повторной операции. [21]
Интубированного пациента доставляют в операционную . Для введения лекарств и мониторинга вводятся линии (например, периферические внутривенные канюли, центральные линии, такие как внутренняя яремная канюля). Далее следует описание традиционного аортокоронарного шунтирования (АКШ). [21]
Разрез грудины делается во время забора сосудов , либо из рук или груди, либо из ноги, обычно из внутренней грудной артерии или подкожной вены. LITA забирается через стернотомию. Существует два распространенных способа мобилизации LITA: ножка (т. е. ножка, состоящая из артерии плюс окружающий жир и вены) и скелетированная (т. е. освобожденная от других тканей). Перед тем, как LITA будет разделена в ее более дистальной части, антикоагулянт гепарин вводится пациенту через периферическую линию, чтобы предотвратить образование тромбов. [21]
После сбора перикард — мешок, который окружает сердце — вскрывается и накладываются швы-фиксаторы, чтобы удерживать его открытым. Кисетные швы накладываются на аорту, чтобы подготовить введение канюли в аорту, и катетер, который временно останавливает сердце с помощью раствора с высоким содержанием калия. Еще один кисетный шов помещается в правое предсердие для венозной канюли. После установки канюль и катетера начинается сердечно-легочное шунтирование (CPB). Деоксигенированная кровь, поступающая в сердце из вен, направляется в аппарат CPB для насыщения кислородом, а затем доставляется в аорту, чтобы поддерживать остальную часть тела насыщенной. Кровь часто охлаждают до 32–34 °C (90–93 °F), чтобы замедлить метаболизм и минимизировать потребность в кислороде. Зажим помещается на аорту между кардиоплегическим катетером и аортальной канюлей, так что поток кардиоплегического раствора может контролироваться регулировкой зажима. Через несколько минут сердце перестает биться. [21] [22]
При неподвижном сердце верхушка сердца вынимается из перикарда, чтобы были доступны собственные артерии, лежащие на задней стороне сердца. Обычно сначала строятся дистальные анастомозы (сначала с правой коронарной системой, затем с огибающей), а затем, при необходимости, последовательный анастомоз. Хирурги проверяют анастомоз на проходимость (достаточно ли он открыт) или на наличие утечки. Затем они вставляют трансплантат в перикард, иногда прикрепленный к кардиоплегическому катетеру. Анастомоз ЛВГА с ЛНА обычно является последним дистальным анастомозом, который должен быть построен; во время его построения начинается процесс согревания крови (с помощью АКБ). [21] После завершения анастомоза и проверки на наличие утечек следующими являются проксимальные анастомозы кондуитов, если таковые имеются. Их можно делать либо с надетым зажимом, либо после снятия зажима с аорты и изоляции небольшого сегмента аорты путем наложения частичного зажима. При этом аорты, обремененные бляшками, могут быть повреждены или высвободить атероматозные частицы из-за чрезмерного обращения. [21] [23]
После выполнения проксимальных анастомозов зажим снимается, а аорта и кондуиты деаэрируются. Могут быть установлены провода для стимуляции, которые подают ток для поддержки сердцебиения. Если сердце и другие системы функционируют, ИК прекращается, а канюли удаляются. Для устранения эффекта антикоагулянта гепарина вводится протамин . После проверки возможных мест кровотечения устанавливаются грудные дренажи и грудина закрывается. [21] [23]
Операция аортокоронарного шунтирования без искусственного кровообращения (OPCAB) позволяет избежать использования аппарата искусственного кровообращения, стабилизируя небольшие сегменты сердца за раз. Хирургическая бригада и анестезиологи должны координировать свои действия и проявлять большую осторожность, чтобы не слишком сильно манипулировать сердцем, чтобы не нарушить стабильность кровотока. Нарушение должно быть немедленно обнаружено и предприняты соответствующие действия. [24]
Поддержание здорового сердцебиения может включать такие маневры, как размещение предсердных проводов для защиты от брадикардии или наложение швов или надрезов на перикард для облегчения экспозиции. Для облегчения экспозиции используются петли и ленты. Цель состоит в том, чтобы избежать дистальной ишемии, вызванной закупоркой сосуда, снабжающего дистальные части левого желудочка, поэтому обычно первым анастомозируется LITA к LAD, а затем следуют другие. Для анастомоза тонкая трубка, продувающая увлажненный CO2 , сохраняет операционное поле чистым от крови. Также может использоваться шунт, чтобы кровь могла проходить мимо места анастомоза. После завершения дистальных анастомозов проксимальные анастомозы с аортой строятся с частично закрытым аортальным зажимом. Остальная часть процесса аналогична АКШ на искусственном кровообращении. [24]
Когда аортокоронарное шунтирование выполняется в экстренном порядке из-за инфаркта миокарда, наивысшим приоритетом является спасение борющегося миокарда. Перед операцией может быть установлен внутриаортальный баллонный насос (IABP), чтобы облегчить часть нагрузки по перекачиванию крови, эффективно уменьшая количество кислорода, необходимого миокарду. Во время операции стандартной практикой является как можно более раннее помещение пациента на ИК и реваскуляризация сердца тремя подкожными венами. Кальцифицированная аорта также представляет собой проблему, поскольку ее очень опасно пережимать. В этом случае операция может быть выполнена как аортокоронарное шунтирование без насоса с использованием как нижних брыжеечных артерий (IMA), так и Y, T и последовательных трансплантатов. Глубокая остановка сердца может быть вызвана гипотермией , снижающей температуру тела до немного выше 20 °C (68 °F). [25] В случаях, когда значительная артерия полностью заблокирована, может быть возможным удалить бляшку и использовать то же отверстие в артерии для выполнения анастомоза. Эта техника называется эндартерэктомией и обычно выполняется в правой коронарной системе. [26]
Повторные операции аортокоронарного шунтирования (АКШ) (еще одна операция аортокоронарного шунтирования после предыдущей) вызывают трудности. Сердце может быть расположено слишком близко к грудине и, таким образом, подвергаться риску при повторном разрезании грудины, поэтому используется осциллирующая пила . Сердце может быть покрыто прочными спайками с регулирующими структурами. Врачи должны решить, следует ли заменять стареющие трансплантаты. Манипуляции с венозными трансплантатами избегаются, поскольку это может привести к смещению бляшки. [27]
Минимально инвазивное прямое аортокоронарное шунтирование (MIDCAB) стремится избежать большого разреза в грудине. Он использует методы без искусственного кровообращения для размещения трансплантата, обычно LIMA в LAD. LIMA освобождается через разрез между левыми ребрами (торактомия) или даже с помощью эндоскопа, помещенного в левую часть груди. [28] Роботизированная коронарная реваскуляризация, которая пока не получила широкого распространения, избегает разреза грудины для предотвращения инфекций и кровотечения. Как забор кондуита, так и анастомоз выполняются с помощью робота через торакотомию. Обычно процедура сочетается с гибридной коронарной реваскуляризацией , при которой используются оба метода: АКШ и ЧКВ. Анастомоз LIMA к LAD выполняется в операционной, а другие поражения лечатся с помощью ЧКВ — либо в операционной сразу после анастомоза, либо через несколько дней. [29]
После процедуры пациента обычно переводят в отделение интенсивной терапии (ОИТ), где интубации удаляются, если они еще не сделаны в операционной. Обычно они покидают ОИТ на следующий день, а через четыре дня, если не возникает никаких осложнений, пациента выписывают из больницы. [30]
Ряд препаратов обычно используется в раннем послеоперационном уходе. Добутамин , бета-агент, может увеличить сердечный выброс и вводится через несколько часов после операции. Бета-блокаторы используются для предотвращения мерцательной аритмии и других наджелудочковых аритмий. Провода для стимуляции, прикрепленные к обоим предсердиям, вставленные во время операции, могут помочь предотвратить мерцательную аритмию. Аспирин (80 мг) используется для предотвращения отторжения трансплантата. [30] Ингибиторы ангиотензинпревращающего фермента (АПФ) и блокаторы рецепторов ангиотензина (БРА) используются для контроля артериального давления, особенно у пациентов с низкой сердечной функцией (<40%). Амлодипин , блокатор кальциевых каналов, используется для пациентов, у которых лучевая артерия использовалась в качестве трансплантата. [2]
После выписки пациенты могут испытывать бессонницу, плохой аппетит, снижение полового влечения и проблемы с памятью. Этот эффект обычно временный и длится от 6 до 8 недель. [30] Индивидуально разработанный план упражнений обычно полезен. [30]
АКШ является лучшей процедурой для снижения смертности от тяжелой ИБС и улучшения качества жизни. [31] [32] : 153 Операционная смертность тесно связана с возрастом пациента. Согласно исследованию Eagle et al ., у пациентов в возрасте 50–59 лет операционная смертность составляет 1,8%, в то время как у пациентов старше 80 лет этот показатель составляет 8,3%. [33] Другими факторами, увеличивающими смертность, являются женский пол, повторная операция, дисфункция левого желудочка и заболевание левой главной артерии . [33] АКШ обычно снимает стенокардию, но у некоторых пациентов она возникает повторно. Около 60% пациентов не будут страдать стенокардией через 10 лет после операции. [33] Инфаркт миокарда редко встречается через пять лет после АКШ, но его риск увеличивается со временем. [34] Риск внезапной смерти у пациентов с АКШ низкий. [34] Качество жизни также высокое в течение как минимум пяти лет, затем может медленно начать снижаться. [35] Однако использование двусторонней грудной артерии у пациентов молодого возраста и у тех, у кого нет специфических сопутствующих заболеваний (диабет, ожирение, прием стероидов), может обеспечить отличную долгосрочную выживаемость и качество жизни. [36]
Благоприятные эффекты АКШ очевидны на сердечном уровне. Функция левого желудочка улучшается, и неисправные сегменты сердца — дискинетические (движущиеся неэффективно) или даже акинетические (не двигающиеся) — могут показывать признаки улучшения. Как систолическая, так и диастолическая функции улучшаются и продолжают улучшаться в течение пяти лет в некоторых случаях. [37] Функция левого желудочка и перфузия миокарда во время упражнений также улучшаются после АКШ. Однако, когда левый желудочек серьезно поврежден перед операцией (фракция выброса ниже 30%), преимущества менее впечатляющие с точки зрения движения сегментарной стенки, но все же значимые, поскольку другие параметры могут улучшиться по мере улучшения функции ЛЖ; легочная гипертензия может быть облегчена и продлить выживаемость. [37] [38]
Определение общего риска процедуры затруднено из-за разнообразия пациентов, подвергающихся АКШ; разные подгруппы имеют разный риск, но у молодых пациентов результаты лучше, чем у пожилых. АКШ с использованием двух, а не одной, внутренних грудных артерий (ВГА) может обеспечить большую защиту от ИБС, но результаты пока не окончательные. [33] [39]
Каналы, которые могут быть использованы для АКШ, могут быть артериями или венами. Артерии имеют превосходную долгосрочную проходимость (расширяемость), но вены используются чаще из-за их практичности. [40]
Артериальные трансплантаты берут начало из части внутренней грудной артерии (ВГА), которая проходит около края грудины , и может быть легко мобилизована и анастомозирована с нативным целевым сосудом сердца. Левая артерия используется чаще всего, поскольку она ближе к сердцу, но иногда используется и правая артерия, в зависимости от предпочтений пациента и хирурга. ВГА имеют преимущество из-за их эндотелиальных клеток, которые вырабатывают эндотелиальный фактор релаксации и простациклин , защищая артерию от атеросклероза и, таким образом, стеноза или окклюзии. Недостатки включают высокий уровень осложнений, таких как глубокие инфекции ран грудины, у некоторых подгрупп пациентов — в основном страдающих ожирением и диабетом. Левая лучевая артерия и левая желудочно-сальниковая артерия также могут быть использованы. Долгосрочная проходимость зависит от типа используемой артерии и внутренних факторов сердечного артериального кровообращения. [41]
В качестве вен в основном используются большие подкожные вены и, в некоторых случаях, малая подкожная вена . Их проходимость ниже, чем у артерий. Аспирин защищает трансплантаты от окклюзии; добавление клопидогреля не улучшает показатели. [41]
CABG и PCI — два метода реваскуляризации стенотических поражений сердечных артерий. Предпочтения для каждого пациента все еще являются предметом дискуссий, но при наличии сложных поражений и значительного заболевания левой главной артерии, а также у пациентов с диабетом CABG, по-видимому, обеспечивает лучшие результаты у пациентов, чем PCI. [11] [10] Серьезные показания для CABG также включают симптоматических пациентов и пациентов с нарушенной функцией ЛЖ. [10]
Наиболее распространенными осложнениями аортокоронарного шунтирования являются послеоперационное кровотечение, сердечная недостаточность, мерцательная аритмия (форма аритмии), инсульт , нарушение функции почек и инфицирование раны около грудины. [38]
Послеоперационное кровотечение происходит в 2–5% случаев и может потребовать возвращения в операционную; [42] наиболее распространенным показателем является количество крови, дренируемой грудными дренажами , которые вставляются во время операции для дренирования жидкости или воздуха из грудной клетки. Кровотечение может происходить из аорты , анастомоза, недостаточно герметичной ветви кондуита или из грудины. Другие причины включают аномалии тромбоцитов или их неспособность к свертыванию — возможно, из-за шунтирования или эффекта отскока гепарина , который возникает, когда антикоагулянт гепарин вводится в начале операции и снова появляется в крови после его нейтрализации протамином . [ 43]
Синдром низкого сердечного выброса (ССН) может возникнуть у 14% пациентов с АКШ. В зависимости от тяжести ССН лечится инотропами , внутриаортальным баллонным насосом (ВАБН), оптимизацией преднагрузки и постнагрузки или коррекцией кровяных марлей и электролитов. Цель состоит в том, чтобы поддерживать систолическое артериальное давление выше 90 мм рт. ст. и сердечный индекс более 2,2 л/мин/м 2 . [38] ССН часто является транзиторным. [42] Инфаркт миокарда может возникнуть после операции из-за технических или индивидуальных факторов пациента. Его частоту трудно оценить из-за различных определений, но большинство исследований оценивают его частоту между 2% и 5%. Частота также зависит от того, является ли это изолированным АКШ (в среднем 4%, диапазон 0,3%–10%) или комбинированной операцией (в среднем 2,0%, диапазон 0,7%–12%). [44] Новые особенности электрокардиограммы, такие как зубцы Q или ультразвуковое документированное чередование движений сердечной стенки, являются показательными. Продолжающаяся ишемия может потребовать экстренной ангиографии и ЧКВ или повторной операции. [45] [42] Немедленная коронарная ангиография предлагает наиболее оперативный метод не только для диагностики, но и для потенциального повторного вмешательства. [46] Эхокардиография менее ценна для обнаружения или подтверждения послеоперационной ишемии миокарда. [47] Также могут возникать аритмии, чаще всего мерцательная аритмия (частота 20–40%), которая лечится коррекцией баланса электролитов и контролем частоты и ритма. [42] [38] Однако аритмия, такая как желудочковая тахикардия или фибрилляция, может быть признаком послеоперационной ишемии миокарда, которая лечится в зависимости от причины. [48]
Неблагоприятные неврологические эффекты возникают после АКШ примерно у 1,5% пациентов. [42] Они могут проявляться как дефициты типа 1 — очаговые дефициты, такие как инсульт или кома , — или глобальные дефициты типа 2, такие как делирий, вызванный АКШ, гипоперфузией или церебральной эмболией. [38] Когнитивные нарушения были зарегистрированы в 80% случаев после АКШ при выписке и длятся в течение года в 40% случаев. Причина остается неясной; АКШ является маловероятной причиной, потому что даже у пациентов АКШ без АКШ, как и у пациентов с АКШ без искусственного кровообращения, и пациентов с ЧКВ частота одинакова. [38] [39]
Инфекции, такие как раневые инфекции в грудине (поверхностные или глубокие), чаще всего вызываются золотистым стафилококком и могут осложнить послеоперационный процесс. Изъятие обеих грудных артерий является фактором риска, поскольку это значительно ухудшает перфузию крови через грудину. [38] Также может возникнуть пневмония . [42] Осложнения в желудочно-кишечном тракте были описаны и чаще всего связаны с лекарствами, вводимыми во время операции. [39]

В начале 20-го века хирургические вмешательства, направленные на облегчение стенокардии и предотвращение смерти, представляли собой либо симпатэктомию — разрез симпатической цепи , которая снабжает сердце, либо перикардиальную абразию с надеждой, что спайки создадут значительное коллатеральное кровообращение. Симпатэктомия дала разочаровывающие и непоследовательные результаты. [50] Французский хирург Алексис Каррель был первым, кто анастомозировал сосуд — ветвь сонной артерии — с собственной артерией в сердце собаки, но эксперимент не удалось воспроизвести. [51] В середине 20-го века попытки реваскуляризации продолжались. Beck CS использовал каротидный кондуит для соединения нисходящей аорты с коронарным синусом , самой большой веной сердца. В «процедуре Винеберга» Артур Винеберг использовал скелетированную LITA, поместив ее в небольшой туннель, который он создал рядом с LAD, и надеясь, что сформируется спонтанное коллатеральное кровообращение. Это происходило в экспериментах на собаках, но не у людей. Goetz RH был первым, кто выполнил анастомоз внутренней сосудистой артерии с левой бедренной артерией в 1960 году, используя бесшовную технику. [50]
Разработка коронарной ангиографии в 1962 году Мейсоном Сонесом помогла врачам выявлять пациентов, нуждающихся в операции, и какие собственные сосуды сердца следует обойти. [52] В 1964 году советский кардиохирург Василий Колесов выполнил первый успешный анастомоз внутренней грудной артерии с коронарной артерией, за ним последовал Майкл Дебейки в Соединенных Штатах. Аргентинский хирург Рене Фавалоро стандартизировал процедуру. Их достижения сделали АКШ стандартом лечения пациентов с ИБС. [53]
Современная эра аортокоронарного шунтирования началась в 1964 году, когда советский кардиохирург Василий Колесов выполнил первый успешный анастомоз внутренней грудной артерии с коронарной артерией. В том же году американский хирург Майкл Дебейки использовал подкожную вену для создания аортокоронарного шунтирования. Аргентинский хирург Рене Фавалоро усовершенствовал и стандартизировал технику аортокоронарного шунтирования с использованием подкожной вены пациента. [53]
Введение остановки сердца во время операции (кардиоплегии) сделало АКШ гораздо менее рискованным. Главным препятствием АКШ были ишемия и инфаркт, возникающие во время остановки сердца, чтобы позволить хирургам построить дистальный анастомоз. В 1970-х годах использовалась кардиоплегия на основе калия. Кардиоплегия минимизировала потребность сердца в кислороде, тем самым уменьшая последствия ишемии. Усовершенствование кардиоплегии в 1980-х годах сделало АКШ менее рискованным, снизив смертность во время операции. [54]
В конце 1960-х годов, после работы Рене Фавалоро, операция проводилась только в нескольких центрах, но ожидалось, что она в более широком смысле изменит исход ишемической болезни сердца. К 1979 году в США проводилось 114 000 процедур в год. Внедрение чрескожного коронарного вмешательства (ЧКВ) не отменило АКШ; частота обеих процедур продолжала расти, но ЧКВ росли быстрее. В последующие десятилетия АКШ широко изучалось и сравнивалось с ЧКВ. Отсутствие явного преимущества АКШ над ЧКВ привело к небольшому снижению числа АКШ в некоторых странах (например, в США) к 2000 году. В Европе, в основном в Германии, АКШ выполнялось все чаще. По состоянию на 2023 год [обновлять]исследования, сравнивающие эти две методики, продолжаются. [55] Метаанализ, опубликованный в 2023 году, предполагает, что АКШ обеспечивает стабильное преимущество в выживании по сравнению с ЧКВ со стентами с лекарственным покрытием (СЛП). [56]
Работа Фавалоро имеет основополагающее значение для истории выбора трансплантата. Он установил, что использование двусторонних ВГА превосходит венозные трансплантаты. Хирурги исследовали использование других артериальных трансплантатов — селезеночного, желудочно-сальникового, брыжеечного, подлопаточного и других — но ни один из них не достиг показателей проходимости ВГА. В 1971 году Карпентье ввел использование лучевой артерии, которая изначально была склонна к неудачам, но развитие методов забора в последующие 20 лет значительно улучшило проходимость. [57]
Свиньи, овцы и собаки использовались в качестве экспериментальных моделей для разработки аортокоронарного шунтирования. [58] Однако проведение аортокоронарного шунтирования для лечения больных животных встречается крайне редко. [59]