Ацетилхолин ( АХ ) — это органическое соединение , которое функционирует в мозге и организме многих видов животных (включая человека) как нейромедиатор . [1] Его название происходит от его химической структуры: это сложный эфир уксусной кислоты и холина . [2] Части тела, которые используют или подвергаются воздействию ацетилхолина, называются холинергическими .
Ацетилхолин — это нейротрансмиттер, используемый в нервно-мышечном соединении , другими словами, это химическое вещество, которое высвобождают двигательные нейроны нервной системы для активации мышц. Это свойство означает, что препараты, влияющие на холинергические системы, могут иметь очень опасные эффекты, начиная от паралича и заканчивая судорогами . Ацетилхолин также является нейротрансмиттером в автономной нервной системе , как в качестве внутреннего передатчика для симпатической и парасимпатической нервной системы , так и в качестве конечного продукта, высвобождаемого парасимпатической нервной системой. [1] Ацетилхолин является основным нейротрансмиттером парасимпатической нервной системы. [2] [3]
В мозге ацетилхолин функционирует как нейротрансмиттер и как нейромодулятор . Мозг содержит ряд холинергических областей, каждая из которых имеет свои собственные функции; например, играет важную роль в возбуждении , внимании , памяти и мотивации . [4] Ацетилхолин также был обнаружен в клетках не-нейронного происхождения, а также в микробах. Недавно ферменты, связанные с его синтезом, деградацией и клеточным поглощением, были прослежены до ранних истоков одноклеточных эукариот. [5] Простейший патоген Acanthamoeba spp. продемонстрировал доказательства присутствия ACh, который обеспечивает рост и пролиферативные сигналы через гомолог мускаринового рецептора M1, расположенный на мембране. [6]
Частично из-за его функции активации мышц, но также из-за его функций в автономной нервной системе и мозге, многие важные препараты оказывают свое действие, изменяя холинергическую передачу. Многочисленные яды и токсины, вырабатываемые растениями, животными и бактериями, а также химические нервно-паралитические агенты, такие как зарин , наносят вред, инактивируя или гиперактивируя мышцы посредством их влияния на нервно-мышечное соединение. Препараты, которые действуют на мускариновые ацетилхолиновые рецепторы , такие как атропин , могут быть ядовитыми в больших количествах, но в меньших дозах они обычно используются для лечения определенных заболеваний сердца и проблем со зрением. [7] [8] Скополамин или дифенгидрамин , которые также действуют в основном на мускариновые рецепторы ингибирующим образом в мозге (особенно на рецептор M 1 ), могут вызывать делирий , галлюцинации и амнезию посредством антагонизма рецепторов в этих местах. По состоянию на 2016 год только подтип рецептора М 1 был связан с антихолинергическим делирием. [9] Привыкающие свойства никотина обусловлены его воздействием на никотиновые ацетилхолиновые рецепторы в мозге.
Ацетилхолин — это молекула холина , ацетилированная по атому кислорода . Из-за заряженной аммониевой группы ацетилхолин не проникает через липидные мембраны. Из-за этого при введении молекулы извне она остается во внеклеточном пространстве и в настоящее время считается , что молекула не проходит через гематоэнцефалический барьер.
Ацетилхолин синтезируется в некоторых нейронах ферментом холинацетилтрансферазой из соединений холина и ацетил-КоА . Холинергические нейроны способны вырабатывать АХ. Примером центральной холинергической области является базальное ядро Мейнерта в базальном переднем мозге. [10] [ 11] Фермент ацетилхолинэстераза превращает ацетилхолин в неактивные метаболиты холин и ацетат . Этот фермент в изобилии содержится в синаптической щели, и его роль в быстром выведении свободного ацетилхолина из синапса необходима для правильной работы мышц. Некоторые нейротоксины работают путем ингибирования ацетилхолинэстеразы, что приводит к избытку ацетилхолина в нервно-мышечном соединении , вызывая паралич мышц, необходимых для дыхания, и остановку биения сердца.

Ацетилхолин функционирует как в центральной нервной системе (ЦНС), так и в периферической нервной системе (ПНС). В ЦНС холинергические проекции от базального переднего мозга к коре головного мозга и гиппокампу поддерживают когнитивные функции этих целевых областей. В ПНС ацетилхолин активирует мышцы и является основным нейромедиатором в автономной нервной системе. [12] [2]
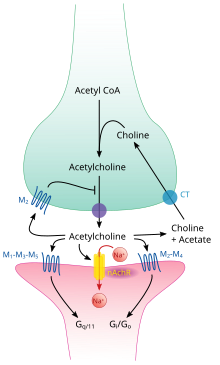
Как и многие другие биологически активные вещества, ацетилхолин оказывает свое действие, связываясь с рецепторами, расположенными на поверхности клеток, и активируя их. Существует два основных класса ацетилхолиновых рецепторов: никотиновые и мускариновые . Они названы в честь химических веществ, которые могут избирательно активировать каждый тип рецептора, не активируя другой: мускарин — это соединение, обнаруженное в грибе Amanita muscaria ; никотин обнаружен в табаке.
Никотиновые ацетилхолиновые рецепторы — это лиганд-зависимые ионные каналы, проницаемые для ионов натрия , калия и кальция . Другими словами, это ионные каналы, встроенные в клеточные мембраны, способные переключаться из закрытого в открытое состояние, когда с ними связывается ацетилхолин; в открытом состоянии они позволяют ионам проходить через них. Никотиновые рецепторы бывают двух основных типов, известных как мышечные и нейрональные. Мышечный тип может быть избирательно заблокирован кураре , нейрональный тип — гексаметонием . Основное расположение рецепторов мышечного типа — мышечные клетки, как более подробно описано ниже. Рецепторы нейронального типа расположены в вегетативных ганглиях (как симпатических, так и парасимпатических) и в центральной нервной системе.
Мускариновые ацетилхолиновые рецепторы имеют более сложный механизм и воздействуют на клетки-мишени в течение более длительного периода времени. У млекопитающих было идентифицировано пять подтипов мускариновых рецепторов, обозначенных как M1–M5. Все они функционируют как рецепторы, сопряженные с G-белком , что означает , что они оказывают свое действие через систему вторичных мессенджеров . Подтипы M1, M3 и M5 являются Gq - сопряженными; они повышают внутриклеточные уровни IP3 и кальция , активируя фосфолипазу C. Их действие на клетки-мишени обычно возбуждающее. Подтипы M2 и M4 являются Gi /Go - сопряженными; они снижают внутриклеточные уровни цАМФ , ингибируя аденилатциклазу . Их действие на клетки-мишени обычно ингибирующее. Мускариновые ацетилхолиновые рецепторы обнаружены как в центральной нервной системе , так и в периферической нервной системе сердца, легких, верхнего отдела желудочно-кишечного тракта и потовых желез.
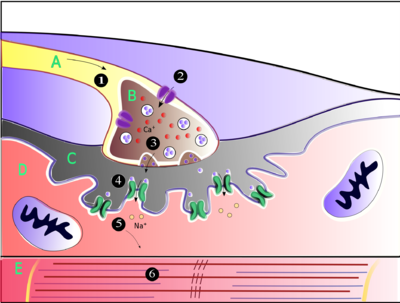
Ацетилхолин — это вещество, которое нервная система использует для активации скелетных мышц , разновидности поперечно-полосатых мышц. Эти мышцы используются для всех типов произвольных движений, в отличие от гладкой мышечной ткани , которая участвует в ряде непроизвольных действий, таких как перемещение пищи по желудочно-кишечному тракту и сужение кровеносных сосудов. Скелетные мышцы напрямую контролируются двигательными нейронами, расположенными в спинном мозге или, в некоторых случаях, в стволе мозга . Эти двигательные нейроны посылают свои аксоны через двигательные нервы , из которых они выходят, чтобы подключиться к мышечным волокнам в особом типе синапса, называемом нервно-мышечным соединением .
Когда двигательный нейрон генерирует потенциал действия , он быстро перемещается по нерву, пока не достигнет нервно-мышечного соединения, где он инициирует электрохимический процесс, который вызывает высвобождение ацетилхолина в пространство между пресинаптическим окончанием и мышечным волокном. Затем молекулы ацетилхолина связываются с рецепторами никотиновых ионных каналов на мембране мышечной клетки, заставляя ионные каналы открываться. Затем ионы натрия поступают в мышечную клетку, инициируя последовательность шагов, которые в конечном итоге вызывают сокращение мышцы .
Факторы, которые уменьшают высвобождение ацетилхолина (и тем самым влияют на кальциевые каналы P-типа ): [13]
Блокаторы кальциевых каналов (нифедипин, дилтиазем) не влияют на P-каналы. Эти препараты влияют на кальциевые каналы L-типа .
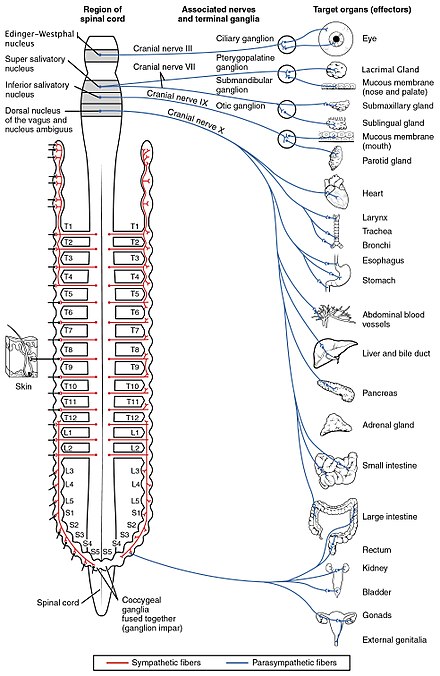
Автономная нервная система контролирует широкий спектр непроизвольных и бессознательных функций организма. Ее основными ветвями являются симпатическая нервная система и парасимпатическая нервная система . В широком смысле, функция симпатической нервной системы заключается в мобилизации организма для действия; для ее описания часто используется фраза « бей или беги» . Функция парасимпатической нервной системы заключается в приведении организма в состояние, благоприятствующее отдыху, регенерации, пищеварению и воспроизводству; для ее описания часто используется фраза «отдыхай и переваривай» или «корми и размножайся». Обе эти вышеупомянутые системы используют ацетилхолин, но по-разному.
На схематическом уровне симпатическая и парасимпатическая нервные системы организованы по сути одинаково: преганглионарные нейроны в центральной нервной системе посылают проекции нейронам, расположенным в вегетативных ганглиях, которые посылают выходные проекции практически в каждую ткань тела. В обеих ветвях внутренние связи, проекции от центральной нервной системы к вегетативным ганглиям, используют ацетилхолин в качестве нейротрансмиттера для иннервации (или возбуждения) нейронов ганглиев. В парасимпатической нервной системе выходные связи, проекции от нейронов ганглиев к тканям, которые не принадлежат нервной системе, также выделяют ацетилхолин, но действуют на мускариновые рецепторы. В симпатической нервной системе выходные связи в основном выделяют норадреналин , хотя ацетилхолин выделяется в нескольких точках, таких как судомоторная иннервация потовых желез.
Ацетилхолин в сыворотке оказывает прямое влияние на сосудистый тонус , связываясь с мускариновыми рецепторами, присутствующими на сосудистом эндотелии . Эти клетки реагируют увеличением продукции оксида азота , который дает сигнал окружающим гладким мышцам расслабиться, что приводит к вазодилатации . [14]

В центральной нервной системе АХ оказывает разнообразное воздействие на пластичность, возбуждение и вознаграждение . АХ играет важную роль в повышении бдительности при пробуждении [15] , в поддержании внимания [16] и в обучении и памяти [17] .
Было показано, что повреждение холинергической (ацетилхолинпродуцирующей) системы мозга связано с дефицитом памяти, связанным с болезнью Альцгеймера . [18] Также было показано, что АХ способствует быстрому сну. [19]
В стволе мозга ацетилхолин вырабатывается в педункулопонтийном ядре и латеродорсальном тегментальном ядре, которые вместе известны как мезопонтийная область покрышки или понтомезэнцефалотегментальный комплекс. [20] [21] В базальном переднем мозге он вырабатывается в базальном ядре Мейнерта и медиальном септальном ядре :
Кроме того, ACh действует как важный внутренний передатчик в полосатом теле , которое является частью базальных ганглиев . Он высвобождается холинергическими интернейронами . У людей, нечеловеческих приматов и грызунов эти интернейроны реагируют на заметные внешние стимулы ответами, которые по времени совпадают с ответами дофаминергических нейронов черной субстанции . [22] [23]
Ацетилхолин участвует в обучении и памяти несколькими способами. Антихолинергический препарат скополамин ухудшает получение новой информации у людей [24] и животных. [17] У животных нарушение подачи ацетилхолина в неокортекс ухудшает обучение простым задачам различения, сравнимым с получением фактической информации [25] , а нарушение подачи ацетилхолина в гиппокамп и смежные корковые области вызывает забывчивость, сравнимую с антероградной амнезией у людей. [26]
Заболевание миастения гравис , характеризующееся мышечной слабостью и утомляемостью, возникает, когда организм ненадлежащим образом вырабатывает антитела против никотиновых рецепторов ацетилхолина и, таким образом, подавляет правильную передачу сигнала ацетилхолина. [27] Со временем концевая пластинка моторного нерва разрушается. Препараты, которые конкурентно ингибируют ацетилхолинэстеразу (например, неостигмин , физостигмин или, прежде всего, пиридостигмин ), эффективны в лечении симптомов этого расстройства. [28] Они дают эндогенно высвобождаемому ацетилхолину больше времени для взаимодействия с соответствующим ему рецептором, прежде чем он будет инактивирован ацетилхолинэстеразой в синаптической щели (пространстве между нервом и мышцей).
Блокирование, подавление или имитация действия ацетилхолина имеет множество применений в медицине. Препараты, действующие на систему ацетилхолина, являются либо агонистами рецепторов, стимулируя систему, либо антагонистами, ингибируя ее. Агонисты и антагонисты ацетилхолиновых рецепторов могут либо оказывать прямое воздействие на рецепторы, либо оказывать свое воздействие косвенно, например, воздействуя на фермент ацетилхолинэстеразу , который разрушает лиганд рецептора. Агонисты повышают уровень активации рецептора; антагонисты снижают его.
Сам по себе ацетилхолин не имеет терапевтической ценности как препарат для внутривенного введения из-за его многогранного действия (неселективного) и быстрой инактивации холинэстеразой. Однако его используют в виде глазных капель для сужения зрачка при операциях по удалению катаракты, что способствует быстрому послеоперационному восстановлению.
Никотин связывается с никотиновыми ацетилхолиновыми рецепторами и активирует их , имитируя действие ацетилхолина на эти рецепторы. ACh открывает Na + -канал при связывании, так что Na + поступает в клетку. Это вызывает деполяризацию и приводит к возбуждающему постсинаптическому потенциалу. Таким образом, ACh оказывает возбуждающее действие на скелетные мышцы; электрический ответ быстрый и кратковременный. Кураре — это яды для стрел, которые действуют на никотиновые рецепторы и использовались для разработки клинически полезных методов лечения.
Мускариновые рецепторы образуют комплексы рецепторов, сопряженных с G-белком, в клеточных мембранах нейронов и других клеток. Атропин является неселективным конкурентным антагонистом ацетилхолина в мускариновых рецепторах.
Многие агонисты рецепторов ACh действуют косвенно, ингибируя фермент ацетилхолинэстеразу . Накопление ацетилхолина вызывает постоянную стимуляцию мышц, желез и центральной нервной системы, что может привести к фатальным судорогам, если доза высока.
Они являются примерами ингибиторов ферментов и усиливают действие ацетилхолина, задерживая его деградацию; некоторые из них использовались в качестве нервно-паралитических агентов ( зарин и нервно-паралитический газ VX ) или пестицидов ( органофосфаты и карбаматы ). Многие токсины и яды, вырабатываемые растениями и животными, также содержат ингибиторы холинэстеразы. В клинической практике их вводят в низких дозах [ почему? ] для отмены действия миорелаксантов , для лечения миастении и для лечения симптомов болезни Альцгеймера ( ривастигмин , который увеличивает холинергическую активность в мозге).
Органические ртутные соединения, такие как метилртуть , имеют высокое сродство к сульфгидрильным группам , что вызывает дисфункцию фермента холинацетилтрансферазы. Это ингибирование может привести к дефициту ацетилхолина и иметь последствия для двигательной функции.
Ботулинический токсин (Ботокс) действует, подавляя высвобождение ацетилхолина, тогда как яд паука черная вдова ( альфа-латротоксин ) имеет обратный эффект. Ингибирование АХ вызывает паралич . При укусе паука черная вдова человек испытывает потерю запасов АХ, и мышцы начинают сокращаться. Если и когда запасы истощаются, наступает паралич .
Ацетилхолин используется организмами во всех сферах жизни для различных целей. Считается, что холин , предшественник ацетилхолина, использовался одноклеточными организмами миллиарды лет назад [ требуется цитата ] для синтеза фосфолипидов клеточной мембраны. [29] После эволюции переносчиков холина обилие внутриклеточного холина проложило путь для включения холина в другие синтетические пути, включая производство ацетилхолина. Ацетилхолин используется бактериями, грибами и множеством других животных. Многие из применений ацетилхолина основаны на его действии на ионные каналы через GPCR, подобные мембранным белкам.
Два основных типа ацетилхолиновых рецепторов, мускариновые и никотиновые рецепторы, конвергентно эволюционировали, чтобы реагировать на ацетилхолин. Это означает, что вместо того, чтобы эволюционировать из общего гомолога, эти рецепторы эволюционировали из отдельных семейств рецепторов. По оценкам, семейство никотиновых рецепторов существует более 2,5 миллиардов лет. [29] Аналогично, считается, что мускариновые рецепторы отделились от других GPCR по крайней мере 0,5 миллиарда лет назад. Обе эти группы рецепторов эволюционировали в многочисленные подтипы с уникальным сродством к лигандам и сигнальными механизмами. Разнообразие типов рецепторов позволяет ацетилхолину создавать различные ответы в зависимости от того, какие типы рецепторов активированы, и позволяет ацетилхолину динамически регулировать физиологические процессы. Рецепторы ACh связаны с рецепторами 5-HT3 ( серотонина ), ГАМК и глицина как по последовательности, так и по структуре, что убедительно свидетельствует об их общем эволюционном происхождении. [30]
В 1867 году Адольф фон Байер определил структуры холина и ацетилхолина и синтезировал их оба, назвав последний в исследовании « ацетилнейрином ». [31] [32] Холин является предшественником ацетилхолина. Вот почему Фредерик Уокер Мотт и Уильям Добинсон Халлибертон отметили в 1899 году, что инъекции холина снижают кровяное давление у животных. [33] [32] Впервые было отмечено, что ацетилхолин является биологически активным в 1906 году, когда Рид Хант (1870–1948) и Рене де М. Таво обнаружили, что он снижает кровяное давление в исключительно малых дозах. [34] [32] [35]
В 1914 году Артур Дж. Эвинс был первым, кто извлек ацетилхолин из природы. Он идентифицировал его как снижающий кровяное давление загрязнитель из некоторых экстрактов спорыньи Claviceps purpurea по просьбе Генри Халлетта Дейла . [32] Позже в 1914 году Дейл описал эффекты ацетилхолина на различные типы периферических синапсов, а также отметил, что он снижает кровяное давление у кошек при подкожных инъекциях даже в дозах в один нанограмм . [36] [32]
Концепция нейротрансмиттеров была неизвестна до 1921 года, когда Отто Леви, работая профессором в Университете Граца , заметил, что блуждающий нерв выделяет вещество, которое подавляет сердечную мышцу . Он назвал его vagusstoff («вещество блуждающего нерва»), отметил, что оно является структурным аналогом холина, и предположил, что это ацетилхолин. [37] [38] В 1926 году Леви и Э. Навратил пришли к выводу, что это соединение, вероятно, является ацетилхолином, поскольку vagusstoff и синтетический ацетилхолин теряли свою активность аналогичным образом при контакте с тканевыми лизатами , содержащими ферменты, разрушающие ацетилхолин (теперь известные как холинэстеразы ). [39] [40] Этот вывод был широко принят. Более поздние исследования подтвердили функцию ацетилхолина как нейротрансмиттера . [38]
В 1936 году Х. Х. Дейл и О. Лёви разделили Нобелевскую премию по физиологии и медицине за исследования ацетилхолина и нервных импульсов. [32]
связан только с антагонизмом постсинаптических рецепторов M1, и на сегодняшний день другие подтипы рецепторов не были вовлечены.