
Бета-лактамазы ( β-лактамазы ) — это ферменты ( КФ 3.5.2.6), продуцируемые бактериями , которые обеспечивают множественную устойчивость к бета-лактамным антибиотикам , таким как пенициллины , цефалоспорины , цефамицины , монобактамы и карбапенемы ( эртапенем ), хотя карбапенемы относительно устойчивы к бета-лактамазы. Бета-лактамазы обеспечивают устойчивость к антибиотикам, разрушая структуру антибиотиков . Все эти антибиотики имеют общий элемент в своей молекулярной структуре: четырехатомное кольцо, известное как бета-лактамное (β-лактамное) кольцо. В результате гидролиза фермент лактамаза разрывает кольцо β-лактама, деактивируя антибактериальные свойства молекулы.
Бета-лактамазы, продуцируемые грамотрицательными бактериями, обычно секретируются, особенно при наличии в окружающей среде антибиотиков. [1]
Структура сериновой β-лактамазы (SBL) Streptomyces представлена 1BSG. Альфа-бета-складка ( InterPro : IPR012338 ) напоминает складку DD-транспептидазы , из которой, как полагают, произошел фермент. β-лактамные антибиотики связываются с DD-транспептидазами, ингибируя биосинтез клеточной стенки бактерий. Сериновые β-лактамазы по сходству последовательностей группируются на типы A, C и D.
Другой тип бета-лактамаз относится к типу металло («тип B»). Металло-бета-лактамазы (MBL) нуждаются в ионе(ах) металла (1 или 2 иона Zn 2+ [2] ) в своем активном центре для своей каталитической активности. [3] Структура металло-бета-лактамазы Нью-Дели 1 представлена 6C89. Он напоминает РНКазу Z , из которой, как полагают, он произошел.
Два типа бета-лактамаз действуют на основе двух основных механизмов раскрытия β-лактамного кольца. [2]
SBL по структуре и механизму сходны с β-лактамными мишенями пенициллин-связывающих белков (PBP), которые необходимы для построения и модификации клеточной стенки. И SBL, и PBP ковалентно изменяют остаток серина в активном центре. Разница между PBP и SBL заключается в том, что последний генерирует свободный фермент и неактивный антибиотик за счет очень быстрого гидролиза промежуточного ацил-фермента. [ нужна цитата ]
MBL используют ионы Zn 2+ для активации молекулы воды в месте связывания для гидролиза β-лактамного кольца. Хелаторы цинка недавно были исследованы как ингибиторы металло-β-лактамаз, поскольку они часто способны восстанавливать чувствительность к карбапенемам. [4]
Пенициллиназа представляет собой особый тип β-лактамазы, проявляющий специфичность к пенициллинам , опять же за счет гидролиза β-лактамного кольца . Молекулярные массы различных пенициллиназ имеют тенденцию группироваться около 50 килодальтон.
Пенициллиназа была первой идентифицированной β-лактамазой. Впервые он был выделен Абрахамом и Чейном в 1940 году из E. coli (грамотрицательной) еще до того, как пенициллин начал использоваться в клинической практике [5] , но продукция пенициллиназы быстро распространилась на бактерии, которые ранее ее не продуцировали или производили лишь изредка. Были разработаны устойчивые к пенициллиназе бета-лактамы, такие как метициллин , но в настоящее время широко распространена устойчивость даже к ним.
Среди грамотрицательных бактерий серьезную озабоченность вызывает появление устойчивости к цефалоспоринам расширенного спектра действия. Первоначально он появился у ограниченного числа видов бактерий ( E. cloacae , C. freundii , S. marcescens и P. aeruginosa ), которые могли мутировать с гиперпродукцией хромосомной β-лактамазы класса C. Несколько лет спустя у видов бактерий, не продуцирующих в природе ферменты AmpC ( K. pneumoniae , Salmonella spp., P. mirabilis ), появилась устойчивость за счет продукции ESBL TEM- или SHV-типа (бета-лактамаз расширенного спектра). Характерно, что такая устойчивость включала оксиимино- (например, цефтизоксим , цефотаксим , цефтриаксон и цефтазидим , а также оксииминомонобактам азтреонам ), но не 7-альфа-метоксицефалоспорины ( цефамицины ; другими словами, цефокситин и цефотетан ). ; блокировался такими ингибиторами, как клавуланат , сульбактам или тазобактам , и не включал карбапенемы и темоцилин . Хромосомно-опосредованные β-лактамазы AmpC представляют собой новую угрозу, поскольку они придают устойчивость к 7-альфа-метоксицефалоспоринам ( цефамицинам ), таким как цефокситин или цефотетан , но на них не влияют коммерчески доступные ингибиторы β-лактамаз, а у штаммов с потеря поринов внешней мембраны обеспечивает устойчивость к карбапенемам. [6]
Члены этого семейства обычно экспрессируют β-лактамазы (например, TEM-3, TEM-4, [7] и SHV-2 [8] ), которые придают устойчивость к цефалоспоринам расширенного спектра (расширенного спектра). В середине 1980-х годов была обнаружена новая группа ферментов — β-лактамазы расширенного спектра действия (ESBL) (впервые обнаружены в 1979 году). [9] Распространенность бактерий, продуцирующих ESBL, постепенно увеличивается в больницах неотложной помощи. [10] Распространенность среди населения в целом варьируется в зависимости от страны, например, примерно 6% в Германии [11] и Франции, [12] 13% в Саудовской Аравии, [13] и 63% в Египте. [14] ESBL представляют собой бета-лактамазы, которые гидролизуют цефалоспорины расширенного спектра действия с оксиимино боковой цепью. К этим цефалоспоринам относятся цефотаксим , цефтриаксон и цефтазидим , а также оксиимино-монобактам азтреонам . Таким образом, ESBL придают множественную устойчивость к этим антибиотикам и родственным оксиимино-бета-лактамам. В типичных обстоятельствах они происходят от генов TEM-1, TEM-2 или SHV-1 в результате мутаций, которые изменяют конфигурацию аминокислот вокруг активного сайта этих β-лактамаз. Более широкий набор β-лактамных антибиотиков подвержен гидролизу этими ферментами. В последнее время описывается все большее число ESBL, не принадлежащих к линии TEM или SHV. [15] ESBL часто кодируются плазмидами. Плазмиды, ответственные за продукцию ESBL, часто несут гены, кодирующие устойчивость к другим классам лекарств (например, аминогликозидам). Таким образом, возможности применения антибиотиков при лечении микроорганизмов, продуцирующих БЛРС, крайне ограничены. Карбапенемы являются препаратами выбора при серьезных инфекциях, вызванных микроорганизмами, продуцирующими ESBL, однако недавно появились сообщения об изолятах, устойчивых к карбапенемам (в первую очередь к эртапенему ). [16] Организмы, продуцирующие ESBL, могут оказаться чувствительными к некоторым цефалоспоринам расширенного спектра действия . Однако лечение такими антибиотиками связано с высокой частотой неудач. [ нужна цитата ]
ТЕМ-1 является наиболее часто встречающейся бета-лактамазой у грамотрицательных бактерий. До 90% устойчивости E. coli к ампициллину обусловлено выработкой ТЕМ-1. [17] Также ответственен за резистентность к ампициллину и пенициллину, которая наблюдается у H. influenzae и N. gonorrhoeae во все большем количестве. Хотя бета-лактамазы ТЕМ-типа чаще всего обнаруживаются в E. coli и K. pneumoniae , они все чаще обнаруживаются и у других видов грамотрицательных бактерий. Аминокислотные замены, ответственные за фенотип бета-лактамазы расширенного спектра (ESBL), группируются вокруг активного центра фермента и изменяют его конфигурацию, обеспечивая доступ к субстратам оксиимино-бета-лактама. Открытие активного центра для субстратов бета-лактамов также обычно повышает чувствительность фермента к ингибиторам β-лактамаз, таким как клавулановая кислота. Одиночные аминокислотные замены в положениях 104, 164, 238 и 240 приводят к фенотипу ESBL, но ESBL с самым широким спектром обычно имеют более одной аминокислотной замены. На основании различных комбинаций изменений в настоящее время описано 140 ферментов ТЕМ-типа. TEM-10, TEM-12 и TEM-26 являются одними из наиболее распространенных в США. [18] [19] [20] Термин ТЕМ происходит от имени афинского пациента (Темониера), у которого в 1963 году был выделен изолят. [21]
SHV-1 на 68 процентов разделяет аминокислоты с TEM-1 и имеет аналогичную общую структуру. Бета-лактамазы SHV-1 чаще всего обнаруживаются у K. pneumoniae и ответственны за до 20% плазмидно-опосредованной устойчивости к ампициллину у этого вида. ESBL этого семейства также имеют аминокислотные изменения вокруг активного центра, чаще всего в положениях 238 или 238 и 240. Известно более 60 разновидностей SHV. ШВ-5 и ШВ-12 относятся к числу наиболее распространенных. [18] Инициалы означают «переменная сульфгидрильного реагента». [22]
Эти ферменты получили свое название из-за их большей активности в отношении цефотаксима , чем других субстратов оксиимино-бета-лактамов (например, цефтазидима , цефтриаксона или цефепима ). Они не возникают в результате мутации, а представляют собой примеры приобретения плазмидами генов бета-лактамаз, обычно встречающихся в хромосомах видов Kluyvera , группы редко патогенных комменсальных организмов. Эти ферменты не очень тесно связаны с бета-лактамазами TEM или SHV, поскольку они лишь примерно на 40% идентичны этим двум обычно выделяемым бета-лактамазам. В настоящее время известно более 172 [23] ферментов СТХ-М. Несмотря на свое название, некоторые из них более активны в отношении цефтазидима , чем цефотаксима . Они широко описаны среди видов Enterobacteriaceae , главным образом E. coli и K. pneumoniae. Обнаруженные в 1980-х годах, они с начала 2000-х годов распространились и в настоящее время являются преобладающим типом БЛРС в мире. Обычно их объединяют в пять групп на основе гомологии секвенирования; CTX-M-1, CTX-M-2, CTX-M-8, CTX-M-9 и CTX-M-25. CTX-M-15 (принадлежит к кластеру CTX-M-1) является наиболее распространенным геном CTX-M. [24] Было обнаружено , что пример бета-лактамазы CTX-M-15 вместе с IS Ecp1 транспонирован на хромосому Klebsiella pneumoniae ATCC BAA-2146. [25] Инициалы означают «Цефотаксим-Мюнхен». [26]
Бета-лактамазы OXA долгое время считались менее распространенной, но также опосредованной плазмидами разновидностью бета-лактамаз, которая могла гидролизовать оксациллин и родственные ему антистафилококковые пенициллины. Эти бета-лактамазы отличаются от ферментов TEM и SHV тем, что относятся к молекулярному классу D и функциональной группе 2d. Бета-лактамазы OXA-типа придают устойчивость к ампициллину и цефалотину и характеризуются высокой гидролитической активностью в отношении оксациллина и клоксациллина , а также тем фактом, что они плохо ингибируются клавулановой кислотой . Аминокислотные замены в ферментах OXA также могут приводить к фенотипу ESBL. Хотя большинство ESBL были обнаружены у E. coli , K. pneumoniae и других Enterobacteriaceae , ESBL OXA-типа были обнаружены главным образом у P. aeruginosa . ESBL OXA-типа были обнаружены в основном у изолятов Pseudomonas aeruginosa из Турции и Франции. Семейство бета-лактамаз OXA изначально было создано как фенотипическая, а не генотипическая группа для нескольких бета-лактамаз, которые имели специфический профиль гидролиза. Следовательно, среди некоторых членов этого семейства гомология последовательностей составляет всего 20%. Однако недавние дополнения к этому семейству демонстрируют некоторую степень гомологии с одним или несколькими существующими членами семейства бета-лактамаз OXA. Некоторые из них придают устойчивость преимущественно к цефтазидиму, но OXA-17 придает большую устойчивость к цефотаксиму и цефепиму, чем к цефтазидиму.
Другие плазмид-опосредованные ESBL, такие как бета-лактамазы PER, VEB, GES и IBC, были описаны, но они встречаются редко и обнаруживаются главным образом у P. aeruginosa и в ограниченном числе географических участков. PER-1 в изолятах в Турции, Франции и Италии; ВЭБ-1 и ВЭБ-2 у штаммов Юго-Восточной Азии; и GES-1, GES-2 и IBC-2 в изолятах из Южной Африки, Франции и Греции. PER-1 также распространен у мультирезистентных видов Acinetobacter в Корее и Турции. Некоторые из этих ферментов также обнаружены у Enterobacteriaceae, тогда как другие необычные ESBL (такие как BES-1, IBC-1, SFO-1 и TLA-1) обнаружены только у Enterobacteriaceae.
Хотя раньше организмы, продуцирующие БЛРС, были связаны с больницами и институциональными учреждениями, в настоящее время эти организмы все чаще встречаются в обществе. CTX-M-15-положительная E. coli является причиной внебольничных инфекций мочевыводящих путей в Великобритании [27] и имеет тенденцию быть устойчивой ко всем пероральным β-лактамным антибиотикам, а также к хинолонам и сульфонамидам . Варианты лечения могут включать нитрофурантоин , фосфомицин , мециллинам и хлорамфеникол . В отчаянии можно также использовать инъекции эртапенема или гентамицина один раз в день.
Хотя устойчивые к ингибиторам β-лактамазы не являются ESBL, их часто обсуждают с ESBL, поскольку они также являются производными классических ферментов типа TEM или SHV. Эти ферменты сначала получили обозначение IRT для устойчивой к ингибитору TEM β-лактамазы; однако впоследствии все они были переименованы в числовые обозначения TEM. Существует по крайней мере 19 различных устойчивых к ингибиторам TEM β-лактамаз. Устойчивые к ингибиторам TEM β-лактамазы были обнаружены главным образом в клинических изолятах E. coli , а также в некоторых штаммах K. pneumoniae , Klebsiella oxytoca , P. mirabilis и Citrobacter freundii . Хотя устойчивые к ингибиторам варианты ТЕМ устойчивы к ингибированию клавулановой кислотой и сульбактамом , тем самым проявляя клиническую устойчивость к комбинациям бета-лактам-ингибитор лактамаз амоксициллин - клавуланат ( ко-амоксиклав ), тикарциллин - клавуланат ( ко-тикарклав ) и ампициллин/сульбактам , они обычно остаются чувствительными к ингибированию тазобактамом , а затем и комбинацией пиперациллин/тазобактам , хотя устойчивость была описана . Это уже не преимущественно европейская эпидемиология, она часто встречается в северных частях Америки, и ее следует проверять при комплексных ИМП. [19]
β-лактамазы типа AmpC обычно выделяют из грамотрицательных бактерий, устойчивых к цефалоспоринам расширенного спектра действия. β-лактамазы AmpC (также называемые классом C или группой 1) обычно кодируются на хромосоме многих грамотрицательных бактерий, включая виды Citrobacter , Serratia и Enterobacter , где их экспрессия обычно индуцируется ; он также может встречаться на Escherichia coli, но обычно не индуцируется, хотя может иметь гиперэкспрессию. β-лактамазы типа AmpC также могут переноситься на плазмидах. [6] β-лактамазы AmpC, в отличие от ESBL, гидролизуют цефалоспорины широкого и расширенного спектра действия (цефамицины, а также оксиимино-β-лактамы), но обычно не ингибируются ингибиторами β-лактамаз клавулановой кислотой и тазобактамом , тогда как авибактам могут сохранять ингибирующую активность в отношении этого класса β-лактамаз. [28] β-лактамазные организмы типа AmpC часто клинически группируются по аббревиатуре «SPACE»: Serratia , Pseudomonas или Proteus , Acinetobacter , Citrobacter и Enterobacter .
Карбапенемы известны своей стабильностью к β-лактамазам AmpC и β-лактамазам расширенного спектра действия. Карбапенемазы представляют собой разнообразную группу β-лактамаз, которые активны не только против оксииминоцефалоспоринов и цефамицинов, но также и против карбапенемов. Азтреонам стабилен к металло-β-лактамазам, но многие продуценты ИМФ и ВИМ устойчивы вследствие других механизмов. Ранее считалось, что карбапенемазы происходят только из классов A, B и D, но была описана карбапенемаза класса C.
Плазмидно-опосредованные карбапенемазы IMP-типа (IMP означает «активные на имипенеме»), 19 разновидностей которых в настоящее время известны, были установлены в Японии в 1990-х годах как у кишечных грамотрицательных организмов, так и у видов Pseudomonas и Acinetobacter . Ферменты ИМФ медленно распространялись в другие страны Дальнего Востока, о них сообщалось в Европе в 1997 году, а также они были обнаружены в Канаде и Бразилии.
Второе растущее семейство карбапенемаз, семейство VIM, было зарегистрировано в Италии в 1999 году и в настоящее время включает 10 членов, которые имеют широкое географическое распространение в Европе, Южной Америке и на Дальнем Востоке и были обнаружены в Соединенных Штатах. VIM-1 был обнаружен у P. aeruginosa в Италии в 1996 г.; с тех пор ВИМ-2 — ныне преобладающий вариант — неоднократно обнаруживался в Европе и на Дальнем Востоке; ВИМ-3 и -4 являются второстепенными вариантами ВИМ-2 и -1 соответственно.
Разнообразие аминокислотных последовательностей составляет до 10% в семействе VIM, 15% в семействе IMP и 70% между VIM и IMP. Тем не менее ферменты обоих семейств схожи. Оба связаны с интеграном, иногда внутри плазмид. Оба гидролизуют все β-лактамы, кроме монобактамов, и уклоняются от всех ингибиторов β-лактамов. Ферменты VIM являются одними из наиболее широко распространенных MBL: зарегистрировано >40 вариантов VIM. Биохимические и биофизические исследования показали, что варианты VIM имеют лишь небольшие различия в своих кинетических параметрах, но существенные различия в их термической стабильности и профилях ингибирования. [29]
Группа β-лактамаз OXA встречается преимущественно у видов Acinetobacter и разделена на два кластера. OXA-карбапенемазы очень медленно гидролизуют карбапенемы in vitro , а высокие значения МИК, наблюдаемые у некоторых хозяев Acinetobacter (>64 мг/л), могут отражать вторичные механизмы. В клинических изолятах они иногда дополняются дополнительными механизмами устойчивости, такими как непроницаемость или отток. OXA-карбапенемазы также имеют тенденцию иметь пониженную гидролитическую эффективность по отношению к пенициллинам и цефалоспоринам. [30]
Некоторые ферменты класса А, в основном плазмид-опосредованные ферменты KPC, также являются эффективными карбапенемазами. Известны десять вариантов, от KPC-2 до KPC-11, которые отличаются одной или двумя аминокислотными заменами (KPC-1 был повторно секвенирован в 2008 году и оказался на 100% гомологичен опубликованным последовательностям KPC-2). КРС-1 был обнаружен в Северной Каролине, КРС-2 в Балтиморе и КРС-3 в Нью-Йорке. Они имеют лишь 45% гомологию с ферментами SME и NMC/IMI и, в отличие от них, могут кодироваться самотрансмиссивными плазмидами.
По состоянию на февраль 2009 года карбапенемаза Klebsiella pneumoniae ( KPC[обновлять] ) класса А во всем мире была наиболее распространенной карбапенемазой и впервые была обнаружена в 1996 году в Северной Каролине , США. [31] В публикации 2010 года указывалось, что КПК, производящие энтеробактерии, становятся обычным явлением в Соединенных Штатах. [32]
Первая карбапенемаза класса С была описана в 2006 году и выделена из вирулентного штамма Enterobacter aerogenes . [33] Он переносится плазмидой pYMG-1 и поэтому может передаваться другим бактериальным штаммам. [34]
В целом они не имеют клинического значения.
CcrA (CfiA). Его ген встречается ок. 1–3% изолятов B. fragilis , но меньшее количество продуцирует фермент, поскольку экспрессия требует соответствующей миграции инсерционной последовательности. CcrA был известен до появления имипенема, и производители в последующем не продемонстрировали незначительного увеличения его количества.
Первоначально описанный в Нью-Дели в 2009 году, этот ген в настоящее время широко распространен у Escherichia coli и Klebsiella pneumoniae из Индии и Пакистана. По состоянию на середину 2010 года бактерии, несущие NDM-1, были завезены в другие страны (включая США и Великобританию), скорее всего, из-за большого количества туристов, путешествующих по миру, которые могли подхватить штамм из окружающей среды. поскольку штаммы, содержащие ген NDM-1, были обнаружены в пробах окружающей среды в Индии. [35] У NDM есть несколько вариантов, которые имеют разные свойства. [29]
Как правило, изолят считается продуцентом БЛРС, если он обнаруживает in vitro чувствительность к цефамицинам ( цефокситин , цефотетан ), но устойчивость к цефалоспоринам третьего поколения и азтреонаму . Более того, следует подозревать эти штаммы, когда лечение этими агентами грамотрицательных инфекций не дает результатов, несмотря на сообщения о чувствительности in vitro . После обнаружения штамма, продуцирующего БЛРС, лаборатория должна сообщить о его «резистентности» ко всем пенициллинам, цефалоспоринам и азтреонаму, даже если он проверен (in vitro) как чувствительный. [ нужна ссылка ] Сопутствующая устойчивость к аминогликозидам и триметоприму - сульфаметоксазолу , а также высокая частота сосуществования устойчивости к фторхинолонам создают проблемы. Ингибиторы бета-лактамаз, такие как клавуланат , сульбактам и тазобактам, in vitro ингибируют большинство БЛРС, но на клиническую эффективность комбинаций бета-лактамов/ингибиторов бета-лактамаз нельзя постоянно полагаться при лечении. Цефамицины ( цефокситин и цефотетан ) не гидролизуются большинством ESBL, но гидролизуются ассоциированной β-лактамазой типа AmpC. Кроме того, комбинации ингибиторов β-лактамов и β-лактамаз могут быть неэффективны против организмов, продуцирующих β-лактамазу типа AmpC. Иногда эти штаммы снижают экспрессию белков внешней мембраны, что делает их устойчивыми к цефамицинам. Исследования in vivo дали неоднозначные результаты в отношении K. pneumoniae , продуцирующего ESBL . ( Цефепим , цефалоспорин четвертого поколения, продемонстрировал стабильность in vitro в присутствии многих штаммов ESBL/AmpC.) В настоящее время карбапенемы в целом считаются предпочтительным средством для лечения инфекций, вызванных микроорганизмами, продуцирующими ESBL. Карбапенемы устойчивы к гидролизу, опосредованному ESBL, и проявляют превосходную активность in vitro против штаммов Enterobacteriaceae , экспрессирующих ESBL. [ нужна цитата ]
Штаммы, продуцирующие только ESBL, чувствительны к цефамицинам и карбапенемам in vitro и практически не проявляют инокуляционного эффекта с этими агентами.
Для организмов, продуцирующих ESBL типа TEM и SHV , очевидная чувствительность in vitro к цефепиму и пиперациллину/тазобактаму является обычным явлением, но оба препарата проявляют инокулятивный эффект со снижением чувствительности по мере увеличения размера инокулята с 10 5 до 10 7 организмов.
Штаммы с некоторыми ESBL типа CTX-M и OXA -типа устойчивы к цефепиму при тестировании, несмотря на использование стандартного инокулята.
Хотя устойчивые к ингибиторам варианты ТЕМ устойчивы к ингибированию клавулановой кислотой и сульбактамом , тем самым демонстрируя клиническую устойчивость к комбинациям бета-лактам-ингибитор бета-лактамаз амоксициллин - клавуланат ( ко-амоксиклав ), тикарциллин - клавуланат и ампициллин/сульбактам , они остаются чувствительными к ингибированию тазобактамом , а затем и комбинацией пиперациллин/тазобактам .
Штаммы, продуцирующие AmpC, обычно устойчивы к оксиимино-бета-лактамам и цефамицинам и чувствительны к карбапенемам ; однако пониженная экспрессия поринов также может сделать такой штамм устойчивым к карбапенемам.
Штаммы с карбапенемазами IMP-, VIM- и OXA -типов обычно остаются восприимчивыми. Устойчивость к небета-лактамным антибиотикам часто встречается у штаммов, продуцирующих любой из этих ферментов, поэтому альтернативные варианты небета-лактамной терапии необходимо определять путем прямого тестирования чувствительности. Особенно высока устойчивость к фторхинолонам и аминогликозидам .
При инфекциях, вызванных видами Escherichia coli или Klebsiella , продуцирующими ESBL , лечение имипенемом или меропенемом было связано с лучшими результатами с точки зрения выживаемости и бактериологического клиренса. Цефепим и пиперациллин/тазобактам оказались менее успешными. Цефтриаксон , цефотаксим и цефтазидим оказывались неудачными еще чаще, несмотря на чувствительность организма к антибиотику in vitro . В нескольких сообщениях документально подтверждена неэффективность терапии цефамицином из-за резистентности из-за потери поринов. Некоторые пациенты ответили на терапию аминогликозидами или хинолонами , но в недавнем сравнении ципрофлоксацина и имипенема при бактериемии, вызванной ESBL-продуцирующим K. pneumoniae , имипенем дал лучший результат.
Клинических исследований по определению оптимальной терапии инфекций, вызванных БЛРС, продуцирующими штаммы Pseudomonas aeruginosa , было немного .
В 1957 году, на фоне беспокойства по поводу аллергических реакций на пенициллинсодержащие антибиотики, бета-лактамазы продавались в качестве антидота под торговой маркой нейтрапен. [36] Было высказано предположение, что расщепление пенициллина ферментом будет лечить аллергическую реакцию. [37] Хотя он не был полезен при остром анафилактическом шоке, он показал положительные результаты в случаях крапивницы и болей в суставах, предположительно вызванных аллергией на пенициллин. [38] [39] Его использование было предложено в педиатрических случаях, когда аллергия на пенициллин была обнаружена после введения полиовакцины, в которой пенициллин использовался в качестве консерванта. [40] Однако у некоторых пациентов развилась аллергия на нейтрапен. [41] [42] Больница Олбани удалила его из своего формуляра в 1960 году, всего через два года после добавления, сославшись на отсутствие использования. [43] Некоторые исследователи продолжали использовать его в экспериментах по изучению устойчивости к пенициллину даже в 1972 году. [44] Он был добровольно отозван с американского рынка компанией 3M Pharmaceuticals в 1997 году. [45]
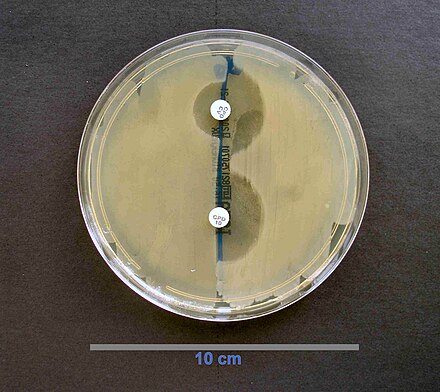
Ферментативную активность бета-лактамаз можно обнаружить с помощью нитроцефина , хромогенного субстрата цефалоспорина , который меняет цвет с желтого на красный при гидролизе, опосредованном бета-лактамазой. [46]
Скрининг бета-лактамаз расширенного спектра (ESBL) можно проводить с использованием дисковой диффузии. Используются диски с цефподоксимом, цефтазидимом, азтреонамом, цефотаксимом и/или цефтриаксоном. [47]
Бета-лактамазы — древние бактериальные ферменты. Металло-β-лактамазы («класс B») структурно схожи с РНКазой Z и, возможно, произошли от нее. Предполагается, что из трех подклассов B1, B2 и B3 B1 и B2 развились около одного миллиарда лет назад , тогда как B3, по-видимому, возник независимо, возможно, до расхождения грамположительных и грамотрицательных эубактерий около двух миллиардов лет назад. много лет назад. [48] PNGM-1 (Металло-β-лактамаза-1 Папуа-Новой Гвинеи) обладает активностью как металло-β-лактамазы (MBL), так и тРНКазы Z, что позволяет предположить, что PNGM-1, как полагают, произошел от тРНКазы Z, и что Активность MBL B3 PNGM-1 представляет собой беспорядочную активность, и считается, что MBL подкласса B3 развились посредством активности PNGM-1. [49] Подклассы B1 и B3 получили дальнейшее подразделение. [50]
Сериновые бета-лактамазы (классы A, C и D), по-видимому, произошли от DD-транспептидаз , которые представляют собой пенициллин-связывающие белки, участвующие в биосинтезе клеточной стенки и, как таковые, являются одной из основных мишеней бета-лактамных антибиотиков. [51] Эти три класса демонстрируют необнаружимое сходство последовательностей друг с другом, но их все же можно сравнивать с использованием структурной гомологии. Группы A и D являются сестринскими таксонами, а группа C разошлась раньше A и D. [52] Эти сериновые ферменты, как и беталактамазы группы B, имеют древнее происхождение и, как предполагается, возникли около двух миллиардов лет назад. [53]
В частности, предполагается, что группа OXA (класса D) эволюционировала на хромосомах и перемещалась в плазмиды по крайней мере в двух отдельных случаях. [54]
«β» ( бета ) относится к положению азота на втором атоме углерода в кольце. Лактам представляет собой смесь лактона (от латинского Lactis — молоко , поскольку молочную кислоту выделяли из простокваши) и амида . Суффикс -аза , обозначающий фермент, происходит от диастазы (от греческого диастаза , «разделение»), первого фермента, открытого в 1833 году Пайеном и Персосом. [55]