Биоорганическая химия — это область, которая изучает роль металлов в биологии . Биоорганическая химия включает в себя изучение как природных явлений, таких как поведение металлопротеинов , так и искусственно введенных металлов, включая те, которые не являются необходимыми , в медицине и токсикологии . Многие биологические процессы, такие как дыхание, зависят от молекул, которые попадают в сферу неорганической химии . Дисциплина также включает в себя изучение неорганических моделей или имитаторов, которые имитируют поведение металлопротеинов. [1]
Как смесь биохимии и неорганической химии , бионеорганическая химия важна для выяснения последствий белков переноса электронов , связывания и активации субстрата, химии переноса атомов и групп, а также свойств металлов в биологической химии. Успешное развитие действительно междисциплинарной работы необходимо для продвижения бионеорганической химии. [2]
Около 99% массы млекопитающих составляют элементы углерод , азот , кальций , натрий , хлор , калий, водород , фосфор , кислород и сера . [3] Органические соединения ( белки , липиды и углеводы ) содержат большую часть углерода и азота, а большая часть кислорода и водорода присутствует в виде воды. [3] Вся совокупность металлосодержащих биомолекул в клетке называется металлом .
Пол Эрлих использовал органомышьяк («мышьяки») для лечения сифилиса , продемонстрировав значимость металлов или, по крайней мере, металлоидов для медицины, которая расцвела с открытием Розенбергом противораковой активности цисплатина (цис-PtCl 2 (NH 3 ) 2 ). Первым белком, когда-либо кристаллизованным (см. Джеймс Б. Самнер ), была уреаза , позже было показано, что она содержит никель в своем активном центре . Витамин B 12 , лекарство от злокачественной анемии , как было показано кристаллографически Дороти Кроуфут Ходжкин , состоит из кобальта в макроцикле коррина .
Несколько отдельных систем можно выделить в бионеорганической химии. Основные области включают:
Разнообразный набор транспортеров (например, ионный насос NaKATPase ), вакуолей , запасных белков (например, ферритин ) и малых молекул (например, сидерофоров ) используются для контроля концентрации ионов металлов и их биодоступности в живых организмах. Важно отметить, что многие основные металлы не являются легкодоступными для нижестоящих белков из-за низкой растворимости в водных растворах или дефицита в клеточной среде. Организмы разработали ряд стратегий для сбора и транспортировки таких элементов, ограничивая при этом их цитотоксичность .
Многие реакции в науках о жизни включают воду, и ионы металлов часто находятся в каталитических центрах (активных участках) для этих ферментов, т. е. это металлопротеины . Часто реагирующая вода является лигандом (см. комплекс металла с водой ). Примерами ферментов гидролаз являются карбоангидраза , металлофосфатазы и металлопротеиназы . Бионеорганические химики стремятся понять и воспроизвести функцию этих металлопротеинов.
Металлосодержащие белки переноса электронов также распространены. Их можно разделить на три основных класса: железо-серные белки (такие как рубредоксины , ферредоксины и белки Риске ), синие медные белки и цитохромы . Эти белки переноса электронов комплементарны неметаллическим переносчикам электронов никотинамидадениндинуклеотиду (НАД) и флавинадениндинуклеотиду (ФАД). Азотный цикл широко использует металлы для окислительно-восстановительных взаимопревращений.

Несколько ионов металлов токсичны для людей и других животных. Биоорганическая химия свинца в контексте его токсичности была рассмотрена. [4]
Аэробная жизнь широко использует металлы, такие как железо, медь и марганец. Гем используется эритроцитами в форме гемоглобина для переноса кислорода и, возможно, является наиболее признанной металлической системой в биологии. Другие системы переноса кислорода включают миоглобин , гемоцианин и гемэритрин . Оксидазы и оксигеназы — это металлические системы, встречающиеся в природе, которые используют кислород для проведения важных реакций, таких как выработка энергии в цитохром с оксидазе или окисление малых молекул в цитохром P450 оксидазах или метанмонооксигеназе . Некоторые металлопротеины предназначены для защиты биологической системы от потенциально вредного воздействия кислорода и других реактивных кислородсодержащих молекул, таких как перекись водорода . Эти системы включают пероксидазы , каталазы и супероксиддисмутазы . Дополнительным металлопротеином к тем, которые реагируют с кислородом, является комплекс, выделяющий кислород, присутствующий в растениях. Эта система является частью сложного белкового аппарата, который вырабатывает кислород , когда растения выполняют фотосинтез .

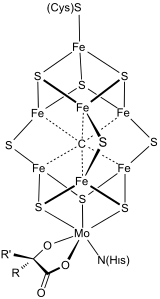
Биоорганометаллические системы характеризуются связями металл-углерод как структурными элементами или как промежуточными соединениями. Биоорганометаллические ферменты и белки включают гидрогеназы , FeMoco в нитрогеназе и метилкобаламин . Эти встречающиеся в природе металлоорганические соединения . Эта область больше сосредоточена на использовании металлов одноклеточными организмами. Биоорганометаллические соединения играют важную роль в химии окружающей среды . [5]
Ряд лекарств содержат металлы. Эта тема основана на изучении конструкции и механизма действия металлосодержащих фармацевтических препаратов и соединений, которые взаимодействуют с эндогенными ионами металлов в активных участках ферментов. Наиболее широко используемым противораковым препаратом является цисплатин . Контрастное вещество для МРТ обычно содержит гадолиний . Карбонат лития использовался для лечения маниакальной фазы биполярного расстройства. Золотые противоартритные препараты, например, ауранофин, были коммерциализированы. Молекулы, выделяющие оксид углерода, представляют собой комплексы металлов, которые были разработаны для подавления воспаления путем выделения небольших количеств оксида углерода. Было изучено сердечно-сосудистое и нейрональное значение оксида азота , включая фермент синтазу оксида азота . (См. также: усвоение азота .) Кроме того, комплексы металлических переходов на основе триазолопиримидинов были испытаны против нескольких штаммов паразитов. [6]
Химия окружающей среды традиционно подчеркивает взаимодействие тяжелых металлов с организмами. Метилртуть стала причиной крупной катастрофы, называемой болезнью Минамата . Отравление мышьяком является широко распространенной проблемой, в основном из-за загрязнения мышьяком грунтовых вод , которое затрагивает многие миллионы людей в развивающихся странах. Метаболизм соединений, содержащих ртуть и мышьяк, включает ферменты на основе кобаламина .
Биоминерализация — это процесс, посредством которого живые организмы производят минералы , часто для укрепления или придания жесткости существующим тканям. Такие ткани называются минерализованными тканями . [7] [8] [9] Примерами служат силикаты в водорослях и диатомовых водорослях , карбонаты в беспозвоночных , а также фосфаты и карбонаты кальция в позвоночных . Другие примеры включают месторождения меди , железа и золота с участием бактерий. Биологически образованные минералы часто имеют особое применение, например, в качестве магнитных датчиков в магнитотактических бактериях (Fe 3 O 4 ), устройств для измерения гравитации (CaCO 3 , CaSO 4 , BaSO 4 ) и хранения и мобилизации железа (Fe 2 O 3 •H 2 O в белке ферритине ). Поскольку внеклеточное [10] железо активно участвует в индукции кальцификации, [11] [12] его контроль необходим для развития раковин; белок ферритин играет важную роль в контроле распределения железа. [13]
Обильные неорганические элементы действуют как ионные электролиты . Наиболее важными ионами являются натрий , калий , кальций , магний , хлорид , фосфат и бикарбонат . Поддержание точных градиентов через клеточные мембраны поддерживает осмотическое давление и pH . [15] Ионы также имеют решающее значение для нервов и мышц , поскольку потенциалы действия в этих тканях создаются путем обмена электролитами между внеклеточной жидкостью и цитозолем . [16] Электролиты входят в клетки и выходят из них через белки в клеточной мембране, называемые ионными каналами . Например, сокращение мышц зависит от движения кальция, натрия и калия через ионные каналы в клеточной мембране и Т-трубочках . [17]
Переходные металлы обычно присутствуют в организмах в качестве следовых элементов , причем наиболее распространены цинк и железо . [18] [19] [20] Эти металлы используются в качестве кофакторов белков и сигнальных молекул. Многие из них необходимы для активности ферментов, таких как каталаза , и белков-переносчиков кислорода, таких как гемоглобин . [21] Эти кофакторы тесно связаны с определенным белком; хотя кофакторы ферментов могут быть изменены во время катализа, кофакторы всегда возвращаются в свое исходное состояние после того, как катализ произошел. Микроэлементы металлов попадают в организмы с помощью определенных транспортеров и связываются с запасными белками, такими как ферритин или металлотионеин, когда не используются. [22] [23] Кобальт необходим для функционирования витамина B12 . [24]
Многие другие элементы, помимо металлов, являются биоактивными. Сера и фосфор необходимы для всей жизни. Фосфор почти исключительно существует в виде фосфата и его различных эфиров . Сера существует в различных степенях окисления, от сульфата (SO 4 2− ) до сульфида (S 2− ). Селен является микроэлементом, входящим в состав белков, которые являются антиоксидантами. Кадмий важен из-за своей токсичности. [25]