Бутан ( / ˈ b juː t eɪ n / ) — алкан с формулой C 4 H 10 . Бутан существует в виде двух изомеров, н -бутана со связью CH 3 CH 2 CH 2 CH 3 и изобутана с формулой (CH 3 ) 3 CH . Оба изомера являются легковоспламеняющимися, бесцветными, легко сжижаемыми газами , которые быстро испаряются при комнатной температуре и давлении. Бутаны являются следовыми компонентами природных газов (газов NG). Другие углеводороды в NG включают пропан , этан и особенно метан , которые более распространены. Сжиженный природный газ представляет собой смесь пропана и некоторых бутанов. [6]
Название бутан происходит от корня «бут-» (от масляной кислоты , названной в честь греческого слова, обозначающего масло ) и суффикса «-ан» .
Первый синтез бутана был случайно осуществлен британским химиком Эдвардом Франклендом в 1849 году из этилиодида и цинка , но он не осознавал, что этильный радикал димеризуется, и неправильно идентифицировал вещество. [7]
Он был обнаружен в сырой нефти в 1864 году Эдмундом Рональдсом , который первым описал его свойства, [8] [9] которые он назвал «гидридом бутила », [10] основываясь на названии известной тогда масляной кислоты , которая была названа и описана французским химиком Мишелем Эженом Шеврёлем [11] 40 годами ранее. Другие названия возникли в 1860-х годах: «бутилгидрид», [12] «гидрид тетрила» [13] и «тетрилгидрид», [14] «диэтил» или «этилэтилид» [15] и другие. Август Вильгельм фон Хофманн в своей системной номенклатуре 1866 года предложил название «квартан», [2] а современное название было введено в английский язык из немецкого около 1874 года. [16]
Бутан не имел большого практического применения до 1910-х годов, когда У. Снеллинг идентифицировал бутан и пропан как компоненты бензина. Он обнаружил, что если их охладить, то их можно хранить в сжиженном состоянии с уменьшенным объемом в герметичных контейнерах. В 1911 году сжиженный нефтяной газ Снеллинга стал общедоступным, а его процесс получения смеси был запатентован в 1913 году. [17] Бутан является одним из наиболее производимых промышленных химикатов в 21 веке, около 80-90 миллиардов фунтов (40 миллионов тонн США, 36 миллионов метрических тонн ) производится Соединенными Штатами каждый год. [18]
Плотность бутана сильно зависит от температуры и давления в резервуаре. [19] Например, плотность жидкого бутана составляет 571,8±1 кг/м 3 (для давлений до 2 МПа и температуры 27±0,2 °C), а плотность жидкого бутана составляет 625,5±0,7 кг/м 3 (для давлений до 2 МПа и температуры −13±0,2 °C).
Вращение вокруг центральной связи C−C приводит к двум различным конформациям ( транс и гош ) для н -бутана. [20]

При избытке кислорода бутан полностью сгорает с образованием углекислого газа и водяного пара ; при недостатке кислорода из-за неполного сгорания вместо углекислого газа может образоваться углерод ( сажа ) или оксид углерода . Бутан плотнее воздуха.
При достаточном количестве кислорода:
При ограничении кислорода:
По весу бутан содержит около 49,5 МДж / кг (13,8 кВтч /кг; 22,5 МДж/ фунт ; 21 300 БТЕ /фунт) или по объему жидкости 29,7 мегаджоулей на литр (8,3 кВтч/л; 112 МДж/галлон США; 107 000 БТЕ/галлон США).
Максимальная адиабатическая температура пламени бутана с воздухом составляет 2243 К (1970 °C; 3578 °F).
н -Бутан является сырьем для каталитического процесса компании DuPont по получению малеинового ангидрида :
н -Бутан, как и все углеводороды , подвергается свободнорадикальному хлорированию, давая как 1-хлор-, так и 2-хлорбутаны, а также более высокохлорированные производные. Относительные скорости хлорирования частично объясняются различными энергиями диссоциации связей : 425 и 411 кДж / моль для двух типов связей CH.
Нормальный бутан может использоваться для смешивания бензина , как топливный газ, растворитель для экстракции ароматизаторов, как отдельно, так и в смеси с пропаном , а также как сырье для производства этилена и бутадиена , ключевого ингредиента синтетического каучука . Изобутан в основном используется на нефтеперерабатывающих заводах для повышения (увеличения) октанового числа автомобильного бензина. [21] [22] [23] [24]
Для смешивания бензина н-бутан является основным компонентом, используемым для управления давлением паров по Рейду (RVP). Поскольку зимнее топливо требует гораздо более высокого давления паров для запуска двигателей, нефтеперерабатывающие заводы повышают RVP, смешивая больше бутана с топливом. [25] н-бутан имеет относительно высокое исследовательское октановое число (RON) и моторное октановое число (MON), которые составляют 93 и 92 соответственно. [26]
При смешивании с пропаном и другими углеводородами смесь может называться коммерчески сжиженным нефтяным газом (СНГ). Он используется как компонент бензина, как сырье для производства базовых нефтехимических продуктов в паровом крекинге , как топливо для зажигалок и как пропеллент в аэрозольных спреях, таких как дезодоранты . [27]
Чистые формы бутана, особенно изобутан, используются в качестве хладагентов и в значительной степени заменили разрушающие озоновый слой галометаны в холодильниках, морозильниках и системах кондиционирования воздуха. Рабочее давление для бутана ниже, чем рабочее давление для галометанов, таких как фреон-12 (R-12). Следовательно, системы R-12, такие как в автомобильных системах кондиционирования воздуха, при переводе на чистый бутан будут функционировать плохо. Вместо этого используется смесь изобутана и пропана, чтобы обеспечить производительность системы охлаждения, сравнимую с R-12. [28]
Бутан также используется в качестве топлива для обычных зажигалок или бутановых горелок , а также продается в бутылках в качестве топлива для приготовления пищи, барбекю и походных печей. В 20 веке немецкая компания Braun выпустила беспроводное устройство для укладки волос, которое использовало бутан в качестве источника тепла для производства пара . [29]
В качестве топлива бутан часто смешивают с небольшим количеством меркаптанов , чтобы придать несгоревшему газу неприятный запах, легко обнаруживаемый человеческим носом. Таким образом, утечки бутана можно легко определить. Хотя сероводород и меркаптаны токсичны, они присутствуют в таких низких концентрациях, что удушье и опасность возгорания от бутана становятся проблемой задолго до токсичности . [30] [31] Большинство коммерчески доступных бутанов также содержат некоторое количество загрязняющего масла, которое можно удалить фильтрацией. Если его не удалить, он оставит отложения в точке воспламенения и может в конечном итоге заблокировать равномерный поток газа. [32]
Бутан, используемый в качестве растворителя для экстракции ароматизаторов, не содержит этих загрязняющих веществ. [33] Бутановый газ может стать причиной взрыва газа в плохо проветриваемых помещениях, если утечки останутся незамеченными и воспламенятся от искры или пламени. [5] Очищенный бутан используется в качестве растворителя при промышленной экстракции масел каннабиса.
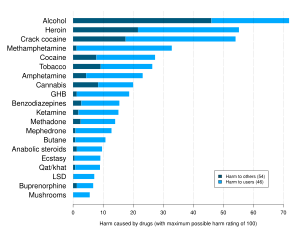
Вдыхание бутана может вызвать эйфорию , сонливость , потерю сознания , асфиксию , сердечную аритмию , колебания артериального давления и временную потерю памяти, если злоупотреблять им непосредственно из контейнера под высоким давлением, и может привести к смерти от удушья и фибрилляции желудочков . Бутан попадает в кровоток и в течение нескольких секунд приводит к интоксикации. [35] Бутан является наиболее часто употребляемым летучим веществом в Великобритании и был причиной 52% смертей, связанных с растворителями в 2000 году. [36] При распылении бутана непосредственно в горло струя жидкости может быстро охладиться до -20 °C (-4 °F) за счет расширения, вызывая длительный ларингоспазм . [37] Синдром «внезапной смерти от вдыхания запаха» , впервые описанный Бассом в 1970 году, [38] является наиболее распространенной причиной смерти, связанной с растворителями, и составляет 55% известных смертельных случаев. [37]
Аналогично, сохраненные названия «этан», «пропан» и «бутан» никогда не заменялись систематическими названиями «дикарбан», «трикарбан» и «тетракарбан», как рекомендовано для аналогов силана — «дисилан», фосфана — «трифосфан» и сульфана — «тетрасульфан».