_01.JPG/440px-Операционная._ФЦН_(Тюмень)_01.JPG)

Биомедицинская инженерия ( БМИ ) или медицинская инженерия — это применение инженерных принципов и концепций проектирования в медицине и биологии для медицинских целей (например, диагностических или терапевтических целей). БМИ также традиционно является логическими науками для продвижения лечения в здравоохранении, включая диагностику , мониторинг и терапию . [1] [2] Также в сферу деятельности биомедицинского инженера входит управление текущим медицинским оборудованием в больницах с соблюдением соответствующих отраслевых стандартов. Это включает в себя закупки, плановые испытания, профилактическое обслуживание и предоставление рекомендаций по оборудованию, роль также известна как техник по биомедицинскому оборудованию (БМИ) или клинический инженер .
Биомедицинская инженерия недавно стала отдельной областью изучения по сравнению со многими другими областями инженерии. [ требуется ссылка ] Такая эволюция является обычной, поскольку новая область переходит от междисциплинарной специализации среди уже существующих областей к тому, чтобы считаться отдельной областью. Большая часть работы в области биомедицинской инженерии состоит из исследований и разработок , охватывающих широкий спектр подобластей (см. ниже). Известные приложения биомедицинской инженерии включают разработку биосовместимых протезов , различных диагностических и терапевтических медицинских устройств, начиная от клинического оборудования и заканчивая микроимплантами, технологий визуализации, таких как МРТ и ЭКГ / ЭКГ , регенеративный рост тканей и разработку фармацевтических препаратов , включая биофармацевтические препараты .

Биоинформатика — это междисциплинарная область, которая разрабатывает методы и программные средства для понимания биологических данных. Как междисциплинарная область науки, биоинформатика объединяет информатику, статистику, математику и инженерию для анализа и интерпретации биологических данных.
Биоинформатика считается как общим термином для совокупности биологических исследований, которые используют компьютерное программирование как часть своей методологии, так и ссылкой на конкретные аналитические «конвейеры», которые многократно используются, особенно в области геномики. Распространенные применения биоинформатики включают идентификацию генов-кандидатов и нуклеотидов (SNP). Часто такая идентификация проводится с целью лучшего понимания генетической основы заболевания, уникальных адаптаций, желаемых свойств (особенно у сельскохозяйственных видов) или различий между популяциями. Менее формальным образом биоинформатика также пытается понять организационные принципы в последовательностях нуклеиновых кислот и белков.
.jpg/440px-B09685P005_(1).jpg)
Биомеханика – это изучение структуры и функционирования механических аспектов биологических систем на любом уровне от целых организмов до органов , клеток и клеточных органелл [3] с использованием методов механики [4] .
Биоматериал — это любая материя, поверхность или конструкция, которая взаимодействует с живыми системами. Биоматериалы как наука существуют уже около пятидесяти лет. Изучение биоматериалов называется биоматериаловедением или биоматериальной инженерией . За свою историю она пережила устойчивый и сильный рост, и многие компании инвестируют большие суммы денег в разработку новых продуктов. Биоматериаловедение охватывает элементы медицины, биологии, химии, тканевой инженерии и материаловедения.
Биомедицинская оптика объединяет принципы физики, инженерии и биологии для изучения взаимодействия биологической ткани и света, а также того, как это может быть использовано для зондирования, визуализации и лечения. [5] Она имеет широкий спектр применения, включая оптическую визуализацию, микроскопию, офтальмоскопию, спектроскопию и терапию. Примерами методов и технологий биомедицинской оптики являются оптическая когерентная томография (ОКТ), флуоресцентная микроскопия , конфокальная микроскопия и фотодинамическая терапия (ФДТ). ОКТ, например, использует свет для создания трехмерных изображений высокого разрешения внутренних структур, таких как сетчатка глаза или коронарные артерии сердца. Флуоресцентная микроскопия включает в себя маркировку определенных молекул флуоресцентными красителями и визуализацию их с помощью света, что дает представление о биологических процессах и механизмах заболеваний. В последнее время адаптивная оптика помогает в визуализации, исправляя аберрации в биологических тканях, обеспечивая более высокое разрешение изображений и повышенную точность таких процедур, как лазерная хирургия и визуализация сетчатки.
Тканевая инженерия, как и генная инженерия (см. ниже), является крупным сегментом биотехнологии , который во многом пересекается с биотехнологией животных.
Одной из целей тканевой инженерии является создание искусственных органов (из биологического материала) для пациентов, которым требуется пересадка органов. Биомедицинские инженеры в настоящее время изучают методы создания таких органов. Исследователи вырастили твердые челюстные кости [6] и трахеи [7] из человеческих стволовых клеток с этой целью. Несколько искусственных мочевых пузырей были выращены в лабораториях и успешно трансплантированы пациентам-людям. [8] Биоискусственные органы, которые используют как синтетические, так и биологические компоненты, также являются областью фокусировки в исследованиях, например, с устройствами для поддержки печени, которые используют клетки печени в конструкции искусственного биореактора. [9]

Генная инженерия, технология рекомбинантной ДНК, генетическая модификация/манипуляция (ГМ) и сплайсинг генов — это термины, которые применяются к прямой манипуляции генами организма. В отличие от традиционной селекции, косвенного метода генетической манипуляции, генная инженерия использует современные инструменты, такие как молекулярное клонирование и трансформация, для прямого изменения структуры и характеристик целевых генов. Методы генной инженерии нашли успешное применение во многих приложениях. Некоторые примеры включают улучшение технологии выращивания сельскохозяйственных культур ( не медицинское применение , но см. биологическая системная инженерия ), производство синтетического человеческого инсулина с использованием модифицированных бактерий, производство эритропоэтина в клетках яичников хомяка и производство новых типов экспериментальных мышей, таких как онкомышь (раковая мышь) для исследований. [ необходима цитата ]
Нейронная инженерия (также известная как нейроинженерия) — это дисциплина, которая использует инженерные методы для понимания, ремонта, замены или улучшения нейронных систем. Нейронные инженеры обладают уникальной квалификацией для решения проблем проектирования на стыке живой нервной ткани и неживых конструкций. Нейронная инженерия может помочь во многих вещах, включая будущую разработку протезов. Например, когнитивное нейронное протезирование (CNP) интенсивно исследуется и позволит имплантировать чип, чтобы помогать людям с протезами, предоставляя сигналы для управления вспомогательными устройствами. [10]
Фармацевтическая инженерия — это междисциплинарная наука, которая включает в себя разработку лекарств, доставку и нацеливание новых лекарств, фармацевтические технологии, операции по химической инженерии и фармацевтический анализ. Ее можно считать частью фармации из-за ее фокуса на использовании технологий в химических агентах для обеспечения лучшего медицинского лечения.

Это чрезвычайно широкая категория , по сути охватывающая все продукты здравоохранения, которые не достигают своих предполагаемых результатов преимущественно химическими (например, фармацевтические препараты) или биологическими (например, вакцины) средствами и не связаны с метаболизмом.
Медицинское изделие предназначено для использования в:
Некоторые примеры включают кардиостимуляторы , инфузионные насосы , аппараты искусственного кровообращения , аппараты диализа , искусственные органы , имплантаты , протезы конечностей , корректирующие линзы , кохлеарные имплантаты , глазные протезы , лицевые протезы , соматопротезы и зубные имплантаты .
Стереолитография — практический пример медицинского моделирования , используемого для создания физических объектов. Помимо моделирования органов и человеческого тела, новые инженерные методы в настоящее время также используются в исследованиях и разработках новых устройств для инновационных терапий, [11] лечения, [12] мониторинга пациентов, [13] сложных заболеваний.
Медицинские приборы регулируются и классифицируются (в США) следующим образом (см. также Регламент ):
Медицинская/биомедицинская визуализация является основным сегментом медицинских устройств . Эта область занимается предоставлением возможности врачам напрямую или косвенно «видеть» вещи, которые не видны на виду (например, из-за их размера и/или местоположения). Это может включать использование ультразвука, магнетизма, УФ, радиологии и других средств.
В качестве альтернативы, навигационное оборудование использует технологию электромагнитного отслеживания, например, размещение катетера в мозге или системы размещения зонда для кормления . Например, ENvue от ENvizion Medical, электромагнитная навигационная система для размещения зонда для энтерального кормления. Система использует внешний генератор поля и несколько пассивных датчиков ЭМ, что позволяет масштабировать дисплей в соответствии с контуром тела пациента и просматривать в реальном времени местоположение и направление кончика зонда для кормления, что помогает медицинскому персоналу обеспечить правильное размещение в желудочно-кишечном тракте . [14]

Технологии визуализации часто необходимы для медицинской диагностики и, как правило, представляют собой наиболее сложное оборудование, встречающееся в больнице, включая: флюороскопию , магнитно-резонансную томографию (МРТ), ядерную медицину , позитронно-эмиссионную томографию (ПЭТ), ПЭТ-КТ , проекционную радиографию, такую как рентгенография и КТ , томографию , ультразвук , оптическую микроскопию и электронную микроскопию .
Имплантат — это вид медицинского устройства, предназначенного для замены и действия в качестве отсутствующей биологической структуры (по сравнению с трансплантатом, который обозначает пересаженную биомедицинскую ткань). Поверхность имплантатов, которая контактирует с телом, может быть изготовлена из биомедицинского материала, такого как титан, силикон или апатит, в зависимости от того, что является наиболее функциональным. В некоторых случаях имплантаты содержат электронику, например, искусственные кардиостимуляторы и кохлеарные имплантаты. Некоторые имплантаты являются биоактивными, например, устройства для подкожной доставки лекарств в форме имплантируемых таблеток или стентов с лекарственным покрытием .

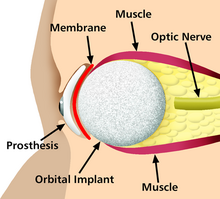
Искусственные замены частей тела являются одним из многочисленных применений бионики. Занимаясь сложным и тщательным изучением свойств и функций систем человеческого тела, бионика может применяться для решения некоторых инженерных проблем. Тщательное изучение различных функций и процессов глаз, ушей и других органов проложило путь для усовершенствованных камер, телевидения, радиопередатчиков и приемников и многих других инструментов.
В последние годы биомедицинские датчики, основанные на микроволновой технологии, привлекли больше внимания. Различные датчики могут быть изготовлены для конкретных целей как в диагностике, так и в мониторинге заболеваний, например, микроволновые датчики могут использоваться в качестве дополнительной техники к рентгену для мониторинга травм нижних конечностей. [15] Датчик контролирует диэлектрические свойства и, таким образом, может замечать изменения в тканях (кости, мышцы, жир и т. д.) под кожей, поэтому при измерении в разное время в процессе заживления реакция датчика будет меняться по мере заживления травмы.
Клиническая инженерия — это отрасль биомедицинской инженерии, занимающаяся фактическим внедрением медицинского оборудования и технологий в больницах или других клинических учреждениях. Основные роли клинических инженеров включают обучение и контроль за техническими специалистами по биомедицинскому оборудованию (BMET) , выбор технологических продуктов/услуг и логистическое управление их внедрением, работу с государственными регулирующими органами по инспекциям/аудитам, а также работу в качестве технологических консультантов для другого персонала больницы (например, врачей, администраторов, ИТ-специалистов и т. д.). Клинические инженеры также консультируют и сотрудничают с производителями медицинских устройств относительно перспективных улучшений дизайна на основе клинического опыта, а также отслеживают прогресс в области современных технологий, чтобы соответствующим образом перенаправлять схемы закупок.
Их неотъемлемая направленность на практическое внедрение технологий, как правило, удерживала их ориентированными больше на постепенные перепроектирования и перенастройки, в отличие от революционных исследований и разработок или идей, которые могли бы быть приняты в клинической практике через много лет; однако, все больше усилий прилагается для расширения этого временного горизонта, в течение которого клинические инженеры могут влиять на траекторию биомедицинских инноваций. В своих различных ролях они образуют «мост» между основными проектировщиками и конечными пользователями, объединяя перспективы близости к точке использования, а также обучения в области продуктовой и технологической инженерии. Отделы клинической инженерии иногда нанимают не только биомедицинских инженеров, но и промышленных/системных инженеров для помощи в решении вопросов операционных исследований/оптимизации, человеческого фактора, анализа затрат и т. д. Кроме того, см. раздел «Техника безопасности» для обсуждения процедур, используемых для проектирования безопасных систем. Отдел клинической инженерии состоит из менеджера, руководителя, инженера и техника. Один инженер на восемьдесят коек в больнице — это соотношение. Клинические инженеры также уполномочены проводить аудит фармацевтических и связанных с ними складов для мониторинга отзывов инвазивных товаров FDA.

Реабилитационная инженерия — это систематическое применение инженерных наук для проектирования, разработки, адаптации, тестирования, оценки, применения и распространения технологических решений проблем, с которыми сталкиваются люди с ограниченными возможностями. Функциональные области, рассматриваемые посредством реабилитационной инженерии, могут включать мобильность, коммуникации, слух, зрение и познание, а также деятельность, связанную с трудоустройством, независимой жизнью, образованием и интеграцией в общество. [1]
В то время как некоторые инженеры по реабилитации имеют степень магистра в области реабилитационной инженерии, как правило, субспециализации биомедицинской инженерии, большинство инженеров по реабилитации имеют степень бакалавра или магистра в области биомедицинской инженерии, машиностроения или электротехники. Португальский университет предоставляет степень бакалавра и степень магистра в области реабилитационной инженерии и доступности. [6] [8] Квалификация, чтобы стать инженером по реабилитации в Великобритании, возможна через университетский курс бакалавриата с отличием, такой как Health Design & Technology Institute, Coventry University. [9]
Процесс реабилитации людей с ограниченными возможностями часто подразумевает разработку вспомогательных устройств, таких как приспособления для ходьбы, призванных способствовать включению их пользователей в общественную жизнь, торговлю и отдых.
В последние десятилетия постоянно возрастали вопросы регулирования, чтобы реагировать на многочисленные инциденты, вызванные устройствами для пациентов. Например, с 2008 по 2011 год в США было 119 отзывов FDA медицинских устройств, классифицированных как класс I. По данным Управления по контролю за продуктами и лекарствами США (FDA), отзыв класса I связан с «ситуацией, в которой существует обоснованная вероятность того, что использование или воздействие продукта вызовет серьезные неблагоприятные последствия для здоровья или смерть» [16].
Независимо от законодательства конкретной страны, основные цели регулирования совпадают во всем мире. [17] Например, в правилах по медицинским устройствам продукт должен быть: 1) безопасным и 2) эффективным и 3) подходящим для всех производимых устройств (почему эта часть удалена?)
Продукт безопасен, если пациенты, пользователи и третьи лица не подвергаются неприемлемым рискам физических опасностей (смерть, травмы, ...) при его предполагаемом использовании. Защитные меры должны быть введены на устройствах, чтобы снизить остаточные риски до приемлемого уровня по сравнению с выгодой, получаемой от его использования.
Продукт эффективен, если он работает так, как указано производителем при предполагаемом использовании. Эффективность достигается посредством клинической оценки, соответствия стандартам производительности или демонстрации существенной эквивалентности с уже представленным на рынке устройством.
Предыдущие характеристики должны быть обеспечены для всех изготовленных изделий медицинского устройства. Это требует, чтобы система качества была внедрена для всех соответствующих субъектов и процессов, которые могут повлиять на безопасность и эффективность на протяжении всего жизненного цикла медицинского устройства.
Область разработки медицинских устройств относится к наиболее строго регулируемым областям инженерии, и практикующие биомедицинские инженеры должны регулярно консультироваться и сотрудничать с юристами по регулирующему праву и другими экспертами. Управление по контролю за продуктами и лекарствами (FDA) является основным регулирующим органом здравоохранения в Соединенных Штатах, имеющим юрисдикцию в отношении медицинских устройств, лекарственных препаратов, биологических препаратов и комбинированных продуктов. Главными целями, определяющими политические решения FDA, являются безопасность и эффективность медицинских продуктов, которые должны быть обеспечены с помощью действующей системы качества, как указано в постановлении 21 CFR 829. Кроме того, поскольку биомедицинские инженеры часто разрабатывают устройства и технологии для «потребительского» использования, такие как устройства для физиотерапии (которые также являются «медицинскими» устройствами), они также могут в некоторых отношениях регулироваться Комиссией по безопасности потребительских товаров . Наибольшими препятствиями, как правило, являются «разрешение» 510K (обычно для устройств класса 2) или предпродажное «одобрение» (обычно для лекарств и устройств класса 3).
В европейском контексте эффективность безопасности и качество обеспечиваются посредством «Оценки соответствия», которая определяется как «метод, с помощью которого производитель демонстрирует, что его устройство соответствует требованиям Европейской директивы по медицинским устройствам ». Директива определяет различные процедуры в зависимости от класса устройства, начиная от простой Декларации соответствия (Приложение VII) для устройств класса I до проверки ЕС (Приложение IV), обеспечения качества производства (Приложение V), обеспечения качества продукции (Приложение VI) и полного обеспечения качества (Приложение II). Директива по медицинским устройствам определяет подробные процедуры сертификации. В общих чертах эти процедуры включают испытания и проверки, которые должны содержаться в конкретных поставках, таких как файл управления рисками, технический файл и поставки системы качества. Файл управления рисками является первым поставляемым продуктом, который обуславливает последующие этапы проектирования и производства. Этап управления рисками должен управлять продуктом таким образом, чтобы риски продукта были снижены до приемлемого уровня в отношении ожидаемых для пациентов преимуществ от использования устройства. Технический файл содержит все данные документации и записи, подтверждающие сертификацию медицинского устройства. Технический файл FDA имеет схожее содержание, хотя и организован в другой структуре. Поставляемые результаты Системы качества обычно включают процедуры, которые обеспечивают качество на протяжении всех жизненных циклов продукта. Тот же стандарт (ISO EN 13485) обычно применяется для систем управления качеством в США и во всем мире.

В Европейском союзе существуют сертифицирующие организации, называемые « Уполномоченными органами », аккредитованные государствами-членами ЕС. Уполномоченные органы должны гарантировать эффективность процесса сертификации для всех медицинских устройств, за исключением устройств класса I, для продажи которых достаточно декларации соответствия, составленной производителем. После того, как продукт прошел все этапы, требуемые Директивой о медицинских устройствах, устройство имеет право на маркировку CE , указывающую на то, что устройство считается безопасным и эффективным при использовании по назначению, и, следовательно, может продаваться на территории Европейского союза.
Различные регулирующие механизмы иногда приводят к тому, что определенные технологии разрабатываются сначала либо для США, либо для Европы в зависимости от более благоприятной формы регулирования. В то время как страны часто стремятся к существенной гармонии для содействия межнациональному распространению, философские разногласия относительно оптимальной степени регулирования могут стать помехой; более строгие правила кажутся привлекательными на интуитивном уровне, но критики осуждают компромиссную цену с точки зрения замедления доступа к спасающим жизни разработкам.
Директива 2011/65/EU, более известная как RoHS 2, представляет собой переработанный вариант законодательства, первоначально принятого в 2002 году. Первоначальное законодательство ЕС «Ограничения содержания определенных опасных веществ в электрических и электронных устройствах» (Директива RoHS 2002/95/EC) было заменено и отменено директивой 2011/65/EU, опубликованной в июле 2011 года и широко известной как RoHS 2. Директива RoHS направлена на ограничение содержания опасных веществ в электронных изделиях, в частности токсинов и тяжелых металлов, которые впоследствии выбрасываются в окружающую среду при переработке таких устройств.
Область действия RoHS 2 расширена и теперь включает ранее исключенные продукты, такие как медицинские приборы и промышленное оборудование. Кроме того, производители теперь обязаны предоставлять оценки рисков соответствия и отчеты об испытаниях – или объяснять, почему их нет. Впервые не только производители, но и импортеры и дистрибьюторы разделяют ответственность за обеспечение того, чтобы электрическое и электронное оборудование в рамках RoHS соответствовало ограничениям по опасным веществам и имело маркировку CE на своей продукции.
Новый международный стандарт IEC 60601 для электромедицинских приборов для домашнего здравоохранения, определяющий требования к приборам, используемым в домашней медицинской среде. IEC 60601-1-11 (2010) теперь должен быть включен в проектирование и проверку широкого спектра медицинских приборов для домашнего использования и оказания медицинской помощи наряду с другими применимыми стандартами серии IEC 60601 3-го издания.
Обязательной датой внедрения европейской версии стандарта EN является 1 июня 2013 года. FDA США требует применения стандарта с 30 июня 2013 года, в то время как Министерство здравоохранения Канады недавно продлило требуемую дату с июня 2012 года до апреля 2013 года. Североамериканские агентства будут требовать эти стандарты только для подачи заявок на новые устройства, в то время как ЕС применит более строгий подход, требуя, чтобы все соответствующие устройства, размещаемые на рынке, соответствовали стандарту домашнего здравоохранения.
AS/ANS 3551:2012 — австралийские и новозеландские стандарты управления медицинскими устройствами. Стандарт определяет процедуры, необходимые для поддержания широкого спектра медицинских активов в клинических условиях (например, в больнице). [18] Стандарты основаны на стандартах IEC 606101.
Стандарт охватывает широкий спектр элементов управления медицинским оборудованием, включая закупку, приемочные испытания, техническое обслуживание (испытания на электробезопасность и профилактическое обслуживание) и вывод из эксплуатации.
Биомедицинские инженеры требуют значительных знаний как в области инженерии, так и в области биологии и обычно имеют степень бакалавра (B.Sc., BS, B.Eng. или BSE) или магистра (MS, M.Sc., MSE или M.Eng.) или докторскую степень (Ph.D. или MD-PhD [19] [20] [21] ) в области BME (биомедицинской инженерии) или другой отрасли инженерии со значительным потенциалом для пересечения с BME. По мере роста интереса к BME во многих инженерных колледжах теперь есть кафедра или программа биомедицинской инженерии с предложениями от бакалавриата (B.Sc., BS, B.Eng. или BSE) до уровня докторантуры. Биомедицинская инженерия только недавно стала развиваться как отдельная дисциплина, а не как междисциплинарная гибридная специализация других дисциплин; и программы BME на всех уровнях становятся все более распространенными, включая бакалавриат наук в области биомедицинской инженерии , который включает в себя достаточно биологического научного контента, чтобы многие студенты использовали его в качестве " предмедицинской " специальности при подготовке к медицинской школе . Ожидается, что число биомедицинских инженеров будет расти как причина, так и следствие улучшений в медицинских технологиях. [22]
В США все большее число программ бакалавриата также признаются ABET в качестве аккредитованных программ по биоинженерии/биомедицинской инженерии. По состоянию на 2023 год ABET аккредитовала 155 программ. [23]
В Канаде и Австралии аккредитованные программы обучения в области биомедицинской инженерии распространены. [24] Например, Университет Макмастера предлагает степень магистра наук (MASc), степень доктора медицины/доктора философии (MD/PhD) и степень доктора философии в области биомедицинской инженерии. [25] Первая канадская программа бакалавриата BME была предложена в Университете Гвельфа как четырехлетняя программа бакалавриата по инженерным наукам. [26] Политехнический институт в Монреале также предлагает степень бакалавра в области биомедицинской инженерии [27], как и Университет Флиндерса. [28]
Как и в случае со многими степенями, репутация и рейтинг программы могут влиять на привлекательность обладателя степени для трудоустройства или поступления в аспирантуру. Репутация многих степеней бакалавра также связана с программами магистратуры или исследований учреждения, которые имеют некоторые ощутимые факторы для рейтинга, такие как финансирование исследований и объем, публикации и цитирования. В частности, в случае BME рейтинг больницы и медицинской школы университета также может быть существенным фактором в воспринимаемом престиже его отделения/программы BME.
Последипломное образование является особенно важным аспектом в BME. В то время как многие инженерные области (такие как машиностроение или электротехника) не требуют последипломного образования для получения работы начального уровня в своей области, большинство должностей BME предпочитают или даже требуют его. [29] Поскольку большинство профессий, связанных с BME, связаны с научными исследованиями, такими как разработка фармацевтических и медицинских устройств , последипломное образование является почти обязательным требованием (поскольку степени бакалавра обычно не предполагают достаточной исследовательской подготовки и опыта). Это может быть степень магистра или доктора наук; хотя в некоторых специальностях степень доктора философии встречается заметно чаще, чем в других, она едва ли когда-либо составляет большинство (за исключением академической среды). Фактически, предполагаемая потребность в каком-либо виде диплома об окончании университета настолько сильна, что некоторые программы бакалавриата BME будут активно отговаривать студентов от специализации в BME без явного намерения также получить степень магистра или поступить в медицинскую школу впоследствии.
Программы магистратуры в BME, как и в других научных областях, весьма разнообразны, и отдельные программы могут подчеркивать определенные аспекты в рамках области. Они также могут включать обширные совместные усилия с программами в других областях (например, с университетской медицинской школой или другими инженерными подразделениями), опять же из-за междисциплинарного характера BME. Программы MS и Ph.D. обычно требуют от кандидатов наличия степени бакалавра в BME или другой инженерной дисциплине (плюс определенные курсы по наукам о жизни) или наукам о жизни (плюс определенные курсы по инженерии).
Образование в области BME также сильно различается по всему миру. Благодаря своему обширному сектору биотехнологий, многочисленным крупным университетам и относительно небольшому количеству внутренних барьеров США значительно продвинулись в развитии возможностей образования и обучения в области BME. Европа, которая также имеет большой сектор биотехнологий и впечатляющую систему образования, столкнулась с трудностями в создании единых стандартов, поскольку европейское сообщество пытается вытеснить некоторые из национальных юрисдикционных барьеров, которые все еще существуют. Недавно появились такие инициативы, как BIOMEDEA, для разработки образовательных и профессиональных стандартов, связанных с BME. [30] Другие страны, такие как Австралия, признают и принимают меры для исправления недостатков в своем образовании в области BME. [31] Кроме того, поскольку высокие технологии обычно являются признаками развитых стран, некоторые регионы мира склонны к более медленному развитию образования, в том числе в области BME.
Как и в случае с другими профессиями, требующими обучения, в каждом штате есть определенные (довольно схожие) требования для получения лицензии зарегистрированного профессионального инженера (PE), но в США в промышленности такая лицензия не требуется для работы инженером в большинстве ситуаций (из-за исключения, известного как промышленное исключение, которое фактически применяется к подавляющему большинству американских инженеров). Модель США, как правило, требовала только от практикующих инженеров, предлагающих инженерные услуги, которые влияют на общественное благосостояние, безопасность, охрану жизни, здоровья или имущества, иметь лицензию, в то время как инженеры, работающие в частной промышленности без прямого предложения инженерных услуг населению или другим предприятиям, образованию и правительству, не должны иметь лицензию. Это, в частности, не относится ко многим другим странам, где лицензия так же необходима для инженерной практики, как и для юриспруденции или медицины.
Биомедицинская инженерия регулируется в некоторых странах, например, в Австралии, но регистрация обычно только рекомендуется, а не обязательна. [32]
В Великобритании инженеры-механики, работающие в области медицинской инженерии, биоинженерии или биомедицинской инженерии, могут получить статус дипломированного инженера через Институт инженеров-механиков . Институт также управляет Отделом инженерии в медицине и здравоохранении. [33] Институт физики и инженерии в медицине (IPEM) имеет комиссию по аккредитации курсов магистратуры по биомедицинской инженерии, а статус дипломированного инженера также можно получить через IPEM.
Экзамен по основам инженерии — первый (и более общий) из двух экзаменов на получение лицензии для большинства юрисдикций США — теперь охватывает биологию (хотя технически не BME). Для второго экзамена, называемого Principles and Practices, Part 2, или экзаменом Professional Engineering, кандидаты могут выбрать содержание конкретной инженерной дисциплины для тестирования; в настоящее время нет возможности для BME с этим, что означает, что любые биомедицинские инженеры, желающие получить лицензию, должны подготовиться к сдаче этого экзамена в другой категории (что не влияет на фактическую лицензию, поскольку большинство юрисдикций в любом случае не признают специализации дисциплин). Однако Общество биомедицинской инженерии (BMES) с 2009 года изучает возможность внедрения версии этого экзамена, специфичной для BME, чтобы облегчить получение лицензии биомедицинскими инженерами.
Помимо государственной регистрации, некоторые частные профессиональные/промышленные организации также предлагают сертификации с различной степенью известности. Одним из таких примеров является сертификация Certified Clinical Engineer (CCE) для клинических инженеров.
В 2012 году в США работало около 19 400 инженеров-биомедиков, и прогнозировалось, что эта область вырастет на 5% (быстрее среднего) с 2012 по 2022 год. [34] В биомедицинской инженерии самый высокий процент женщин-инженеров по сравнению с другими распространенными инженерными профессиями.